
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
В основе метода лежит реакция: H+ + OH- = H2O.
Этим методом можно определять неорганические, органические и биологические вещества, обладающие кислотно-основными свойствами. В органических и биологических веществах можно определять некоторые важные элементы, например, N, C, S и др. Для этого определяемый элемент переводят в неорганическую кислоту или основание, которые затем могут быть оттитрованы.
Основными рабочими растворами в этом методе являются кислоты (чаще HCl или H2SO4) или щёлочи (обычно NaOH или KOH).
Если рассмотреть основную реакцию метода нейтрализации, то можно предположить, что в точке эквивалентности должна быть нейтральная среда. Однако, это не всегда так.
NaOH + HCl = NaCl + H2O – нейтральная, рН=7,
NaOH + CH3COOH = CH3COONa + H2O – щелочная, рН>7,
NH4OH + HCl = NH4Cl + H2O – кислотная, рН<7.
Если кислота и основание сильные, то среда в момент эквивалентности будет нейтральная.
Если же соль образована слабой кислотой или слабым основанием, то в момент эквивалентности, вследствие гидролиза соли, среда будет щелочная или кислотная.
Следовательно, в разных случаях титрование приходится заканчивать при различных значениях рН, зависящих от природы реагирующих между собой кислоты и основания, а также от их концентраций.
Для точного определения конца реакции необходимо правильно выбрать индикатор. Чтобы правильно выбрать индикатор нужно знать, как происходит изменение кислотности или основности раствора в процессе нейтрализации. Для этого рассчитывают рН в различные моменты титрования.
В качестве рабочих используются растворы сильных кислот (HCl, H2SO4 и др.) концентрации от 0,05 до 1,0 моль/л или сильных оснований (NaOH, KOH, Ba(OH)2 и др.) той же концентрации. Растворы кислот устойчивы и могут храниться без изменения сколь угодно долго. Растворы щелочей также устойчивы, но их рекомендуется хранить во фторопластовой посуде, чтобы не допустить взаимодействия со стеклом. Необходимо также учитывать, что растворы щелочей поглощают CO2 из воздуха.
Растворы кислот и щелочей стандартизуют по одному из первичных установочных веществ: Na2CO3, Na2B4O7×10H2O (для кислот), гидрофталату калия, H2C2O4×2H2O, C6H5COOH и т.д. (для щелочей). Значительно сокращает затраты времени на приготовление титрованных растворов применение специальных ампул, выпускаемых промышленностью (фиксаналов).
8. Расчёт кривых титрования сильной кислоты сильным основанием, слабой кислоты сильным основанием, слабого основания сильной кислотой.
1. Титрование сильной кислоты сильным основанием HCl + NaOH = NaCl + H2O.
Предположим, что для определения взяли 10 мл НСl и на титрование её пошло 8,00 мл NaOH с концентрацией 0,10 моль/л. По закону эквивалентов
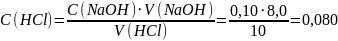 моль/л
моль/л
Таблица 1 - Изменение рН при титровании раствора НСl раствором NaOH
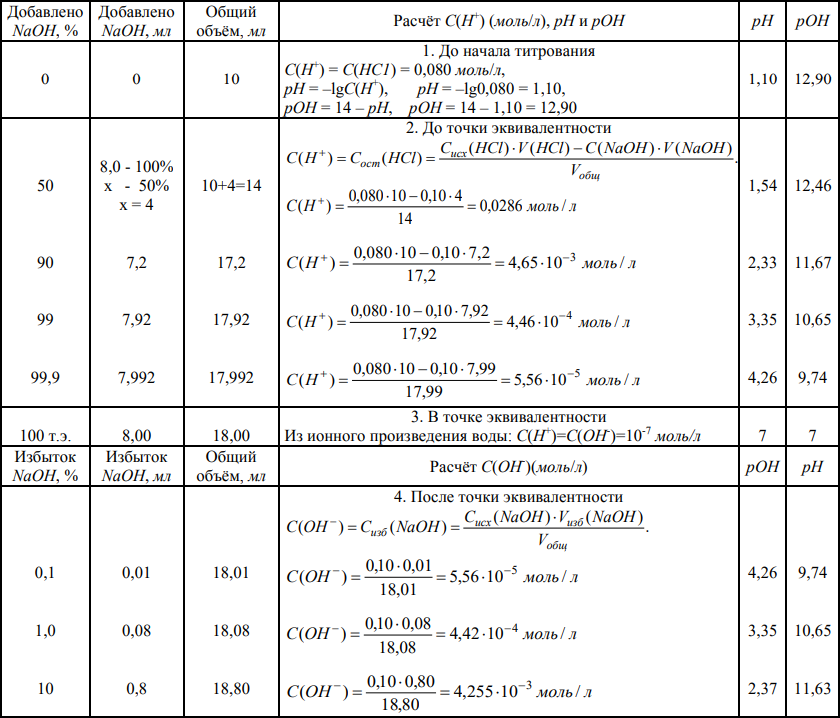
Данные таблицы представим графически (рис. 1). Графическое изображение зависимости рН р-ра от объёма прибавленного титранта наз. кривой титрования.

Рисунок 1 – Кривая титрования раствора НСl раствором NaOH
2. Титрование слабых кислот сильными основаниями CH3COOH + NaOH = CH3COONa + H2O.
Предположим, возьмём для титрования 100 мл 0,10 моль/л раствора CH3COOH и оттитруем её 100 мл раствора NaOH. K(CH3COOH) = 1,74.10-5.
По закону эквивалентов
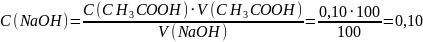 моль/л
моль/л
Таблица 2 - Изменение рН при титровании раствора CH3COOH раствором NaOH

