
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
5 . Буферные растворы. Расчет рН буферных растворов.
Буферные растворы (буферные смеси) – растворы слабой кислоты (основания) и сопряженного с ней основания (кислоты). Они обладают свойством сохранять постоянную концентрацию ионов Н+ при добавлении небольших количеств сильной кислоты или сильного основания, а также при разбавлении водой.
Расчет рН буферных растворов:
1) Сильные к-ты и основания – р-ры диссоциируют практически полностью, поэтому конц-я ионов водорода и конц-я гидроксильных ионов для разбавленных р-ров всегда равна их аналитической конц-ии.
Например: c(HCl) = 0,1 моль/л; pH = ?
Решение: c(H+) = c(HCl) = 0,1 моль/л; .
Например: c(NaOH) = 0,25 моль/л; pH = ?
Решение:
;
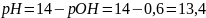 .
.
2) Слабые к-ты и основания – мало распадаются на составляющие их ионы. Степень их диссоциации определяется константой диссоциации.
Например:
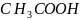 ⇆
⇆
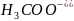 +
+
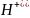 ;
;
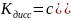 .
.
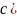 ,
поэтому
,
поэтому
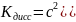 ⇒
.
Прологарифмируем:
⇒
.
Прологарифмируем:
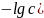 ;
;
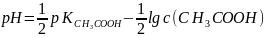 ;
;
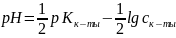 .
.
Аналогично для
слабого основания выводится
 :
:
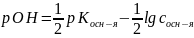 ;
;
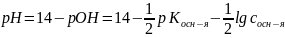 ;
;
6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Соль сильной кислоты и сильного основания гидролизу не подвергается, рН = 7
Соль слабой кислоты и сильного основания, рН > 7
Пример: ацетат натрия CH3COONa (см.ниже)
Соль сильной кислоты и слабого основания, рН < 7
Пример: хлорид алюминия AlCl3 (см. ниже)
Соль слабой кислоты и слабого основания – рН зависит от соотношения констант диссоциации кислоты и соли. Иногда происходит необратимый гидролиз.
Расчёт рН гидролизующихся солей (?):
рН в растворе гидролизующейся соли определяется природой слабого электролита. При гидролизе соли, образованной сильным основанием и слабой кислотой, гидролизуется анион слабой кислоты. В растворе появляются ионы ОН, поэтому среда щелочная, рН > 7.
 ,
(2.17)
,
(2.17)
Если соль, образована слабым основанием и сильной кислотой, то гидролизуется катион слабого основания:
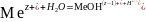 ,
(2.18)
,
(2.18)
в растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
Гидролиз является обратимым процессом и имеет ступенчатый характер. Термодинамической характеристикой гидролиза является его константа равновесия – константа гидролиза.
Константу гидролиза проще всего вычислить через значение константы диссоциации слабого электролита по уравнению:
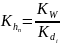 ,
(2.19)
,
(2.19)
Первой константе гидролиза соответствует последняя константа диссоциации, последней константе гидролиза – первая константа диссоциации, в чем нетрудно убедиться, сравнивая состав (по кислотным остаткам) реакций диссоциации и гидролиза для фосфорной кислоты:

Обычно константа гидролиза по второй ступени во много раз меньше, чем по первой. По третьей ступени константа диссоциации еще во столько же раз ниже. Поэтому при расчетах рН обычно учитывают только первую ступень гидролиза, пренебрегая последующими его ступенями. Ионная сила раствора гидролизующейся соли в этом случае может быть вычислена без учета реакции гидролиза по концентрации соли.
В случае гидролиза по аниону (2.17) константа равновесия запишется следующим образом:
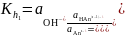 (2.24)
(2.24)
где
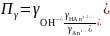 – произведение коэффициентов активности.
– произведение коэффициентов активности.
Концентрация ионов
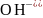 вычисляется по уравнению:
вычисляется по уравнению:
, (2.25)
где Сi – моляльная концентрация гидролизующегося иона.
При гидролизе по катиону (2.18) константа равновесия запишется следующим образом:
 (2.26)
(2.26)
где
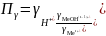 – произведение коэффициентов активности.
– произведение коэффициентов активности.
Концентрация катионов водорода вычисляется по уравнению:
. (2.27)
