
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
https://sdo.srspu.ru/pluginfile.php/682628/mod_resource/content/1/Qulonometriya.pdf
В методе кулонометрического титрования определяемое вещество не принимает участие в электрохимической реакции, протекающей непосредственно на электроде. В ходе реакции на электроде генерируется промежуточный реагент (титрант), реагирующий с определяемым веществом. Реакции реагента с определяемым веществом обычно относятся к типу редокс-реакций, однако это могут быть и кислотно-основные взаимодействия.

Различают прямую (первичную) кулонометрию, когда в электродной реакции участвует только определяемое вещество, электрохимически активное до конца электролиза, и косвенную кулонометрию (кулонометрическое титрование), когда используют электрохимически активный вспомогательный реагент, продукт превращения которого (кулонометрический титрант) химически взаимодействует с определяемым компонентом. По технике выполнения кулонометрию подразделяют на потенциостатическую (кулонометрия при контролируемом потенциале) и амперостатическую (гальваностатическую).
37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
1) титрант не нужно готовить, стандартизировать и хранить;
2) можно получать титранты (например, Fe2+ или Cl2), которые сложно или невозможно приготовить обычным способом;
3) титрант легче «дозируется» (отрегулировать силу тока значительно легче, чем добавить точный объём титранта);
4) раствор в процессе титрования не разбавляется;
5) в процессе предэлектролиза можно устранить мешающее влияние примесей;
6) одну и ту же ячейку можно использовать для любого вида титрования;
7) процесс анализа можно легко автоматизировать.
38. Реакции, протекающие в анодном и катодном пространстве при определении тиосульфат-ионов, кислот.


39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).

40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.

Для тех, кто на «отлично»:
41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
https://sdo.srspu.ru/pluginfile.php/682634/mod_resource/content/1/Opticheskie%20metodi%20analiza.pdf
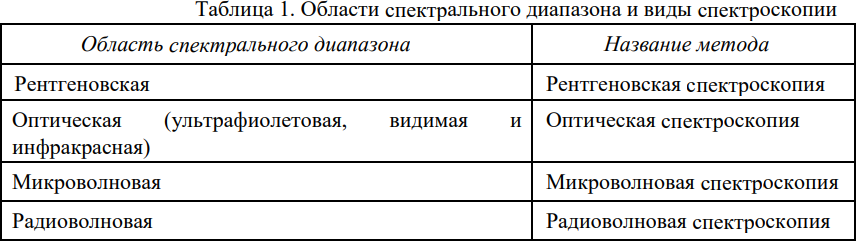
Спектроскопические методы анализа основаны на взаимодействии электромагнитного излучения с веществом. Современная спектроскопия базируется на квантовой теории. Аналитический сигнал можно получать в разных областях спектрального диапазона. В зависимости от этого различают 4 вида спектроскопии (табл.1).
Взаимодействие электромагнитного, т.е. рентгеновского и γ-излучения с веществом может иметь четыре механизма: когерентное рассеяние, некогерентное рассеяние или эффект Комптона, фотоэффект и процесс образования пар электрон-позитрон. В отдельных случаях γ-фотоны с очень высокой энергией могут вызвать фотоядерную реакцию, при которой ядро поглощает γ-квант и испытывает радиоактивный распад.
При взаимодействии с веществом одновременно работают все четыре механизма, приводящие к ионизации и возбуждению атомов среды. Однако, вклад этих механизмов в протекание первичных процессов зависит от энергии ε = hν квантов электромагнитного излучения.
Когерентное рассеяние возникает, если ε = hν < Аi. При этом, вещество излучает электромагнитные волны той же длины, что и поглощённые.
Фотоэффект:
ε = hν ≥ Аi
– внутренний электрон атома полностью
поглощает квант электромагнитного
излучения и покидает атом с некоторой
скоростью
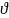 :
:
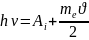 .
После этого возникает характеристическое
рентгеновское излучение. Этот процесс
в биотканях характерен для квантов с ε
< 0,1 МэВ. Вылетевшие из атома электроны
могут производить в биотканях вторичную
ионизацию.
.
После этого возникает характеристическое
рентгеновское излучение. Этот процесс
в биотканях характерен для квантов с ε
< 0,1 МэВ. Вылетевшие из атома электроны
могут производить в биотканях вторичную
ионизацию.
Эффект Комптона
наиболее вероятен для квантов с энергией
ε ~ 1 ÷ 2 МэВ. Некогерентное рассеяние
обусловлено взаимодействием квантов
электромагнитного излучения hν
с внешними слабо связанными с ядром
электронами. В результате, часть энергии
кванта передаётся этому электрону, и
он покидает атом со скоростью
.
Кроме того, рождается новый квант
электромагнитного излучения hν'
с меньшей
энергией –
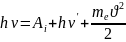 .
Изменение длины волны излучения
определяется формулой Комптона:
.
Изменение длины волны излучения
определяется формулой Комптона:
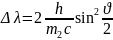 . (11)
. (11)
Возможны вторичные
эффекты ионизации и возбуждения под
воздействием квантов
 и выбитого электрона.
и выбитого электрона.
Образование электрон-позитронных пар возможно только для квантов с энергией не менее удвоенной энергии покоя β-частиц. Т.к. Е0,β = 0,51МэВ, то ε ≥ 1,02 МэВ. Однако, реально в тканях этот процесс будет иметь преобладающее значение при энергии квантов ε ~10 МэВ. И в этом случае возможны вторичные эффекты ионизации и возбуждения атомов вещества.
Учитывая, что рентгеновское излучение – это электромагнитные волны с λ = 10-4 ÷ 80 нм и ε = 20 эВ ÷ 1 МэВ, то для него преобладающим при взаимодействии будет когеретное рассеяние, фотоэффект и эффект Комптона.
γ-излучение имеет λ = 10-5 ÷ 10-1нм и ε = 0,20 ÷ 3,0 МэВ – т.е. для γ-излучения будут иметь место процессы фотоэффекта, некогерентного рассеяния и образования электрон-позитронных пар.
В целом, электромагнитное излучение в воздухе имеет длину пробега порядка сотен метров, и на всем пути образуется всего от 10 до 250 пар ионов. В жидкостях и тканях пробег электромагнитного излучения составляет десятки сантиметров, и даже метры.
Ослабление пучка
рентгеновского и γ-излучения описывается
экспоненциальным законом, причём
линейный коэффициент поглощения для
рентгеновского излучения:
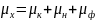 ,
а для γ-излучения:
,
а для γ-излучения:
 в законе
в законе
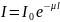 .
Величины μк,
μн,
μф
и μа определяют
вклад когерентного и некогерентного
рассеяния, явления фотоэффекта и
аннигиляции в значение коэффициента
поглощения μ. Для γ-излучения высоких
энергий этот закон выполняется весьма
приблизительно, т.к. не учитывает
вторичных эффектов: аннигиляцию
родившихся пар и возникновение новых
γ-квантов.
.
Величины μк,
μн,
μф
и μа определяют
вклад когерентного и некогерентного
рассеяния, явления фотоэффекта и
аннигиляции в значение коэффициента
поглощения μ. Для γ-излучения высоких
энергий этот закон выполняется весьма
приблизительно, т.к. не учитывает
вторичных эффектов: аннигиляцию
родившихся пар и возникновение новых
γ-квантов.
