
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
К окислителям в йодометрии относятся хроматы, хлор, бром, медь (II), железо (III) и др. Определение их ведут титрованием заместителя.
Окислитель выделяет
из йодида в эквивалентном количестве
свободный йод, который в свою очередь
эквивалентен израсходованному на
титрование тиосульфату натрия. Это
можно представить так:
![]()
Определение меди (II) йодометрически широко применяется при анализе сплавов и руд. Оно основано на следующей реакции:

Медь при восстановлении
выделяет эквивалентное количество
свободного йода. Стандартный потенциал
системы меди
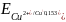 B, a йода
B, a йода
 B. Судя по этим величинам, роль окислителя
должна играть система I2/2I- , а не система
Cu2+/Cu+ , как это есть на самом деле. На
направление реакции оказывает влияние
потенциал, который возникает в процессе
протекания реакции и выражается
уравнением Нернста:
B. Судя по этим величинам, роль окислителя
должна играть система I2/2I- , а не система
Cu2+/Cu+ , как это есть на самом деле. На
направление реакции оказывает влияние
потенциал, который возникает в процессе
протекания реакции и выражается
уравнением Нернста:
![]()
Образующиеся в результате реакции ионы Сu+, c ионами I- дают трудно растворимый осадок СuI, вследствие чего концентрация Cu+ в растворе становится ничтожно малой, a отношение С(Сu2+)/C(Cu+) и весь второй член уравнения резко возрастают. Величина потенциала становится значительно больше стандартного потенциала системы меди и превышает потенциал системы йода. Реакция идёт до конца слева направо. В результате подкисления раствора С(Сu2+) увеличивается, а это тоже повышает потенциал системы меди.
Для уменьшения потенциала системы I2/2I- берут большой избыток KI.
Определение восстановителей
В йодометрии определение восстановителей можно производить непосредственным титрованием раствором йода, но лучше они определяются методом обратного титрования, который заключается в следующем: к восстановителю добавляют определённый объём титрованного раствора йода, заведомо избыточное количество. Часть йода вступает в реакцию с эквивалентным количеством восстановителя, что можно выразить как n(1/z восстановителя) = n(1/2 I2). Непрореагировавший йод оттитровывают тиосульфатом натрия.
Применение при определении восстановителей большого избытка йода повышает потенциал системы I2/2I-.
27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.


28. Йодометрическое определение органических веществ.

29. Особенности и области применения инструментальных методов анализа.
Инструментальные методы позволяют проводить дистанционный анализ или анализ на расстоянии. Ярким примером является дистанционные анализы лунной поверхности, проведённые советской автоматической станцией "Луна – 10" ещё в 1966 году. На стации был установлен гамма-спектрометр, с помощью которого удалось получить первые сведения о содержании радиоактивных элементах в породах Луны. На "Луноходе - 1", а затем на "Луноходе - 2" были установлены приборы для рентгенофлуоресцентного анализа лунного грунта.
Многие приборы, используемые в инструментальных методах анализа, позволяют автоматизировать сам процесс анализа или некоторые его стадии. Автоматические газоанализаторы контролируют состав воздуха в шахтах. Автоматизирован хроматографический анализ. Созданы автоматизированные станции для контроля качества воды.
С помощью некоторых инструментальных методов анализ может быть выполнен без разрушения анализируемого образца (недеструктивный анализ), что имеет большое значение для некоторых отраслей промышленности, криминалистики, медицины, при анализе произведений искусства. Недеструктивный анализ выполняют рентгенофлуоресцентным, радиоактивным и некоторыми другими методами анализа.
Погрешность анализа инструментальными методами составляет в среднем 2 - 5%, что превышает погрешность химических методов анализа. Однако такое сравнение погрешностей не вполне корректно, т.к. относится к разным содержаниям к разным концентрационным областям.
Достоинства инструментальных методов анализа:
1. Низкий предел обнаружения (10-5 – 10-19 %). 2. Экспрессность (быстрота) анализа. 3. Возможность проведения дистанционного анализа.
4. Возможность автоматизации процесса анализа. 5. Возможность выполнения анализа без разрушения анализируемого образца.
6. Возможность проведения локального анализа. 7. Возможность использования ЭВМ при проведении анализа.
Недостатки инструментальных методов:
1. Погрешность 2-5%. 2. Необходимость использования эталонов, стандартных растворов, градуировочных графиков.
