
- •1. Титриметрический метод анализа. Сущность метода. Классификация титриметрических методов анализа.
- •2. Международная система единиц (си). Основные физические величины и формулы для расчёта, применяемые в количественном анализе.
- •3. Способы титрования. Расчёты в титриметрическом методе по результатам титрования.
- •5 . Буферные растворы. Расчет рН буферных растворов.
- •6. Понятие гидролиза. Расчёт рН гидролизующихся солей.
- •Расчёт рН гидролизующихся солей (?):
- •7. Сущность метода кислотно-основного титрования. Рабочие растворы. Приготовление и стандартизация рабочих растворов.
- •3. Титрование слабого основания сильной кислотой
- •Выводы по кривым нейтрализации
- •9. Индикаторы (понятие). Требования, предъявляемые к индикаторам. Кислотно-основные индикаторы.
- •10. Интервал перехода окраски кислотно-основных индикаторов. Выбор индикатора.
- •11. Сущность методов комплексообразовательного титрования. Комплексонометрия.
- •12. Понятие о комплексонах. Механизм взаимодействия комплексона с ионами металлов.
- •14. Механизм действия металлохромных индикаторов (на примере эриохромчёрного т).
- •15. Расчёт кривых комплексонометрического титрования. Выбор индикатора.
- •16. Способы титрования, применяемые в комплексонометрии.
- •17. Повышение селективности комплексонометрических определений. (из тетради)
- •18. Оксидиметрия. Сущность метода. Окислительно-восстановительные потенциалы и направление реакции.
- •19. Индикаторы, применяемые в окислительно-восстановительном титровании. Выбор индикатора. (тетрадь)
- •20. Расчёт кривых окислительно-восстановительного титрования.
- •21. Перманганатометрия. Сущность метода. Рабочие растворы. (смотри тетрадь и лабу 3)
- •22. Перманганатометрическое определение восстановителей и окислителей.
- •23. Перманганатометрическое определение веществ, не обладающих окислительно-восстановительными свойствами.
- •24. Перманганатометрическое определение органических соединений.
- •25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
- •26. Йодометрическое определение окислителей и восстановителей. (см. Лабу 4)
- •Определение восстановителей
- •27. Йодометрическое определение веществ, не проявляющих окислительно-восстановительных свойств.
- •28. Йодометрическое определение органических веществ.
- •29. Особенности и области применения инструментальных методов анализа.
- •30. Сущность потенциометрических методов анализа.
- •31. Электроды сравнения. Устройство и уравнение потенциала для хлоридсеребряного электрода. (лаба 5)
- •32. Металлические индикаторные электроды.
- •33. Электроды с жесткой матрицей, с кристаллической мембраной.
- •34. Прямая потенциометрия. Общая характеристика метода. Приемы, используемые в прямой потенциометрии для определения концентрации вещества. (лаба 5)
- •35. Определение точки эквивалентности в потенциометрическом титровании.
- •36. Сущность кулонометрии; вывод уравнения для объединенного закона Фарадея, условия проведения прямой и косвенной кулонометрии.
- •37. Достоинства кулонометрического титрования перед другими титриметрическими методами.
- •39. Прямая потенциостатическая кулонометрия (применение, схема установки, теоретические основы).
- •40. Косвенная амперостатическая кулонометрия. Схема установки. Сущность метода.
- •Для тех, кто на «отлично»:
- •41. Спектроскопические методы анализа. Электромагнитное излучение и его взаимодействие с веществом.
- •42. Спектроскопические методы анализа. Электромагнитный спектр.
- •44. Молекулярно-абсорбционная спектроскопия. Основные узлы приборов для молекулярно-абсорбционных методов анализа.
- •45. Явление фотоэффекта. Основные законы Столетова.
- •48. Атомно-абсорбционная спектроскопия. Основные положения метода.
- •49. Схема атомно-абсорбционного спектрофотометра. Основные узлы.
- •50. Атомно-эмиссионная спектроскопия (пламенная эмиссионная спектроскопия). Основные положения метода.
24. Перманганатометрическое определение органических соединений.
Отличительной особенностью реакций органических веществ с KMnO4 является их малая скорость, однако определение возможно, если использовать обратный способ титрования.
Анализируемое
соединение предварительно обрабатывают
избытком
щелочного раствора перманганата.
При этом MnO4
переходит в
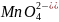 (ион марганцовистой кислоты -
(ион марганцовистой кислоты -
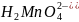 )
MnO4
+ е =
,
а органические соединения обычно
окисляются до карбоната.
)
MnO4
+ е =
,
а органические соединения обычно
окисляются до карбоната.
По окончании
реакции восстановления перманганата,
в щелочной среде, раствор
подкисляют
и титруют
остаток перманганата
раствором железа (II) или другим подходящим
восстановителем (например,
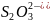 ).
).
Так определяют метанол, который в щелочной среде окисляют перманганатом калия по схеме:
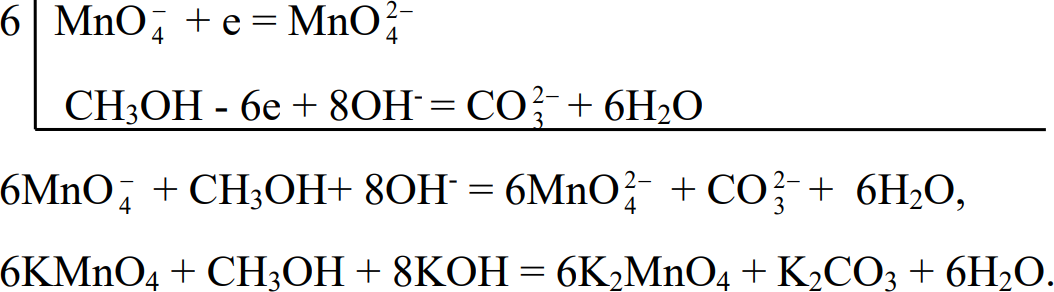
Этим методом можно определить также, муравьиную, винную, лимонную, салициловую и др. кислоты, а также глицерин, фенол и формальдегид.
25. Йодометрия. Сущность метода. Рабочие растворы. Способы фиксирования точки эквивалентности.
Йодометрический метод анализа основан на окислительно-восстановительных процессах, связанных с восстановлением I2 до I--ионов или с окислением I--ионов до I2:
![]()
Йод, выделившийся
в результате окисления йодид-ионов,
титруют тиосульфатом натрия:
![]()
Стандартный потенциал I2/2I- равен 0,54 В. Те вещества, потенциал которых больше 0,54 В окисляют ионы I- по уравнению (2). К таким окислителям относятся KMnO4, K2Cr2O7, Cl2 и др. Те вещества, у которых потенциал меньше 0,54 В окисляются йодом по уравнению (1). К таким восстановителям относятся Na2S2O3, SnCl2, Na2SO3, Na2S и др.
Для того чтобы
наиболее полно прошла реакция между
ионами йода и окислителем, необходимо
потенциал системы окислителя увеличивать,
а потенциал системы I2/2I-
уменьшать. Если окислителем являются
ионы, содержащие кислород (MnO4-
, Cr2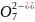 ,
As
,
As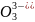 и др.), то реакцию необходимо вести в
кислотной среде, т.к. с увеличением
концентрации ионов Н+
потенциалы таких систем увеличиваются.
и др.), то реакцию необходимо вести в
кислотной среде, т.к. с увеличением
концентрации ионов Н+
потенциалы таких систем увеличиваются.
Потенциал системы
I2/2I-
не зависит от концентрации ионов Н+,
а зависит от соотношения концентраций
окисленной и восстановленной форм. Это
видно и уравнения Нернста:
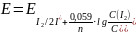
Чтобы понизить потенциал системы I2/2I-, нужно увеличить концентрацию ионов I- и уменьшить концентрацию I2.
Т. о., при определении окислителей необходимы следующие условия:
1. Кислотная среда. 2. Избыток ионов йода (I-). 3. Уменьшение концентрации свободного йода.
Для того чтобы наиболее полно прошла реакция между свободным йодом и восстановителем, необходимо потенциал системы восстановителя уменьшить, а потенциал системы I2/2I- увеличить. Для уменьшения потенциала системы восстановителя, содержащего кислород, нужно уменьшить концентрацию ионов Н+, т. е. вести реакцию в щелочной среде. Чтобы увеличить потенциал системы I2/2I-, нужно увеличить концентрацию I2 и уменьшить концентрацию I-.
Т. о., при йодометрическом определении восстановителей необходимы следующие условия:
1. Щелочная среда (но не больше рН 8). 2. Отсутствие избытка ионов йода (I-). 3. Избыток свободного йода.
Рабочими растворами в йодометрии являются растворы Na2S2O3 и I2. Высокая чувствительность йодокрахмальной реакции позволяет применять концентрации от 0,1 до 0,01 моль/л. Приготовить титрованный раствор тиосульфата по навеске нельзя, так как он изменяет свой титр, особенно в первое время после приготовления. Изменение концентрации раствора тиосульфата происходит по нескольким причинам.
Способы фиксирования точки эквивалентности:
1) С помощью индикаторов 2) Потенциометрия 3) С помощью pH-метров 4) Электрическая проводимость
5) Изменение цвета 6) Осаждение 7) Изотермическое калориметрическое титрование 8) Термометрическая титриметрия
