
- •Практикум по токсикологической химии
- •Часть I
- •Введение
- •Настоящее пособие построено на основе материалов, используемых при проведении практических работ по токсикологической химии студентов заочного отделений фармацевтического факультета двгму.
- •Тема 1 хта группы веществ, изолируемых минерализацией («металлические яды»)
- •Раздел 1. Изолирование «металлических» ядов из биологического материала
- •1.1. Минерализация биологического материала смесью
- •1.2. Минерализация биологического материала смесью серной, азотной и хлорной кислот (метод Каана)
- •1.3. Денитрация минерализата
- •1.4. Минерализация перекисью водорода и концентрированной серной кислотой
- •1.5. Метод сухого озоления
- •1.6. Метод сплавления
- •1.7. Деструкция на ртуть
- •1.8. Подготовка минерализата к анализу.
- •Тестовые задания
- •Раздел 2. Дробный метод анализа « металлических» ядов
- •2.1. Качественные реакции на катионы металлов
- •2.1.1. Качественное обнаружение иона свинца
- •2.1.2. Качественное обнаружение иона бария
- •2.1.3. Качественное обнаружение иона марганца
- •2.1.4. Качественное обнаружение иона хрома
- •2.1.5. Качественное обнаружение иона серебра
- •2.1.6. Качественное обнаружение иона меди
- •2.1.7. Качественное обнаружение иона цинка
- •2.1.8. Качественное обнаружение иона висмута
- •2.1.9. Качественное обнаружение ионов сурьмы
- •2.1.10. Качественное обнаружение ионов таллия
- •2.1.11. Качественное обнаружение иона кадмия
- •2.1.12. Качественное обнаружение иона мышьяка
- •Контрольные вопросы
- •Тестовые задания
- •Тема 2 хта группы веществ, изолируемых дистилляцией ( «летучие» яды)
- •Раздел 1 . Микродиффузия
- •1.1. Определение этилового спирта методом микродиффузии
- •1.2. Обнаружение формальдегида
- •1.3. Обнаружение ацетона
- •1.4. Обнаружение фенолов
- •Раздел 2. Изолирование «летучих» ядов дистилляцией с водяным паром
- •Раздел 3. Химический анализ «летучих» ядов
- •3.1.Качественное обнаружение синильной кислоты
- •3.2. Качественное обнаружение галогенпроизводных алифатического ряда (хлороформа и хлоралгидрата)
- •3.3. Качественное обнаружение формальдегида
- •3.4. Качественное обнаружение метилового спирта
- •3.5. Качественное обнаружение изоамилового спирта
- •3.6. Качественное обнаружение этилового спирта
- •3.7. Качественное обнаружение ацетона
- •3.8. Качественное обнаружение этиленгликоля
- •3.9. Качественное обнаружение уксусной кислоты
- •3.10. Качественное обнаружение фенола
- •2. Реакция образования трибромфенола
- •4. Реакция Либермана
- •3.11. Качественное обнаружение анилина
- •3.12. Количественное фотоколориметрическое определение формальдегида в дистилляте. В основу этого метода положена способность формальдегида образовывать окрашенный продукт с фуксинсернистой кислотой.
- •Раздел 4. Гжх метод анализа «летучих» ядов
- •4.1.Гжх определение спиртов алифатического ряда алкилнитритным методом.
- •4.1.1.Качественное определение.
- •4.1.2.Количественный анализ
- •4.2. Методика гжх-анализа « летучих» ядов Международного совета по систематическому химико-токсикологическому анализу
- •4.3. Методика гжх-анализа «летучих» ядов Московского городского бсмэ.
- •Контрольные вопросы
- •Тестовые задания
- •Тз 15. Общая реакция для обнаружения ацетона и этанола
- •Тема 3 Группа веществ, изолируемых водой с последующей очисткой диализом
- •Раздел 1. Изолирование кислот, оснований и солей из биологического материала
- •Раздел 2.Качественное определение кислот, щелочей и солей
- •2.1. Качественное определение соляной кислоты
- •2.2. Качественное определение азотной кислоты
- •2.3. Качественное определение серной кислоты
- •2.4. Качественное определение кон
- •2.5. Качественное определение NaOh
- •2.6. Качественное определение аммиака
- •2.7. Качественное обнаружение нитритов
- •Контрольные вопросы
- •Тестовые задания
- •Тема 4 Группа веществ, не требующих изолирования. Химико-токсикологический анализ на угарный газ
- •Раздел 1. Качественный анализ на угарный газ
- •1.1. Химический метод.
- •1.2. Метод микродиффузии.
- •1.3. Спектроскопический метод
- •Раздел 2.Количественное определение карбоксигемоглобина в крови
- •2.1.Спектрофотометрический метод
- •Контрольные вопросы
- •Тестовые задания
- •Список литературы
- •Оглавление
- •Тема 1.Хта группы веществ, изолируемых минерализацией
- •Раздел 1. Изолирование «металлических» ядов из биологического материала……………………………………………………………………..9
- •Раздел 2.Дробный метод анализа «металлических» ядов………….17
- •Раздел 4.Гжх метод анализа «летучих» ядов………………………..50
- •Тема 3. Группа веществ, изолируемых водой с последующей очисткой диализом………………………………………………………………..56
- •Раздел 1. Изолирование кислот, оснований и солей из биологического материала…………………………………………………………….57
- •Раздел 2. Качественное определение кислот, щелочей и солей….58
- •Тема 4. Группа веществ, не требующих изолирования. Химико-токсикологический анализ на угарный газ……………………………...63
- •Раздел 1.Качественный анализ на угарный газ……………………….64
- •Раздел 2. Количественное определение карбоксигемоглобина в крови………………………………………………………………………………66
Раздел 3. Химический анализ «летучих» ядов
3.1.Качественное обнаружение синильной кислоты
Реакция с пикриновой кислотой
К 1 мл щелочного дистиллята добавляют 1 мл 0,5% раствора пикриновой кислоты и слегка нагревают на водяной бане. При наличии цианидов раствор приобретает красную окраску.

Реакция образования берлинской лазури
К части дистиллята (щелочной раствор) добавляют 1-3 капли 40% раствора сульфата железа (II), содержащего следы сульфата железа (III). Смесь взбалтывают, нагревают до кипения, охлаждают и добавляют 10% раствор HCl до слабокислой реакции. Появление синего окрашивания, а затем синего осадка указывает, что в дистилляте обнаружена синильная кислота (цианиды). Чувствительность 20 мкг/мл.
NaOH + HCN → NaCN + H2O
2NaCN + FeSO4 → Fe(CN)2 + Na2SO4
Fe(CN)2 + 4NaCN → Na4[Fe(CN)6]
3Na4[Fe(CN)6] + 2Fe2(SO4)3 → Fe4[Fe(CN)6]3 + 6Na2SO4
Реакция с пиридин-бензидиновым реактивом
К части щелочного дистиллята добавляют 0,5 мл бромной воды, 1 мл 10% раствора трихлоруксусной кислоты, а затем 0,5 мл 0,5% раствора сульфата гидразина до обесцвечивания жидкости и дополнительно небольшой его избыток в объеме одной капли. В раствор вносят 3 мл пиридин-бензидиновой смеси – наблюдают образование оранжевого окрашивания, постепенно переходящего в красно-фиолетовое.
NaCN + Br2→ BrCN + NaBr
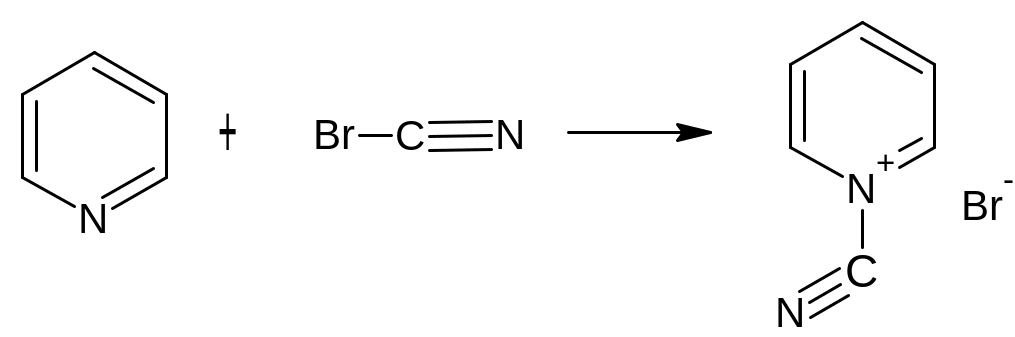

4. Микрокристаллоскопическая реакция образования цианида серебра
Часть дистиллята испаряют, и остаток переносят на предметное стекло. К сухому остатку добавляют каплю 10% раствора азотной кислоты, по одной капле 1% раствора метиленовой сини и 1% раствора нитрата серебра. Под микроскопом наблюдают образование кристаллов в виде длинных игл и сростков из них голубого цвета. Предел обнаружения 0,1 мкг в исследуемой пробе.
NaCN + AgNO3 → AgCN↓ + NaNO3
5. Реакция образования бензидиновой сини
В колбу вносят 2-3 мл исследуемого раствора, к которому прибавляют 1 мл 10% раствора винной кислоты. Колбу сразу же закрывают пробкой, к которой прикреплена влажная бумага, смоченная смесью растворов ацетат меди и бензидина. Затем колбу нагревают несколько минут на водяной бане. При наличии синильной кислоты или ее солей в пробе бумага синеет.
Cu(CH3COO)2 + 2HCN → Cu(CN)2 + 2CH3COOH
2Cu(CN)2 → 2CuCN + (CN)2

3.2. Качественное обнаружение галогенпроизводных алифатического ряда (хлороформа и хлоралгидрата)
1. Реакция отщепления органически связанного хлора
К 1 мл диализата добавляют 1 мл 10% спиртового раствора NaOH и осторожно нагревают в пламени горелки в течение 2-3 мин. После охлаждения раствор подкисляют по лакмусу 10% раствором азотной кислоты и смешивают с 0,5 мл 10% раствором нитрата серебра. Белый осадок или муть указывают на наличие галогенпроизводных в исследуемом растворе.
CHCl3 + 4NaOH → 3NaCl + HCOONa + 2H2O
NaCl + AgNO3 → AgCl↓ + NaNO3
2. Реакция Фудживара
К 2-3 мл исследуемого раствора добавляют 2 мл пиридина и 2 мл 10% раствора NaOH. Смесь нагревают на водяной бане 2-3 мин. При наличии хлороформа или хлоралгидрата в исследуемом дистилляте появляется красное окрашивание.



3. Реакция с реактивом Фелинга
2 мл исследуемого раствора смешивают с 2 мл 10% раствора NaOH и 5 каплями реактива Фелинга. Смесь осторожно нагревают. При наличии хлороформа или хлоралгидрата появляется осадок желтого цвета, переходящий в красный.
CHCl3 + 4NaOH → 3NaCl + HCOONa + 2H2O
2K2Na2[Cu(C4H3O6)2] + HCOONa + H2O → Cu2O↓ + 4KNaC4H4O6 + NaHCO3
4. Реакция с раствором резорцина в щелочной среде
К 1 мл дистиллята добавляют 1 мл 1% раствора резорцина в 10% растворе NaOH, нагревают на кипящей водяной бане 5-10 мин. При наличии хлороформа или хлоралгидрата возникает розовое или малиново-красное окрашивание.

5. Реакция образования изонитрила
К 1 мл исследуемой жидкости добавляют 10 капель 10% спиртового раствора едкого натра и одну каплю водного раствора анилина. Пробирку с раствором осторожно нагревают в течение 1-2 мин. Об образовании изонитрила узнают по появлению характерного неприятного запаха (реакцию проводят только под тягой). Перед тем, как жидкость слить в раковину необходимо в пробирку добавить 10% раствор серной кислоты (для гидролиза изонитрила).
C6H5NH2 + CHCl3 + 3NaOH → C6H5-NC +3NaCl + 3H2O
6. Реакция с реактивом Несслера
К 2-3 мл исследуемого раствора добавляют реактив Несслера. При наличии хлоралгидрата образуется кирпично-красный осадок, который затем становится грязно-зелёным.
CCl3CH(OH)2 + K2HgI4 + 3KOH → Hg↓ + CCl3COOK + 4KI + 3H2O
