
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdf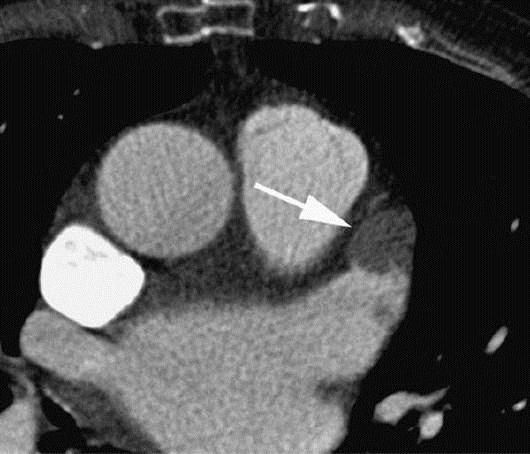
ОПУХОЛИ СЕРДЦА И ТРОМБЫ
Опухоли сердца (см. главу 20) выявляют при КТ как дефекты контрастирования, деформацию заполненных контрастом полостей сердца или как утолщение, часто неоднородное, стенки сердца (миокард или перикард). КТ имеет ограниченные возможности в характеристике мягких тканей, поэтому в части случаев возникают трудности в определении точной локализации опухолей, проникающих в миокард или смежных с ним [61]. Однако наличие кальция (например, в миксомах) можно легко установить или исключить при КТ, что помогает диагностике.
Подобно опухолям, внутрисердечные тромбы выглядят как дефекты контрастирования в полости сердечных камер. Тромбы могут быть единичными или множественными, не имеющими ножки, иметь грибовидную или пластинчатую форму. Предсердные тромбы, главным образом расположенные в пределах ушка ЛП, встречаются наиболее часто. Они проявляются как дефект наполнения (рис. 6.24; см. главу 29). Однако следует помнить, что при пониженной сократительной функции предсердий, например при их фибрилляции, после инъекции контрастного вещества, даже при отсутствии тромба, может наблюдаться слабое контрастирование ушка предсердия.
Рис. 6.24. Визуализация тромба в предсердии. Дефект наполнения показан в ушке ЛП (стрелка).
Тромбы в ЛЖ часто обнаруживают после предшествующего ИМ. Обычно они расположены рядом с зоной ИМ и связаны с расстройствами движения стенки (рис. 6.25) (см. главу 16). Дифференцирование тромба от миокарда и сосочковой мышцы может быть затруднительным. При этом старые тромбы могут обызвествляться.

Рис. 6.25. Визуализация тромба левого желудочка. Тромб в верхушке ЛЖ (стрелка).
ПАТОЛОГИЯ ПЕРИКАРДА
На КТ-томограммах перикард обычно оценивают по передней поверхности сердца. Он очерчивается как тонкая структура мягкотканой плотности, смежная с жировой тканью средостения и расположенная вентрально от него и кнаружи от эпикарда. Толщина нормального перикарда составляет 1-2 мм, но по мере приближения к месту прикрепления перикарда к диафрагме он утолщается до 3-4 мм [62].
Патология перикарда включает его утолщение и кальциноз, выпот в полость перикарда, локальные перикардиальные новообразования или интраперикардиальные опухоли. Утолщение перикарда может быть ограниченным или распространенным. Патологический процесс способен вовлекать и париетальный, и висцеральный перикард, а иногда миокард. Однако утолщение перикарда самого по себе не считают доказательством наличия патологического процесса, влияющего на гемодинамику. В этом контексте может быть полезным обнаружение кальциноза перикарда (рис. 6.26). Выпот в полости перикарда обычно накапливается в каудальной его части и проявляется содержимым жидкостной плотности, прилежащим к миокарду ЛЖ. По мере нарастания количества выпота он распространяется к вентральной поверхности правых предсердия и желудочка. Послеоперационный выпот в полость перикарда может быть ограниченным, например прилегать к ПП. Перикардиальные кисты обычно проявляются как круглые или овальные новообразования в правом перикардиально-диафрагмальном углу (рис. 6.27). Кисты, заполненные жидкостью, соответствуют плотности воды. При раке груди и легких может наблюдаться метастазирование опухоли в перикард.

Рис. 6.26. Визуализация обызвествления перикарда. Утолщенный перикард с выраженным кальцинозом (стрелки).

Рис. 6.27. Визуализация перикардиальной кисты. Перикардиальная киста в правом ребернодиафрагмальном углу (стрелка).
КРУПНЫЕ СОСУДЫ
Так как крупные сосуды смещаются при сердечных сокращениях и дыхании, высокая скорость сканирования современных КТ-сканеров, их высокое пространственное разрешение и хорошая контрастность между кровью в просвете сосуда и окружающими тканями являются факторами, по которым МСКТ-ангиография стала важной и надежной клинической диагностической методикой в оценке крупных сосудов средостения. При КТ грудной полости ЭКГ-синхронизацию используют редко.
АНЕВРИЗМА ГРУДНОГО ОТДЕЛА АОРТЫ
Аневризмы аорты (см. главу 31) вызваны дегенерацией средней оболочки стенки кровеносного сосуда. Они наиболее часто встречаются при атеросклеротической болезни, но также возникают вследствие синдрома Марфана, кистозного некроза средней оболочки сосуда, травмы, постстенотической дилатации или инфекционно-грибковых заболеваний.
Аневризмы разделяют на истинные и ложные. Истинная аневризма вовлекает все слои стенки, часто связана с атеросклерозом и обычно имеет веретенообразную форму (рис. 6.28). Ложные аневризмы возникают вследствие перфорации или пенетрации внутренней и средней оболочек стенки сосуда и их стенка состоит из адвентициальной оболочки и периваскулярных тканей (рис. 6.29). Они часто имеют мешкообразную форму, узкую шейку и связаны с травмой или
инфекцией. Аневризмы грудного отдела аорты нередко заполнены интрамуральными тромбами, а длительно существующие аневризмы могут обызвествляться. При КТ аневризмы визуализируются как локальное увеличение диаметра аорты.

Рис. 6.28. Визуализация аневризмы аорты. Аневризматическая дилатация восходящей части аорты (A). Аксиальное изображение на уровне дуги аорты (Б) демонстрирует значительное различие в диаметре полости восходящей и нисходящей частей аорты. Значительное количество жидкости в перикардиальном пространстве окружает восходящий отдел аорты (стрелки).
Рис. 6.29. Визуализация аневризмы аорты. Маленькая мешковидная аневризма на уровне дуги аорты (стрелка, A). Маленькую шейку и местоположение легко оценить в сагиттальной проекции. Поперечное сечение дуги аорты демонстрирует эксцентричную конфигурацию аневризмы (Б).
РАССЛОЕНИЕ АОРТЫ
Расслоение стенки аорты (см. главу 31) вызвано разрывом в пределах интимы артерии с последующим развитием и антероградным распространением ложного просвета вдоль средней оболочки сосуда. Возможно ретроградное распространение расслоения с вовлечением АК. Ложное русло в диаметре часто больше истинного и способно слепо заканчиваться или повторно соединяться с истинным руслом. Ложное русло может тромбироваться или остаться открытым. Расслоения обычно связывают с артериальной гипертензией или синдромом Марфана (см. главу 31). Их можно дифференцировать согласно классификациям Дебейки или Станфорда,
учитывающим вовлечение в процесс восходящей аорты (Дебейки тип I и II, Станфорд тип A), требующим экстренного хирургического вмешательства и характеризующимся плохим прогнозом, и ограниченных нисходящей частью аорты (Дебейки тип III, Станфорд тип B), которые в отсутствие осложнений лучше всего лечатся терапевтически и имеют относительно хороший прогноз.
При КТ расслоение характеризуется наличием отслоившейся интимы, разделяющей истинное и ложное русло (рис. 6.30). Косвенные КТ-симптомы расслоения включают смещение кнутри обызвествленной стенки ложного просвета, разность контрастирования между истинным и ложным просветом, наличие (неконтрастированного) тромба в ложном просвете, утолщение аортальной стенки и (потенциально) выпот в полость перикарда.
Рис. 6.30. Визуализация расслоения аорты. А - расслоение аорты I типа по классификации Дебейки (соответствующее типу А по классификации Станфорда), распространяется от восходящей аорты к нисходящей и брюшной аорте (стрелки), что показано в 3Dизображении. Толстая стрелка указывает на инфраренальную аорту, которая окклюзирована. Б - расслоение, показанное в (A), отображено при использовании многоплоскостных реконструкций вдоль оси аорты. Инфраренальная аорта окклюзирована

(толстая стрелка), виден продольный кальциноз стенки. В - на аксиальном срезе области груди видно расслоение стенки. Отслоившаяся интима идентифицируется в восходящем и нисходящем отделах аорты (стрелки).
ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ
Было продемонстрировано, что КТ обеспечивает высокую диагностическую точность при обнаружении легочной эмболии (см. главу 37). Легочные эмболии при КТ проявляются как обструкции или дефекты наполнения ангиографии ствола ЛА, правых или левых ЛА, а также их ответвлений (рис. 6.31). Легочные эмболии обычно двусторонние [45]. В обычной клинической практике КТ-ангиографию теперь рассматривают как метод выбора при подозрении на ТЭЛА [63].
Рис. 6.31. Визуализация легочной эмболии. Массивная эмболия на уровне бифуркации ЛА. Ao - аорта; AP - легочная артерия.
ДИАГНОСТИКА ПРИ ОСТРОЙ БОЛИ В ГРУДИ
Для оптимизации выявления причин острой боли в груди в отделении скорой помощи были проведены исследования диагностических возможностей оценки содержания коронарного кальция с последующим выполнением КТ-коронарографии. Отсутствие кальциноза по ходу венечных артерий или отсутствие бляшки при КТ-коронарографии у больных с острой болью в груди при низком уровне риска (нет изменений данных ЭКГ или ферментных показателей) фактически исключает ОКС и имеет превосходный краткосрочный и долговременный прогноз [64-68]. При единственном КТ-сканировании можно выявить или исключить ОКС, легочную эмболию, расслоение аорты и все опасные для жизни состояния, связанные с острой болью в груди. Из-за большой зоны сканирования, необходимости контрастирования и легочных, и венечных артерий необходима более высокая доза контрастного вещества, что ведет к увеличению дозы облучения. Как правило, в клинической практике наиболее вероятным бывает одно из этих состояний. В этом случае КТ рекомендуют выполнять согласно проведенной сортировке пациенов (triple rule). Однако несердечные заболевания, в соответствии с жалобами пациента, могут быть обнаружены при КТ, предназначенной для исключения патологии венечных артерий.
ФУНКЦИОНАЛЬНЫЕ ИССЛЕДОВАНИЯ В КОМПЬЮТЕРНОЙ ТОМОГРАФИИ
Если сканирование проводили в течение всего сердечного цикла, то изображения могут быть реконструированы в любую фазу сердечного цикла, что позволяет оценить общую и региональную сократительную функции. Несмотря на относительно небольшое временное разрешение, глобальная функция ЛЖ при КТ хорошо коррелирует с данными ЭхоКГ и МРТ [69]. Новые протоколы сканирования, значительно уменьшающие лучевую нагрузку на пациента, не позволяют получить информацию о функционировании ЛЖ. Отдельные участки миокарда на постконтрастных КТ-ангиограммах могут не накапливать контрастного вещества из-за нарушения перфузии в случае предшествующего ИМ или тяжелой ишемии (рис. 6.32). Неоднородное накопление контрастного вещества в миокарде может также быть вызвано двигательными и лучистыми артефактами. Для дополнения ангиографической информации при КТ-ангиографии предложено оценивать перфузию миокарда после фармакологической нагрузки для обнаружения ишемии [70]. При этом можно обнаружить истончение стенки после ИМ, обызвествления или очень сильное снижение плотностных показателей миокарда из-за замещения миокарда жировой тканью [71]. Как и при МРТ, может наблюдаться отсроченное усиление после ИМ или других форм его повреждения [72]. Из-за превосходного качества изображения без применения рентгеновского излучения или йодсодержащих контрастных веществ МРТ остается наилучшим методом выявления постинфарктного кардиосклероза.
Рис. 6.32. Изображения миокарда. Конечную диастолическую (A) и конечную систолическую (Б) реконструкции можно использовать для оценки глобальной функции ЛЖ. Отсроченное контрастирование (стрелки) при КТ (В) и МРТ (Г) в случае острого (реперфузированного) ИМ нижней стенки. Дефект контрастирования (стрелки) нижней стенки при КТ сразу после в/в введения контрастного вещества у больного вскоре после реперфузированного ИМ (Д). Истончение стенки и снижение плотностных показателей (стрелки) эндокардиальной части

передней стенки, так же как и отдельные обызвествления (верхний конец стрелки) у пациента, перенесшего предшествующий ИМ в прошлом (Е).
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ ПРИ БОЛЕЗНЯХ КЛАПАНОВ
• КТ-изображения могут предоставить морфологическую информацию о створках АК и МК
(рис. 6.33).
Рис. 6.33. Изображения аортального клапана при КТ-ангиографии после в/в введения контрастного вещества. А, Б - больной с аортальным стенозом. Виден ТК с умеренным кальцинозом. Закрытие в диастоле полное, но остается маленькое отверстие (1,1 см2) в систоле. В, Г - больной с аортальной регургитацией. Открытие клапана немного ухудшено в систоле (площадь отверстия 2,4 см2), в то время как в диастоле остается маленькая центральная область регургитации. Створки клапана утолщены, что часто обнаруживают при регургитации крови на фоне недостаточности АК.
• Площадь отверстия при стенозе АК можно точно измерить при МСКТ. Высокое пространственное решение КТ иногда бывает хорошим подспорьем для оценки структур, расположенных вокруг клапанов (например, абсцессов или расхождения тканей после хирургической операции при эндокардите), которые иногда трудно выявить при ЭхоКГ или МРТ из-за артефактов, вызванных протезом клапана (рис. 6.34).
Рис. 6.34. Визуализация параклапанной фистулы у больного после замены АК (стрелка). Современные протезы клапанов обычно вызывают очень незначительные артефакты при КТ.
•Функциональные показатели, такие как скорость потока и градиент давления, не могут быть определены по данным КТ. Правые сердечные клапаны трудно визуализировать при КТ из-за сниженного и, часто, неоднородного контрастирования в правых отделах, но подбор протокола сканирования может обеспечить равномерное контрастирование в обоих желудочках, что позволит определить ФВ ПЖ.
•КТ-изображения могут иметь существенное значение при исследовании сердца в период подготовки к хирургическому вмешательству на клапанах и чрескожной замене АК.
•КТ-ангиография венечных артерий может надежно исключить их стеноз у больных с запланированным хирургическим вмешательством на клапанах [78-80].
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ СЕРДЦА В ЭЛЕКТРОФИЗИОЛОГИИ
При подготовке к изоляции легочных вен подробная информация относительно размеров и анатомии предсердия и легочной вены, ее размера и локализации пищевода позади ЛП потенциально улучшает эффективность и безопасность операции (рис. 6.35). КТ без ЭКГсинхронизации чаще всего достаточно, особенно при ФП. Совмещая КТ-изображения в данными ЭКГ-картирования сердца во время абляции, можно позиционировать катетеры для абляции и уточнять положения выявленных очагов патологической активности, используя данные об индивидуальных анатомических особенностях, хотя регистрация положения катетера на КТизображениях ограничена смещением сердца при дыхании и сердечных сокращениях [81]. При КТ можно идентифицировать послеоперационный стеноз или тромбоз легочных вен [82].

Рис. 6.35. Изображение легочных вен. 3D-КТ-ангиограмма, вид сзади относительно ЛП и легочных вен, так же как расположенных выше ЛА.
Отображение венозной системы сердца может быть полезным перед имплантацией бивентрикулярного кардиостимулятора. Используя визуализацию индивидуального строения вен сердца, оценивают возможность выполнения и проводят выбор вены для размещения электрода в ЛЖ [83, 84]. Также могут быть важны особенности углов отхождения ветвей вен, различия в анатомии синуса и наличие рудиментарных клапанных структур (клапаны Тебезия) в синусовом отверстии. Качество изображения коронарных КТ-изображений может ухудшаться из-за наличия проводов кардиостимулятора (см. главу 27), особенно в местах дистальных частей электродов и в случае петель ИКД (см. главу 30).
КОМПЬЮТЕРНАЯ ТОМОГРАФИЯ СЕРДЦА ПРИ СЛОЖНЫХ ВРОЖДЕННЫХ ПОРОКАХ СЕРДЦА
Обычно больные со сложными врожденными пороками сердца (см. главу 10) молоды, и лучевая нагрузка при КТ исследовании очень нежелательна из-за возможного проявления стахостических эффектов облучения. По этой причине МРТ является методом выбора. Однако МРТ может быть противопоказана больным с установленным кардиостимулятором, ИКД или тяжелой клаустрофобией. В этих случаях КТ сердца может предоставить точные анатомические данные этой сложной врожденной патологии, включая состояние ПЖ (после регистрации данных), но КТ не дает информации о токах крови [85].
ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
Спиральная КТ-коронарография является очень чувствительным диагностическим методом для исключения гемодинамически значимого стеноза при атеросклерозе венечных артерий. Однако на стадии развития атеросклероза спиральная КТ-ангиография не может заменить традиционную ангиографию венечных артерий, которая жизненно важна для планирования как проводниковой, так и хирургической реканализации стенозов венечной артерии и служит "дорожной картой" для проводниковых коронарных диагностических методик, таких как интракоронарное УЗИ, биопсия, оптическая когерентная томография, спектроскопия, термография. Замена инвазивной коронарной ангиографии спиральной КТ-ангиографией венечных артерий требует улучшения временного
разрешения (более быстрое вращение трубки, две или более рентгеновских трубкок, немеханическое регулирование рентгеновского излучения) и пространственного разрешения (улучшенная технология регистрации излучения без увеличения радиационного облучения). Текущие проблемы, связанные со спиральной КТ-ангиографией венечных артерий (такие, как кальциноз, ФП и относительно высокая лучевая нагрузка), следует решать, обращаясь к техническим новшествам в области регистрации данных КТ (их появление ожидают в обозримом будущем). Клиническая роль спиральной КТ в выявлении или исключении стеноза венечной артерии при сравнении с другими атравматичными методиками (стресс-ЭхоКГ, ЭКГ под нагрузкой, ОФЭКТ) должна быть установлена в дальнейших исследованиях, которые должны также включать и анализ рентабельности исследований. Необходимы исследования атеросклероза венечных артерий (кальцифицированных и некальцифицированных бляшек) для дальнейшей оценки его роли в прогнозе, профилактике и экономической эффективности лечения ИБС у пациентов, не имеющих клинической симптоматики.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Bluemke D.A., Achenbach S., Budoff М. et al. Noninvasive coronary artery imaging: magnetic resonance angiography and multidetector computed tomography angiography: a scientific statement from the American Heart Association Committee on Cardiovascular Imaging and Intervention of the Council on Cardiovascular Radiology and Intervention, and the Councils on Clinical Cardiology and Cardiovascular Disease in the Young // Circulation. - 2008. - Vol. 118. - P. 586-606.
Greenland P., Bonow R.O., Brundage B.H. et al. Clinical Expert Consensus Document on Coronary Artery Calcium Scoring by Computed Tomography in Global Cardiovascular Risk Assessment and in Evaluation of Patients With Chest Pain. A Report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography) Developed in Collaboration With the Society of Atherosclerosis Imaging and Prevention and the Society of Cardiovascular Computed Tomography // Circulation. - 2007. - Vol. 115. - P. 402-426.
Hendel R.C., Patel M.R., Kramer C.M. et al. ACCF/ACR/SCCT/SCMR/ASNC/NASCI/SCAI/SIR 2006 appropriateness criteria for cardiac computed tomography and cardiac magnetic resonance imaging: a report of the American College of Cardiology Foundation Quality Strategic Directions Committee Appropriateness Criteria Working Group, American College of Radiology, Society of Cardiovascular Computed Tomography, Society for Cardiovascular Magnetic Resonance, American Society of Nuclear Cardiology, North American Society for Cardiac Imaging, Society for Cardiovascular Angiography and Interventions, and Society of Interventional Radiology // J. Am. Coll. Cardiol. - 2006. - Vol. 48. - P. 14751497.
Schroeder S., Achenbach S., Bengel F. et al. Cardiac computed tomography: indications, applications, limitations, and training requirements: Report of a Writing Group deployed by the Working Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology // Eur. Heart. - 2008. - Vol. 29. - P. 531-556.
СПИСОК ЛИТЕРАТУРЫ
1.Moshage W., Achenbach S., Seese B. et al. Coronary artery stenoses: threedimensional imaging with electrocardiographically triggered, contrast agentenhanced, electronbeam CT // Radiology. - 1995. - Vol. 196. - P. 707-714.
2.Einstein A.J., Henzlova M.J., Rajagopalan S. Estimating risk of cancer associated with radiation exposure from 64-slice computed tomography coronary angiography // JAMA. - 2007. - Vol. 298. - P. 317323.
3.Hausleiter J., Meyer T., Hadamitzky M. et al. Radiation dose estimates from cardiac multislice computed tomography in daily practice // Circulation. - 2005. - Vol. 113. - P. 1305-1310.
4.Earls J.P., Berman E.L., Urban B.A. et al. Prospectively gated transverse coronary CT angiography versus retrospectively gated helical technique: improved image quality and reduced radiation dose // Radiology. - 2008. - Vol. 246. - P. 742-753.
5.Agatston A.S., Janowitz W.R., Hildner F.J. et al. Quantification of coronary artery calcium using ultrafast computed tomography // J. Am. Coll. Cardiol. - 1990. - Vol. 15. - P. 827-832.
6.Becker C.R., Kleffel T., Crispin A. et al. Coronary artery calcium measurement: agreement of multirow detector and electron beam CT // Am. J. Roentgenol. - 2001. - Vol. 176. - P. 1295-1298.
7.Hong C., Bae K.T., Pilgram T.K. Coronary artery calcium: accuracy and reproducibility of measurements with multi-detector row CT - assessment of effects of different thresholds and quantification methods // Radiology. - 2003. - Vol. 227. - P. 795-801.
8.Schoenhagen P., Tuczu M. Coronary artery calcification and end-stage renal disease: Vascular biology and clinical implications // Cleve. Clin. J. Med. - 2002. - Vol. 69. - Suppl. 3. - P. 12-20.
9.Shaw L., Raggi P., Schisterman E. et al. Prognostic value of cardiac risk factors and coronary artery calcium screening for all-cause mortality // Radiology. - 2003. - Vol. 228. - P. 826-833.
10.Greenland P., Bonow R.O., Brundage B.H. et al. ACCF/AHA 2007 clinical expert consensus document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain: a report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography).Developed in Collaboration with the Society of Atherosclerosis Imaging and Prevention and the Society of Cardiovascular Computed Tomography // Circulation. - 2007. - Vol. 115. - P. 402-426.
11.Budoff M.J., Shaw L.J., Liu S.T. et al. Long-term prognosis associated with coronary calcification observations from a registry of 25,253 patients // J. Am. Coll. Cardiol. - 2007. - Vol. 49. - P. 1860-1870.
12.Detrano D.R., Guerci A.D., Carr J.J. et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups // N. Engl. J. Med. - 2008. - Vol. 358. - P. 1336-1345.
13.Abdulla J., Abildstrom S.Z., Gotzsche O. et al. 64-multislice detector computed tomography coronary angiography as potential alternative to conventional coronary angiography: a systematic review and meta-analysis // Eur. Heart J. - 2007. - Vol. 28. - P. 3042-3050.
14.Schroeder S., Achenbach S., Bengel F. et al. Cardiac computed tomography: indications, applications, limitations, and training requirements: Report of a Writing Group deployed by the Working Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology // Eur. Heart J. - 2008. - Vol. 29. - P. 531-556.
15.Weustink A.C., Meijboom W.B., Mollet N.R. et al. Reliable high-speed coronary computed tomography in symptomatic patients // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 786-794.
16.Brodoefel H., Burgstahler C., Tsiflikas I. et al. Dual-source CT: effect of heart rate, heart rate variability, and calcification on image quality and diagnostic accuracy // Radiology. - 2008. - Vol. 247. - P. 346-355.
17.Alkadhi H., Scheffel H., Desbiolles L. et al. Dual-source computed tomography coronary angiography: influence of obesity, calcium load, and heart rate on diagnostic accuracy // Eur. Heart J. - 2008. -
Vol. 29. - P. 766-776.
18.Ropers U., Ropers D., Pflederer T. et al. Influence of heart rate on the diagnostic accuracy of dualsource tomography computed angiography // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 2393-2398.
19.Achenbach S., Ropers U., Kuettner A. et al. Randomized comparison of 64-slice singleand dualsource computed tomography for the detection of coronary artery disease // J. Am. Coll. Cardiol. Img. - 2008. - Vol. 1. - P. 177-218.
20.Meijboom W.B., van Mieghem C.A., Mollet N.R. et al. 64-slice computed tomography coronary angiography in patients with high, intermediate, or low pretest probability of significant coronary artery disease // J. Am. Coll. Cardiol. - 2007. - Vol. 50. - P. 1469-1475.
21.Budoff M.J., Dowe D., Jollis J.G. et al. Diagnostic performance of 64-multidetector-row coronary computed tomographic angiography for evaluation of coronary artery stenosis in individuals without known coronary artery disease: results from the prospective multicenter ACCURACY (Assessment by Coronary Computed Tomographic Angiography of Individuals Undergoing Invasive Coronary Angiography) trial // J. Am. Coll. Cardiol. - 2008. - Vol. 52. - P. 1724-1732.
22.Meijboom W.B., Meijs M.F., Schuijf J.D. et al. Diagnostic accuracy of 64-slice computed tomography coronary angiography: a prospective, multicenter, multivendor study // J. Am. Coll. Cardiol. - 2008. - Vol. 52. - P. 2135-2144.
23.Meijboom W.B., van Mieghem C.A.G., van Pelt N. et al. Comprehensive assessment of coronary artery stenoses computed tomography coronary angiography versus conventional coronary angiography and correlation with fractional flow reserve in patients with stable angina // J. Am. Coll. Cardiol. - 2008. - Vol. 52. - P. 636-643.
