
6 курс / Кардиология / Джон_Кэмм_Болезни_сердца_и_сосудов_2011
.pdfперенесенным ИМ и ФВ ЛЖ ≤30% [1] вносят смятение в национальные службы здоровья европейских стран. Этот раздел будет сосредоточен главным образом на указанной проблеме. Для получения более полной информации по риск-стратификации читатель может обратиться к недавно опубликованному руководству [36].
Вследствие ограниченного объема книги в этой главе речь пойдет только о тех маркерах риска (за исключением ФВ ЛЖ), которые, согласно докладу рабочей группы Европейского общества кардиологов, получили IA класс рекомендаций. К ним относят демографические показатели, вариабельность сердечного ритма (ВСР), турбулентность сердечного ритма или барорефлекторную чувствительность и микроальтернацию зубца Т. Другая группа маркеров, которые могут способствовать улучшению риск-стратификации наряду с низкой ФВ ЛЖ, включает ЭКГ-показатели (продолжительность комплекса QRS, поздние потенциалы), а также результаты ЭФИ. В опубликованных данных мультицентрового исследования MUSTT (Multicenter Unsustained Tachycardia Trial), проведенного среди пациентов с неустойчивой тахикардией, было показано, что у 1638 пациентов с ИБС и сниженной систолической функцией ЛЖ БЛНПГ или другое нарушение внутрижелудочкового проведения (по результатам ЭКГ) приводит к повышению риска общей и аритмической смертности на 50% [37]. Эта прогностическая информация независима от других маркеров риска, таких как ФВ ЛЖ или результаты ЭФИ. Кроме того, ЭКГ-признаки гипертрофии ЛЖ считают значимыми риск-предикторами аритмической смертности (относительный риск 1,35; 95%
ДИ 1,08-1,69).
ЖЕЛУДОЧКОВАЯ ЭКСТРАСИСТОЛИЯ И НЕУСТОЙЧИВАЯ ЖЕЛУДОЧКОВАЯ ТАХИКАРДИЯ
Преждевременные ЖЭС и неустойчивая ЖТ - частые находки у пациентов со органическими заболеваниями сердца. В большинстве исследований маркерами повышенного риска считают частоту ЖЭС около десяти в час и повторяющиеся формы ЖЭС. Положительная прогностическая ценность ЖЭС после ИМ колеблется в пределах 5-15%, а отрицательная прогностическая ценность составляет 90% и более [38]. При сочетании со сниженной функцией ЛЖ ЖЭС становится еще более значимым маркером смертности [36]. Тем не менее профилактический прием антиаритмических препаратов не снижает смертность у пациентов с бессимптомными неустойчивыми желудочковыми аритмиями [1]. Исследование CAST (Cardiac Arrhythmia Suppression Trial, Исследование по купированию аритмии сердца) [39] демонстрирует тот факт, что маркеры риска необязательно служат основной целью лечения. Подавление ЖЭС антиаритмическими препаратами 1С класса после ИМ увеличивало смертность [1].
Остается неясным, повышает ли риск имеющаяся ЖЭС (неустойчивая ЖТ) у пациентов с перенесенным ИМ и ФВ ЛЖ менее 35% [36], но у пациентов с умеренной дисфункцией ЛЖ (ФВ ЛЖ в пределах 35-40%), доказанной ЖЭС и индуцированной при ЭФИ ЖТ показаны преимущества имплантации ИКД [1, 40]. Не установлена и взаимосвязь ЖЭС и остановки сердца у пациентов с неишемической кардиомиопатией. Положительная прогностическая ценность низка и колеблется в пределах 20-50% [36]. Таким образом, в соответствии с текущими практическими рекомендациями показаний к лечению неустойчивой ЖТ в подгруппах пациентов с перенесенным ИМ или неишемической кардиомиопатией не существует. Исключение составляют относительно редкие рецидивирующие ЖТ или эпизоды ЖТ с высокой частотой, приводящие к нестабильности гемодинамики [36]. В таких случаях начальное медикаментозное лечение неустойчивых ЖТ, сопровождающихся клиническими симптомами, должно включать применение β- адреноблокаторов. Если же неустойчивые ЖТ с клиническими признаками не отвечают на их использование, препаратом выбора становится амиодарон или соталол [1].
МИКРОАЛЬТЕРНАЦИЯ ЗУБЦА Т
Едва уловимые изменения на ЭКГ, возникающие в фазе реполяризации и называемые микроальтернацией зубца Т, ассоциированы с повышенным риском ВСС и другими серьезными желудочковыми тахиаритмическими событиями. Микроальтернация зубца Т обычно свидетельствует об изменениях амплитуды зубца Т, незаметных на поверхностной ЭКГ, в каждом втором комплексе QRST. Их тем не менее можно обнаружить при увеличении ЧСС, используя современные сигналпреобразующие методики. Этого, в свою очередь, достигают либо предсердной электрокардиостимуляцией, либо, что предпочтительней, неинвазивно, с помощью проб с физической нагрузкой. На рис. 30.18 представлены примеры положительного, отрицательного и сомнительного теста на микроальтернацию зубца Т.
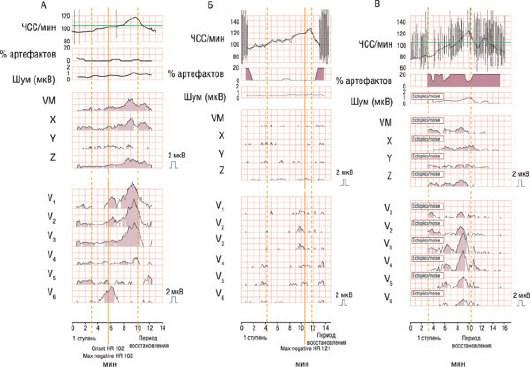
Рис. 30.18. Примеры положительного, отрицательного и сомнительного тестов на микроальтернацию зубца Т. А - сверху вниз представлены тренд ЧСС, процент (доля) артефактов, уровень шума, амплитуда микроальтернации зубца Т в отведении VM (модуль вектора, полученного на основе ортогональных отведений), ортогональных отведениях X, Y и Z и отведениях V1-V6. Б - пример устойчивой микроальтернации зубца Т (серая затушеванная зона), индуцированной физической нагрузкой и начавшейся при достижении ЧСС 102 в минуту. В - отсутствие микроальтернации зубца Т в ходе пробы с нагрузкой при нарастании ЧСС до максимального показателя (121 в минуту). Сомнительный тест на микроальтернацию зубца Т, связанный с частыми ЭС (вертикальные линии в пиктограмме тренда ЧСС).
Некоторые клинические исследования показали, что определение микроальтернации зубца Т у пациентов с органическим заболеванием сердца может дать прогностическую информацию. Оно особенно полезно у пациентов с ишемической и неишемической кардиомиопатией с целью прогнозирования аритмических осложнений в ходе последующего наблюдения [36]. Например, недавно сообщалось, что из 129 больных ишемической кардиомиопатией в течение 24 мес наблюдения у пациентов с отрицательным тестом на микроальтернацию зубца Т не произошло аритмических событий или ВСС. В то же время у пациентов с положительным тестом на микроальтернацию зубца Т или с сомнительным тестом частота событий составила 15,6% [41]. Это означает, что анализ микроальтернации зубца Т может быть полезным для того, чтобы избежать ненужной имплантации ИКД у пациентов со сниженной функцией ЛЖ и отрицательным тестом на микроальтернацию зубца Т.
ВАРИАБЕЛЬНОСТЬ СЕРДЕЧНОГО РИТМА, БАРОРЕФЛЕКТОРНАЯ ЧУВСТВИТЕЛЬНОСТЬ, ТУРБУЛЕНТНОСТЬ СЕРДЕЧНОГО РИТМА (СМ. ТАКЖЕ ГЛАВУ
2)
ВСР практически всецело обусловлена вкладом автономной нервной системы в регуляцию деятельности СА-узла. Как ВСР, так и барорефлекторную чувствительность оценивают проспективно. Они определяют влияние автономной нервной системы на миокард желудочков, что считают важным в патофизиологии ЖТ и ВСС. В больших популяционных исследованиях при многовариантном анализе показано, что ВСР обеспечивает достоверную независимую прогностическую информацию. Исследование ATRAMI (The Autonomic Tone and Reflexes After Myocardial Infarction, Исследование тонуса автономной нервной системы и рефлексов после ИМ) [42, 43] продемонстрировало, что пациенты, перенесшие ИМ со сниженной ВСР, имели относительный риск смерти 3,2. В частности, пациенты с ФВ ЛЖ менее 35% и сохраненной барорефлекторной чувствительностью имели лучшую двухгодичную выживаемость, чем пациенты со сниженной барорефлекторной чувствительностью (7% против 18%). Это более значимо
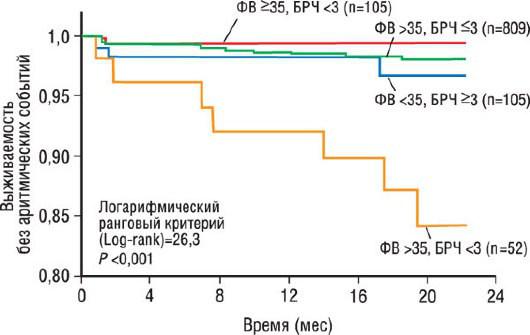
(рис. 30.19) даже для серьезных аритмических событий (3% против 16%). Кам (Camm) и соавт. [44] на основе наблюдения 3717 пациентов с перенесенным ИМ и дисфункцией ЛЖ опубликовали данные по прогностической значимости ВСР. При мультивариантном анализе низкая ВСР увеличивала риск смертности от всех причин до 1,46 (95% ДИ 1,1-1,94), но низкая ВСР не прогнозировала аритмическую смертность. Именно поэтому ВСР служит лучшим маркером неаритмической смертности, чем ВСС.
Рис. 30.19. Риск-предикция серьезных аритмических событий на основе определения ФВ ЛЖ и оценки барорефлекторной чувствительности.
Турбулентность сердечного ритма описывает кратковременные колебания длины синусового цикла, следующего после ЖЭС [45]. Предполагают, что она оценивает вагусные влияния подобно барорефлекторной чувствительности. Это весьма интересный фактор риска, так как его можно оценивать при относительно небольшом числе преждевременных желудочковых сокращений во время суточного мониторирования ЭКГ. Дальнейшие исследования необходимы для того, чтобы определить, существует ли клиническое значение этого маркера для риск-стратификации.
ЛЕЧЕНИЕ ЖЕЛУДОЧКОВЫХ ТАХИКАРДИЙ У ПАЦИЕНТОВ С ОРГАНИЧЕСКИМИ ПОРАЖЕНИЯМИ СЕРДЦА
Спектр методов лечения ЖТ включает медикаментозную терапию, имплантацию устройств, хирургические методы и техники катетерной абляции. Показания для лечения основаны на понимании того, является ли ЖТ просто симптомом или существует потенциальный риск внезапной (аритмической) смерти вследствие существования аритмогенного субстрата.
НЕОТЛОЖНАЯ ПОМОЩЬ ПРИ УСТОЙЧИВОЙ ЖЕЛУДОЧКОВОЙ ТАХИКАРДИИ
Пациентам с устойчивой мономорфной ЖТ и нарушением гемодинамики рекомендована экстренная РСТ при соответствующей седации [1]. Если ЖТ рефрактерна к кардиоверсии или возобновляется сразу после нее, необходимо в/в ввести амиодарон [1]. Если пациент гемодинамически стабилен, можно в/в назначить прокаинамид или аймалин (доступен лишь в некоторых европейских странах) [1]. Применение только амиодарона в этой ситуации недостаточно эффективно [46].
ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Поскольку ВСС имеет многофакторную этиологию, можно рассматривать множество мишеней для терапевтического воздействия. Например, при ИБС такие лечебные мероприятия могут варьировать от ограничения зоны инфаркта и предотвращения новых ишемических событий, происходящих при прогрессировании заболевания и нестабильности бляшки, до модуляции нейроэндокринной активности, антиаритмических и антифибрилляторных воздействий. Все эти методы лечения разработаны для предотвращения или купирования желудочковых тахиаритмий.
Термины "первичная" и "вторичная профилактика" ВСС обычно указывают на то, есть ли у пациента анамнез устойчивой (сопровождаемой гипотензией) ЖТ или предотвращенной ВСС вследствие ФЖ. У пациентов без предшествующих устойчивых желудочковых тахиаритмий, но с высоким риском ВСС лечение обычно описывают как первичную профилактику. Подобное профилактическое лечение у пациентов, уже перенесших остановку сердца или устойчивую ЖТ, называют вторичной профилактикой.
ИМПЛАНТАЦИЯ ДЕФИБРИЛЛЯТОРА И МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
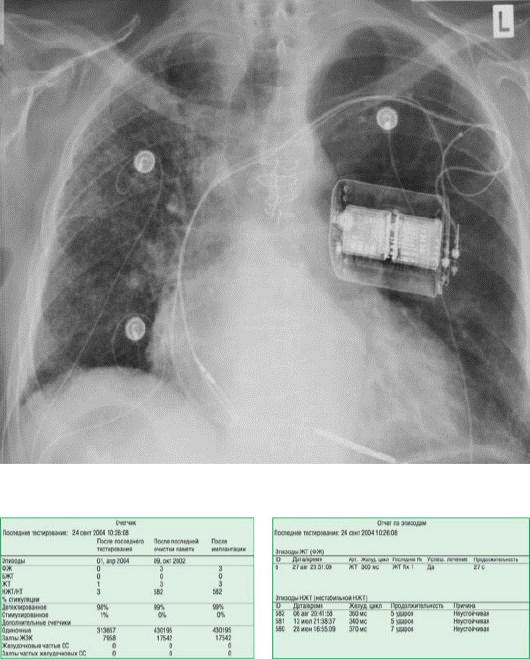
Дальнейшее персистирование или развитие аритмогенного субстрата даже после успешного лечения ЖТ на фоне органического заболевания сердца будет препятствовать любым лечебным воздействиям. В течение долгого времени лечение ЖТ включало только медикаментозную терапию и антитахикардитические вмешательства. В настоящее время лучшим доступным методом профилактики ВСС от ЖТ (рис. 30.20 и 30.21) считают ИКД (класс показаний I, уровень доказательности B [47]). Современный ИКД используют в клинической практике с 1980 г. Это автономное устройство, способное к идентификации ЖТ и ФЖ и автоматическому купированию указанных аритмий путем антитахикардитической стимуляции или нанесения разряда около 35 Дж или менее прямо на сердце. I и II классы критериев для имплантации ИКД согласно текущим практическим рекомендациям представлены в табл. 30.4.
Рис. 30.20. Двухкамерный ИКД, установленный пациенту с ишемической кардиомиопатией и предшествующим АКШ.

Рис. 30.21. Данные памяти однокамерного ИКД, включающие количество и временные интервалы электротерапии ЖТ и фибрилляции желудочков. ЖЭК - желудочковые эктопические комплексы; СС - стабилизирующие стимулы.
Таблица 30.4. I и II классы показаний для установки имплантируемого кардиовертерадефибриллятора согласно руководству 2008 г. Американского кардиологического колледжа, Американской ассоциации кардиологов и Общества по сердечному ритму (ACC/AHA/HRS 2008
Guidelines)
I класс
Установка ИКД рекомендована выжившим после остановки сердца вследствие ФЖ (ЖТ) после уточнения этиологии заболевания и исключения полностью обратимых причин (уровень доказательности A)
Установка ИКД рекомендована пациентам с органическим заболеванием сердца и спонтанной устойчивой ЖТ (уровень доказательности B)
Установка ИКД рекомендована пациентам с обморочными состояниями неясной этиологии, связанными с гемодинамически значимой устойчивой ЖТ или ФЖ, индуцируемой при ЭФИ (уровень доказательности B)
Установка ИКД рекомендована пациентам с ФВ ЛЖ менее 35% вследствие перенесенного более 40 дней назад ИМ, имеющим II или III класс СН по NYHA (уровень доказательности A)
Установка ИКД рекомендована пациентам с дилатационной кардиомиопатией, имеющим ФВ ЛЖ ≤35% и II или III класс СН по NYHA (уровень доказательности B)
Установка ИКД рекомендована пациентам с дисфункцией ЛЖ вследствие перенесенного более 40 дней назад ИМ, имеющим ФВ ЛЖ менее 30% и I класс СН по NYHA (уровень доказательности A)
Установка ИКД рекомендована пациентам с неустойчивой ЖТ вследствие перенесенного ИМ с ФВ ЛЖ менее 40% и индуцируемой при ЭФИ ФЖ или устойчивой ЖТ (уровень доказательности B)
IIa класс
Имплантация ИКД оправдана у пациентов с обморочными состояниями неясной этиологии, значимой дисфункцией ЛЖ и дилатационной кардиомиопатией (уровень доказательности C)
Имплантация ИКД оправдана у пациентов с гипертрофической кардиомиопатией, имеющих один или более факторов риска ВСС (уровень доказательности C)
Имплантация ИКД оправдана для профилактики ВСС у пациентов с аритмогенной кардиомиопатией ПЖ, имеющих один или более факторов риска ВСС (уровень доказательности C)
Имплантация ИКД оправдана у пациентов с синдромом удлиненного интервала Q-T и обморочными состояниями и (или) ЖТ на фоне лечения β-адреноблокаторами (уровень доказательности B)
Имплантация ИКД оправдана у пациентов с синдромом Бругада, имеющих обморочные состояния или доказанную ЖТ, не приводящую к остановке сердца (уровень доказательности C)
Имплантация ИКД оправдана у пациентов с катехоламинергической полиморфной ЖТ, имеющих обморочные состояния и (или) доказанную ЖТ на фоне лечения β-адреноблокаторами (уровень доказательности C)
Имплантация ИКД оправдана у пациентов с саркоидозом сердца, гигантоклеточным миокардитом или болезнью Чагаса (уровень доказательности C)
IIб класс
Установку ИКД можно рассматривать у пациентов с неишемическим заболеванием сердца, ФВ ЛЖ ≤35% и I классом СН по NYHA (уровень доказательности C)
Установку ИКД можно рассматривать у пациентов с синдромом удлиненного интервала Q-T и факторами риска ВСС (уровень доказательности C)
Установку ИКД можно рассматривать у пациентов с обморочными состояниями и выраженным органическим поражением сердца, у которых при детальном инвазивном и неинвазивном обследовании причину заболевания установить не удалось (уровень доказательности C)
Установку ИКД можно рассматривать у пациентов с семейной кардиомиопатией, ассоциированной с внезапной смертью (уровень доказательности C)
Установку ИКД можно рассматривать у пациентов с некомпактным миокардом ЛЖ (уровень доказательности C)
ВТОРИЧНАЯ ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Пациентов с доказанной устойчивой ЖТ или реанимированных после остановки сердца ранее традиционно лечили препаратами с электрофизиологическими свойствами. Цель их применения состояла в предотвращении рецидива желудочковых тахиаритмических событий. ИКД стали основным методом лечения таких пациентов (рис. 30.22 и 30.23). В трех рандомизированных клинических исследованиях сравнивали эффективность ИКД и применения амиодарона в отношении увеличения продолжительности жизни пациентов высокого риска [48, 49].
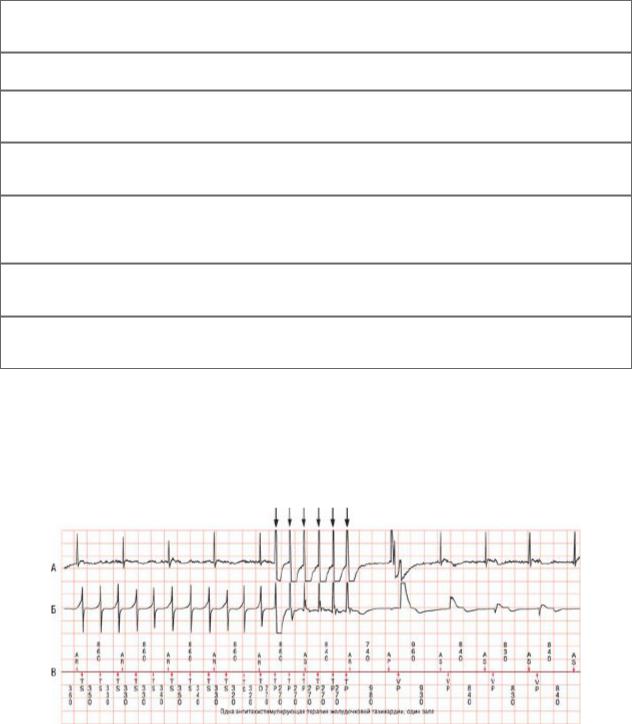
Рис. 30.22. Считывание кардиограммы двухкамерного ИКД: предсердные электрограммы (A); желудочковые электрограммы (Б); выделенные пояснения (В). Следует обратить внимание на ЖТ слева на записи (АВ-диссоциация), купированную путем антитахикардитической стимуляции (указано стрелками).

Рис. 30.23. Считывание электрограммы двухкамерного ИКД: следует обратить внимание на ЖТ слева на записи, купированную с помощью нанесения разряда высокого напряжения (указано стрелкой).
СРАВНЕНИЕ АНТИАРИТМИЧЕСКИХ ПРЕПАРАТОВ И ИМПЛАНТИРУЕМОГО ДЕФИБРИЛЛЯТОРА
Исследование AVID (The Antiarrhythmics Versus Implantable Defibrillator, исследование антиаритмических препаратов в сравнении с ИКД) [50] - первое крупномасштабное рандомизированное исследование, сравнивающее установку ИКД с применением антиаритмических препаратов у пациентов с доказанной ЖТ (55%), сопровождающейся клиническими симптомами или ФЖ (45%). У пациентов с ЖТ наряду с ФВ ЛЖ менее 40% отмечают обмороки или другие серьезные кардиальные симптомы. 81% этих пациентов страдали ИБС.
1016 пациентов с зарегистрированной ЖТ разделили на две группы: с ИКД и приемом антиаритмических препаратов (главным образом, амиодарона). Смертность в группе пациентов, принимающих антиаритмические препараты, составила 17,7, 25,3, и 35,9% после одного, двух и трех лет наблюдения соответственно. В группе ИКД она была значительно меньше: на 39% после одного года и на 27 и 31% - после двух и трех лет соответственно.
Результаты AVID были схожи во всех специфических подгруппах: при ИБС по сравнению с другими заболеваниями, при ФЖ по сравнению с ЖТ, во всех возрастных группах и при всех ФВ. Отмечена тенденция к меньшей эффективности ИКД у пациентов с ФВ ЛЖ более 35%.
КАНАДСКОЕ ИССЛЕДОВАНИЕ ИМПЛАНТИРУЕМЫХ ДЕФИБРИЛЛЯТОРОВ И ГАМБУРГСКОЕ ИССЛЕДОВАНИЕ ОСТАНОВКИ СЕРДЦА
В исследованиях CIDS (Canadian Implantable Defibrillator Study, канадское исследование ИКД) [48] и CASH (Cardiac Arrest Study Hamburg, гамбургское исследование остановки сердца) [49] были включены те же когорты пациентов, что и в AVID. В исследовании CIDS [48] 659 пациентов с ЖТ, сопровождающейся клиническими симптомами, предотвращенной внезапной смертью или обмороком, при существовании индуцируемой ЖТ были рандомизированы на две группы: с ИКД и эмпирическим приемом амиодарона. Двухлетняя смертность в группе приема ЛС составила приблизительно 22%. Отмечено снижение показателя общей смертности при имплантации ИКД (снижение риска на 19,6% за три года), но оно не достигло статистической значимости. Недавнее исследование сравнило долгосрочный прогноз у 120 пациентов, включенных в CIDS и состоявших под наблюдением в течение 11 лет [51]. Половине этих больных был имплантирован ИКД, а другая половина была рандомизирована для лечения амиодароном и принимала препарат после официального окончания исследования. При наблюдении на протяжении 5,6 года произошло
28 смертельных случаев в группе лечения амиодароном (47%) и 16 (23%) - в группе ИКД (p=0,021).
За это время у 49 пациентов (82%) развились побочные эффекты, связанные с приемом амиодарона, что потребовало отмены препарата. Хотя у этого исследования есть ограничения вследствие малой группы пациентов, оно предполагает, что стратегия использования амиодарона в качестве монотерапии первой линии для вторичной профилактики ВСС приводит к существенному проаритмогенному риску и высокой вероятности развития побочных эффектов (табл. 30.5), и это требует прекращения приема препарата. В этом небольшом исследовании преимущество ИКД в отношении снижении смертности от всех причин отмечали на протяжении более чем 10 лет наблюдения. У пациентов с умеренно измененной функцией ЛЖ, выжившим после остановки сердца, преимущество установки ИКД может только увеличиваться со временем.

Таблица 30.5. Сводная таблица зарегистрированных побочных эффектов, связанных с приемом амиодарона, и больших исследований с использованием препарата
Исследование |
GESIC |
CHF |
MADI |
EMIA |
CAMIA |
AVI |
CID |
CAS |
AMIOVIR |
CID |
SCD |
|
A |
- |
T |
T |
T* |
D |
S |
H |
T |
S |
- |
|
|
STA |
|
|
|
|
|
|
|
|
HeF |
|
|
T |
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
Поражение легких |
- |
3,0 |
3,0 |
4,0 |
3,8 |
5,0 |
5,7 |
0 |
- |
10,0 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Глазные симптомы |
- |
- |
- |
0,7 |
0,8 |
- |
14,5 |
- |
- |
10,0 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Фоточувствительно |
- |
- |
- |
- |
- |
- |
10,3 |
- |
- |
- |
- |
сть |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Брадикардия |
3,8 |
1,8 |
3,0 |
0,1 |
1,3 |
- |
3,0 |
- |
- |
20,0 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Проаритмия |
- |
- |
- |
0,0 |
0,3 |
0,2 |
- |
- |
- |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Изменение цвета |
- |
0,3 |
- |
0,0 |
1,9 |
- |
6,3 |
- |
- |
18,3 |
- |
кожи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гастроинтестинальн |
0,8 |
6,0 |
- |
2,0 |
2,1 |
- |
- |
- |
- |
16,7 |
- |
ые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Печеночные |
- |
1,2 |
- |
0,8 |
1,0 |
- |
- |
- |
- |
15,0 |
- |
расстройства |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Нейротоксичность |
- |
4,8 |
- |
1,1 |
3,1 |
- |
17,2 |
- |
- |
48,3 |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Тремор |
- |
- |
- |
- |
- |
- |
15,4 |
- |
- |
- |
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
Нарушения сна |
- |
- |
- |
- |
1,7 |
- |
19,3 |
- |
- |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Нарушения функций |
- |
- |
- |
- |
- |
- |
- |
- |
- |
20,0 |
- |
щитовидной железы |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гипертиреоз |
- |
0,6 |
- |
0,5 |
0,6 |
- |
- |
3,3 |
- |
- |
- |
|
|
|
|
|
|
|
|
|
|
|
|
Гипотиреоз |
- |
0,6 |
1,0** |
0,0 |
3,3 |
16,0 |
- |
- |
- |
- |
6,0 |
|
|
|
|
|
|
|
|
|
|
|
|
Недостаточная |
- |
|
- |
9,4 |
7,3 |
- |
- |
- |
- |
- |
- |
приверженность |
|
|
|
|
|
|
|
|
|
|
|
лечению |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
*- причины для прекращения приема амиодарона.
**- данные всех традиционно леченных пациентов (n=101, включая n=74 пациентов, принимавших амиодарон).
В исследовании CASH [49] в общей сложности 346 пациентов с остановкой сердца в анамнезе были рандомизированы на группы: ИКД, прием метопролола, амиодарона или пропафенона. После включения 230 пациентов, которым был назначен пропафенон, амиодарон, метопролол или ИКД, в группу пропафенона лечение было остановлено из-за увеличения смертности по сравнению с группой ИКД [49]. Это исследование продемонстрировало преимущество, достигающее 37%, в выживаемости пациентов с ИКД по сравнению с лечением метопрололом или амиодароном в течение двух лет. Двухлетняя смертность в этих группах составляла 19,6%.
Следует отметить, что ФВ ЛЖ у пациентов в исследовании CASH (0,46) была намного выше, чем в AVID (0,32) или CIDS (0,34). В CASH также были включены пациенты с первичной ФЖ.
Данные, полученные в исследованиях AVID, CIDS и CASH (только группы амиодарона и ИКД), были использованы в метаанализе [52], который показал значительное снижение смертности от любых причин при ИКД; средний относительный риск составил 0,72. Снижение относительного риска смерти в группе ИКД на 28% в значительной степени было результатом снижения показателя аритмической смерти. У пациентов с ИКД в течение шести лет выживаемость была выше в среднем на 4,4 мес. У больных с ФВ ЛЖ ≤35% результаты установки ИКД были более отчетливыми, чем у пациентов с сохранной функцией желудочков. Это также было установлено при ретроспективном анализе исследования CIDS [53], который показал, что три клинических фактора - возраст ≥70 лет, ФВ ЛЖ ≤35% и СН (класс III или IV) - прогностические и способствуют увеличению риска смерти. Наибольший успех от установки ИКД отмечен среди пациентов, у которых присутствовали эти факторы.
ВТОРИЧНАЯ ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ ПРИ ДИЛАТАЦИОННОЙ КАРДИОМИОПАТИИ
Стратификация риска у больных с идиопатической дилатационной кардиомиопатией в отличие от пациентов с ИБС - намного более трудная задача. Во всех исследованиях, связанных с ИКД, эти пациенты были представлены недостаточно. В AVID, CASH и CIDS только у 15, 11 и 10% пациентов соответственно была идиопатическая дилатационная кардиомиопатия. Было показано снижение общей смертности у пациентов с неишемической дилатационной кардиомиопатией на 20-40% по сравнению с традиционным лечением [48-50], но доверительные интервалы для больных с неишемической дилатационной кардиомиопатией были намного шире, чем для пациентов с ИБС. В метаанализе этих трех исследований только у 225 из 1832 пациентов была зарегистрирована неишемическая кардиомиопатия [52]. Относительный риск снижения общей смертности у них составил 0,78, что было сопоставимо с относительным риском в когорте в целом (0,72). Для этих пациентов 95% ДИ колебался от 0,45 до 1,37.
Клиническое значение обмороков при дилатационной кардиомиопатии при отсутствии доказанной ЖТ все еще остается неясным. Нерандомизированное исследование показало похожие случаи оправданных срабатываний ИКД у пациентов, которым он был имплантирован по поводу обмороков, и у больных, которым дефибриллятор был имплантирован после предотвращенной внезапной смерти, эпизодов ЖТ или ФЖ [54]. Другое исследование продемонстрировало значительно более низкую частоту событий в группе пациентов с ИКД, чем у больных, получавших традиционное лечение [55]. Следовательно, кажется разумным лечить пациентов с неишемической дилатационной кардиомиопатией и обмороками точно так же, как и после предотвращения ВСС, если другие причины обморока исключены.
ПЕРВИЧНАЯ ПРОФИЛАКТИКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Существуют три различных терапевтических метода, которые обеспечивают первичную профилактику ВСС у пациентов с органическими заболеваниями сердца:
•лечение с использованием препаратов, не обладающих электрофизиологическими свойствами;
•лечение с использованием препаратов с определенными электрофизиологическими свойствами;
•установка ИКД.
ПРЕПАРАТЫ БЕЗ ОПРЕДЕЛЕННЫХ ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ СВОЙСТВ
Согласно мнению специальной комиссии Европей-ского общества кардиологов по ВСС, существует, по крайней мере, три различных класса препаратов, не обладающих электрофизиологическими свойствами, но, как было показано, они уменьшают не только смертность от всех причин, но также и от ВСС. Лечение иАПФ пациентов после ИМ и (или) с ХСН привело к снижению ВСС до 30-54% [56, 57]. Второй класс препаратов, уменьшающих частоту ВСС, - блокаторы рецепторов альдостерона (табл. 30.6). Исследование RALES [58] продемонстрировало снижение относительного риска ВСС на 30%. Механизм этого защитного действия окончательно не ясен и может включать профилактику гипокалиемии и регресс интерстициального фиброза, связанного с альдостероном, хотя и существует риск гиперкалиемии. Эти результаты были получены в достаточно большом исследовании, охватившем 6632 пациентов с дисфункцией ЛЖ, выживших после острого ИМ [59]. В этом крупномасштабном рандомизированном исследовании применение блокатора альдостерона эплеренонаΡ способствовало снижению смертности от всех причин, которая была первичной конечной точкой исследования (относительный риск 0,85, 95% ДИ 0,75-0,96, p=0,008). Смертность от ВСС при
приеме эплеренонаΡ также значительно уменьшилась (относительный риск 0,79, 95% ДИ 0,64-0,97, p=0,03). Наконец, по данным нескольких рандомизированных контролируемых клинических исследований, препараты, снижающие концентрацию липидов, могут уменьшить не только общую смертность, но и частоту ВСС у пациентов с ишемией [60, 61].
Таблица 30.6. Исследования первичной профилактики аритмии: относительный риск смертности от всех причин
Антиаритми-ческое |
Число |
Относительный риск смерти (95% |
p |
средство |
пациентов |
ДИ) |
|
|
|
|
|
Антагонисты натриевых каналов у пациентов после инфаркта миокарда |
|
||
|
|
|
|
Класс IA |
6582 |
1,19 (0,99-1,44) |
0,07 |
|
|
|
|
Класс IB |
14033 |
1,06 (0,89-1,26) |
0,50 |
|
|
|
|
Класс IC |
2538 |
1,31 (0,95-1,79) |
0,0006 |
|
|
|
|
ФлекаинидΡ, энкаинидΡ |
1455 |
3,6 (1,7-8,5) |
0,0006 |
|
|
|
|
β-Адреноблокаторы |
|
|
|
|
|
|
|
Во время ИМ |
28970 |
0,87 (0,77-0,98) |
0,02 |
|
|
|
|
После ИМ |
24298 |
0,77 (0,70-0,84) |
‹0,0001 |
|
|
|
|
Карведилол |
1959 |
0,77 (0,60-0,98) |
0,03 |
|
|
|
|
|
- |
0,74 (0,51-1,06) |
0,098 |
|
|||
|
|
|
|
β-Адреноблокаторы у пациентов с ХСН |
|
|
|
|
|
|
|
Карведилол |
1094 |
0,44 (0,28-0,69) |
‹0,0001 |
|
|
|
|
|
- |
0,51 (0,28-0,92) |
- |
|
|||
|
|
|
|
Бисопролол |
2647 |
0,66 (0,54-0,80) |
‹0,0001 |
|
|
|
|
|
- |
0,56 (0,39-0,80) |
‹0,01 |
|
|||
|
|
|
|
Метопролол |
3991 |
0,66 (0,53-0,81) |
0,0009 |
|
|
|
|
|
- |
0,59 |
0,0002 |
|
|||
|
|
(0,045-0,78) |
|
|
|
|
|
Класс III антиаритмических препаратов |
|
|
|
|
|
|
|
Амиодарон |
6500 |
0,87 (0,78-0,99) |
0,03 |
|
|
|
|
|
- |
0,71 (0,59-0,85) |
0,0003 |
|
|||
|
|
|
|
Соталол |
3121 |
1,065 (1.15-2,36) |
‹0,006 |
|
|
|
|
