
- •С.М. Разинова, в.Г. Сидоров молекулярная физика определение отношения теплоемкости при постоянном давлении к теплоемкости при постоянном объеме методом клемана-дезорма
- •Утверждено в качестве методического пособия
- •Лабораторная работа № 21
- •Введение первое начало термодинамики. Адиабатный процесс.
- •1.Первое начало термодинамики. Теплоемкость идеального газа.
- •2. Адиабатный процесс. Формула Пуассона.
- •Описание установки и принципа измерений.
- •Порядок выполнения работы. Первый способ определения отношения теплоемкостей (по формуле 25).
- •Второй способ определения отношения теплоемкостей (по формуле 27).
- •Учебное издание
2. Адиабатный процесс. Формула Пуассона.
Адиабатным называют процесс, в котором отсутствует обмен энергией в форме теплоты (теплообмен) между системой и внешней средой. Адиабатный процесс подчиняется условию: dQ=0.
Практически адиабатный процесс осуществляется при достаточно быстром расширении или сжатии газа. Условие адиабатности будет выполнено, если процесс протекает так быстро, что теплообмен между газом и внешней средой не успевает произойти.
Из первого начала термодинамики (1), следует, что в адиабатическом процессе
dА= - dU, (17)
т.е. работа совершается системой за счет убыли ее внутренней энергии.
Из (8) следует, что в адиабатном процессе
![]() ,
(18)
,
(18)
из (17) и (18) видно, что при адиабатном расширении dV>0, dА=pdV>0 , тогда dT<0 , т.е. газ, охлаждается, а при адиабатном сжатии dV<0, dА=pdV<0 и dT>0, т.е. газ нагревается.
Найдем уравнение адиабаты для идеального газа, т.е. уравнение, связывающее параметры состояния идеального газа, например, р и V при адиабатном процессе. Для этого перепишем уравнение (17) в форме:
![]() ,
,
а
величину
![]() найдем из уравнения состояния газа (10)
путем
найдем из уравнения состояния газа (10)
путем
дифференцирования этого уравнения по всем переменным:
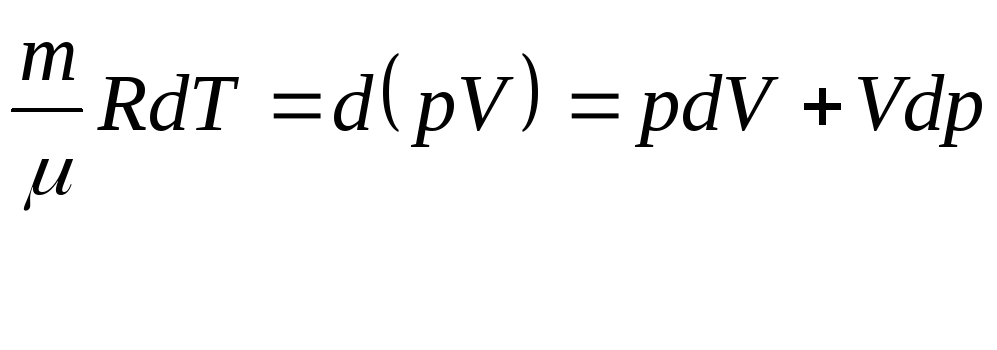 .
.
Таким
образом,
![]() ,
или, учитывая уравнение Майера (14),
получим:
,
или, учитывая уравнение Майера (14),
получим:
![]()
Разделив
обе части этого уравнения на
![]() получим:
получим:
![]()
где:
![]() -
безразмерная величина, называемаяпоказателем
адиабаты.
Пренебрегая зависимостью Cv
от температуры, можно считать, что для
данного газа g=const
.
-
безразмерная величина, называемаяпоказателем
адиабаты.
Пренебрегая зависимостью Cv
от температуры, можно считать, что для
данного газа g=const
.
Так
как ![]() и
и![]() ,
,
то написанное выше уравнение можно представить в виде:
![]() ,
или
,
или
![]() откуда следует, что
откуда следует, что
pVg = const (19)
Уравнение (19) называют формулой Пуассона.
В адиабатном процессе изменяются все параметры состояния: объем, давление и температура.
Соотношение между давлением и температурой, а также между объемом и температурой идеального газа в адиабатном процессе легко получить из (19) и уравнения Менделеева- Клапейрона (10):
![]() ;
;
![]()
Линию, изображающую адиабатный процесс на диаграмме состояния, называют адиабатой. На рис. 3 сплошной линией показан вид адиабаты. Для сравнения на том же рисунке пунктирной линией изображена изотерма, соответствующая температуре газа в состоянии 1. Так как для любого идеального газа показатель адиабаты g>1, то на диаграмме адиабата идет круче, чем изотерма. Объясняется это тем, что при адиабатном сжатии (процесс 1-3) увеличение давления обусловлено не только уменьшением объема газа, как при изотермическом сжатии, но также еще и увеличением температуры.
При адиабатном расширении температура газа уменьшается, поэтому давление газа падает быстрее, чем при изотермическом расширении (процесс 1-2).
Описание установки и принципа измерений.
Определение отношения Сp/Сv для воздуха основано на осуществлении адиабатного расширения и использовании для этого процесса формулы Пуассона (19) pVg = const: где g = Ср/Cv.
Экспериментальная установка для определения g методом Клемана-Дезорма состоит из стеклянного баллона А (рис. 4), который соединяется, с одной стороны, с U-образным манометром М, с другой стороны, посредством трехходового крана К - либо с атмосферой, либо с насосом. Манометр М, наполненный какой-либо жидкостью (керосином, подкрашенной водой и т.д.), позволяет по разнице уровней h жидкостей в левом и правом коленах измерить в баллоне давление р, избыточное над атмосферным: р=rg h , где r - плотность жидкости (чем меньше r, тем заметнее разность уровней h ). Баллон А обшит темным материалом для уменьшения теплообмена с окружающей средой путем излучения.
Для осуществления адиабатного расширения предварительно в баллон А накачивают воздух, для чего трехходовой кран К соединяют с насосом и после накачивания кран К перекрывают. Манометр М в момент закрытия крана показывает некоторую разницу уровней жидкости, которая в течение нескольких последующих минут изменяется. Это объясняется тем, что процесс нагнетания воздуха подобен адиабатному сжатию, вследствие чего воздух в баллоне нагревается, а затем после закрытия крана, он постепенно изохорически охлаждается от окружающей среды до комнатной температуры. В результате давление в баллоне, превосходящее атмосферное, начинает уменьшаться, поэтому изменяется и разность уровней жидкости в манометре. Когда температура в баллоне сравняется с комнатной, разность уровней в манометре остается постоянной, равной величине Н, а давление в баллоне станет равным ратм + r g H.
Затем осуществляется адиабатное расширение воздуха, для чего краном К соединяют баллон с атмосферой на очень короткое время, при этом уровни жидкости в манометре моментально сравниваются. Предварительно сжатый воздух быстро выходит из баллона, т.е. резко адиабатно расширяется и поэтому охлаждается, а затем медленно (в течение 2-3 минут) воздух в баллоне изохорически нагревается, вследствие чего давление в нем увеличивается и разность уровней жидкостей в манометре снова начинает изменяться до тех пор, пока воздух в баллоне не нагреется до, комнатной температуры. Тогда манометр покажет разницу уровней h, давление, избыточное над атмосферным, будет равно r g h, а давление в баллоне будет ратм + r g h.
Докажем, что величину g = Ср/Cv , легко вычислить по измеренным величинам Н и h.
Представим графически процессы, происходящие с воздухом в баллоне (рис. 5). Построение графика начнем с того момента времени, когда предварительно накачанный в баллон воздух охладился до комнатной температуры Т1 (состояние 1 на рис. 5), а давление р1 стало равным
ратм + r g H = р0 + r g H.
Из состояния 1 (р1, V1, T1) воздух, адиабатно расширяясь, переходит в состояние 2, при этом давление сравнивается с атмосферным р0, а температура понижается и становится равной Т2Т1.
Затем, при закрытом кране, т.е. при неизменном объеме воздух в баллоне изохорически нагревается (процесс 2-3) до комнатной Т1 температуры, а давление при этом становится равным р2 = р0 + r g h.
Следует заметить, что в процессе 1-2 воздух выходит из баллона, поэтому масса воздуха в баллоне изменяется. Чтобы в дальнейшем иметь возможность воспользоваться газовыми законами, справедливыми для постоянной массы газа, будем состояние 1 относить к объему V1 ТОлько той части массы газа в баллоне объемом V2 , которая после расширения до состояния 2 примет значение, равное объему баллона V2 , т.е. V1 < V2.
Точки 1 и 3, имеющие одинаковую температуру Т1, теоретически расположены на изотерме, поэтому по закону Бойля-Мариотта можно записать:
р1V1 = р2V2 , (20)
Точки 1 и 2 лежат на адиабате, следовательно по формуле Пуассона (19) параметры этих состояний связаны соотношением:
![]() ,
(21)
,
(21)
Если уравнение (20) возвести в степень и разделить на уравнение (21), то получим:
![]() или
или
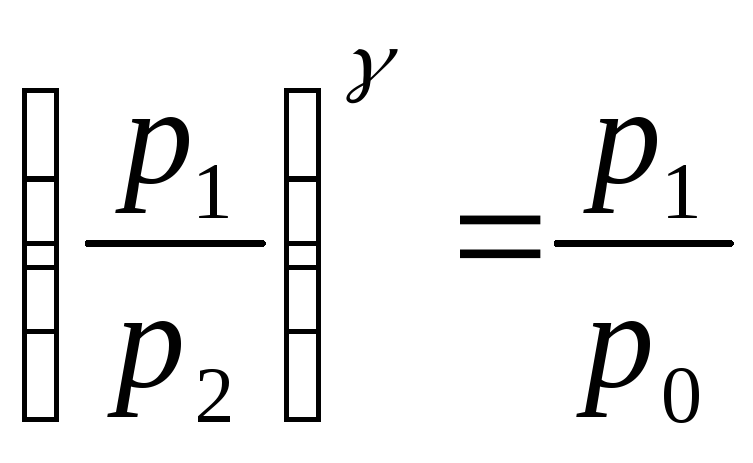 , (22)
, (22)
Логарифмируя (22), находим:
![]() ,
(23)
,
(23)
Подставляя в (23) значение р1 = р0 +r g H и р2 = р0 + r g h получим:
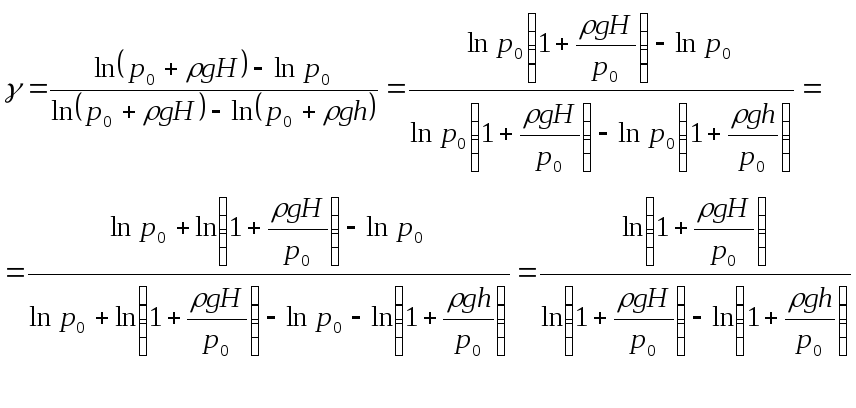 .
(24)
.
(24)
Так
как давление r
g H<<
р0
и r
g h <<
р0
то
![]() <<1
и
<<1
и![]() <<1,
поэтому воспользуемся разложением в
ряд вида:
<<1,
поэтому воспользуемся разложением в
ряд вида:
![]() .
Если в этом разложении x<<1 ,
то можно
пренебречь членами второго порядка,
тогда ln(1+x) »
x. Аналогично полученному можно написать,
что
.
Если в этом разложении x<<1 ,
то можно
пренебречь членами второго порядка,
тогда ln(1+x) »
x. Аналогично полученному можно написать,
что
![]() и
и![]() .
Таким образом выражение (24) преобразуется
к виду:
.
Таким образом выражение (24) преобразуется
к виду:
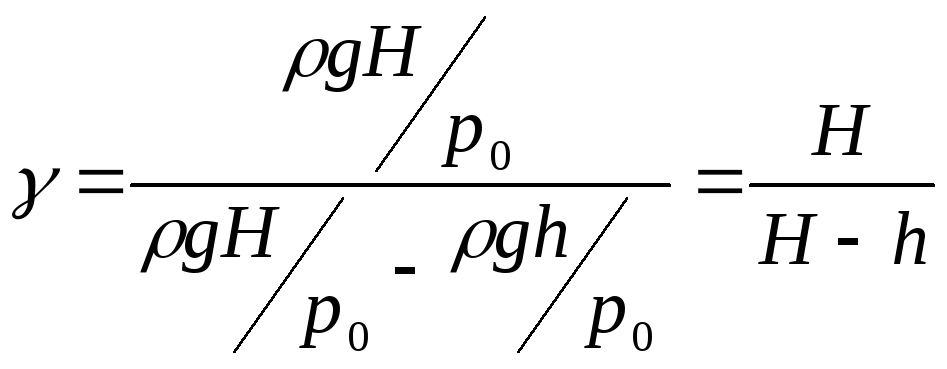 ,
(25)
,
(25)
Уточним
в формуле (25) величину h . Осуществляя
практически адиабатное расширение
(процесс. 1-2 рис. 5), мы не можем закрыть
кран точно в момент окончания этого
процесса. Однако, если кран закрыть
несколько позже окончания адиабатного
процесса, то газ еще некоторое время
будет продолжать расширяться при
постоянном атмосферном давлении, т.е.
изобарически (процесс 2-2¢
на рис. 5), и в опыте вместо значения h мы
всегда будем получать значение h¢,
соответствующее отрезку 2¢-3¢,
причем h¢
тем сильнее будет отличаться от h , чем
больше будет это время запаздывания. С
учетом сказанного выше, формула (25) дает
несколько заниженное значение величины
![]() .
.
Однако, величину h=hист, соответствующую моменту окончания адиабатного расширения, можно точнее определить следующим образом.
Опыт показывает, что величины h¢ и t связаны соотношением:
![]() ln
h¢
= ln hист
- At, (26)
ln
h¢
= ln hист
- At, (26)
где А- константа, зависящая от параметров установки; t - время изобарического расширения (время открытия крана); hист - разность уровней жидкости в манометре в момент времени t =0, т.е. разность уровней, которую мы должны были бы получить, если бы смогли закрыть кран сразу после адиабатного расширения.
Величину
hист
легко определить, если зависимость ln
h¢
от времени t (26) представить графически
(рис. 6). Получив по экспериментальным
данным прямую АВ, можно ее продолжить
до пересечения с осью ординат и в т. С
пересечения прямой с осью координат
(т.е. в точке, соответствующей t=0)
прочесть значение ln hист
,а затем определить величину hист.
Подставив в (25) значение hист
вместо h получим более точное значение
![]() :
:
![]() (27)
(27)
