
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Лекции по общей биохимии
.pdf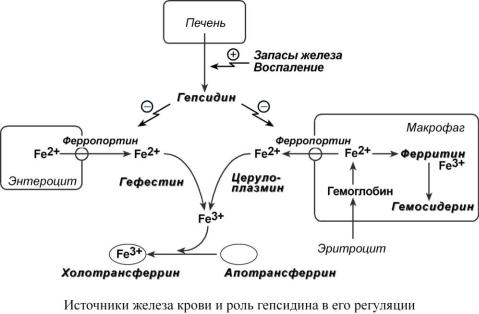
Обмен железа |
320 |
|
|
3. Система IRE/IRP, позволяющая каждой клетке регулировать количество потребляемого железа.
Функции гепсидина
Среди белков-регуляторов обмена железа к настоящему времени наиболее хорошо изучен гепсидин, олигопептид из 25 аминокислот. Гепсидин синтезируется в печени при достаточном количестве железа в гепатоците или под действием цитокинов.
Действие гепсидина заключается в снижении активности белка ферропортина, отвечающего за выход ионов железа из клетки в кровь:
1.В энтероците действие гепсидина приводит к тому, что большая часть железа остается в клетке, запасается в ферритине и теряется при слущивании кишечного эпителия.
2.При действии гепсидина на макрофаг происходит задержка железа внутри макрофага.
Являясь белком острой фазы, гепсидин повышается при любых воспалительных процессах, протекающих в организме, и при бактериальных инфекциях. Повышение его продукции происходит под влиянием провоспалительных цитокинов, наиболее эффективным из которых является интерлейкин-6. Образующийся избыточный гепсидин, уровень которого может повышаться в сотни раз, связывается с ферропортином и вызывает его лизосомальную деградацию. Это блокирует выход железа из макрофагов и энтероцитов, вызывая гипоферремию. Недостаток железа в крови снижает его использование для эритропоэза – развивается "анемия воспаления".
Система IRE/IRP
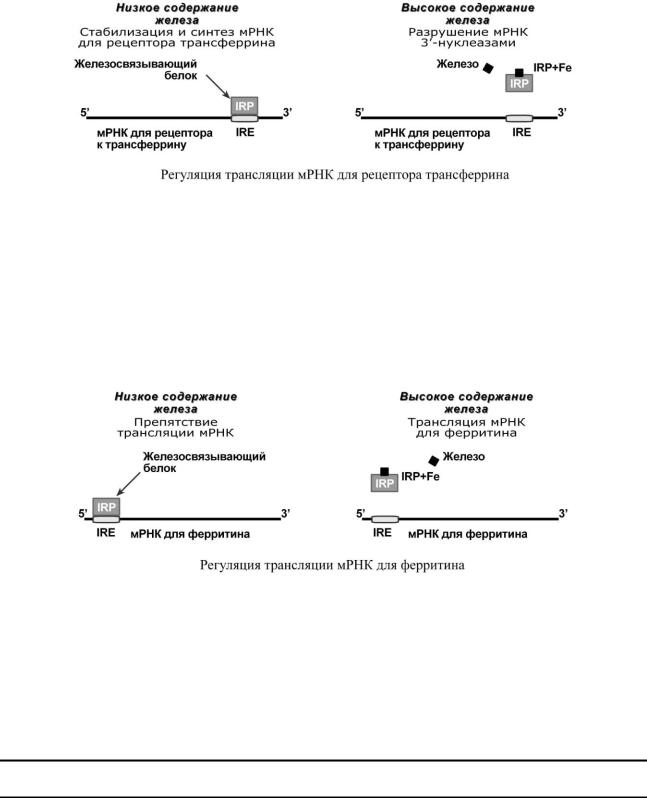
Система IRE/IRP (англ. iron-responsive–element – железочувствительный элемент; iron-responsive element-binding proteins – белок, связывающий железочувствительный элемент) обеспечивает регуляцию:
o синтеза рецепторов к трансферрину, o синтеза ферритина.
Молекулы IRP способны связываться с участком IRE на матричных РНК двух белков – рецептора трансферрина и ферритина. При сниженной концентрации железа в клетке белок IRP активный, при высоком содержании – образуется комплекс IRP+Fe и белок инактивируется.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2020г) |
321 |
|
|
|
|
|
Присоединение активного IRP к 3'-концу мРНК рецептора трансферрина (при низком уровне железа) защищает мРНК от разрушения 3'-РНКазами и, как следствие, она существует дольше, образуется больше рецепторов, связывается больше холотрансферрина и повышается поток железа в клетки.
Присоединение активного IRP к 5'-концу мРНК ферритина (при низком уровне железа) не позволяет ей участвовать в процессе трансляции и синтезе новых молекул ферритина. Когда концентрация железа в клетке возрастает, оно присоединяется к IRP и снижает его сродство к матричной РНК. Конечным результатом является увеличение синтеза молекул ферритина, депонирующего железо.
ВЫВЕ ДЕНИЕ
В сутки обычные потери железа составляют 1-2 мг и происходят несколькими путями: o с желчью
o вместе со слущивающимся эпителием ЖКТ, o десквамация кожи,
o у женщин детородного возраста – от 14 до 140 мг/месяц,
oвыпадение волос, срезание ногтей.
НАР У ШЕ НИЕ ОБМ Е Н А ЖЕ Л Е З А
Избыток железа
Существует аутосомно-рецессивное заболевание гемохроматоз, связанное с нарушением гепсидиновой регуляции и избыточным всасыванием железа в кишечнике. В результате железо накапливается в органах и тканях: печени, поджелудочной железе, миокарде, селезенке, коже, эндокринных железах и др. Общее содержание железа в организме достигает 20-60 г при норме 2-4 г. Постепенно развиваются цирроз печени, кардиомиопатии, сахарный диабет 1 типа, артрит.
Обмен железа |
322 |
|
|
Железодефицит
При недостаточности железа в организме мобилизация резервов происходит в следующем порядке:
o железо из депо (ферритин),
o затем в клетках (кроме эритроидных) снижается количество гемопротеинов до жизнеспособного минимума,
o далее истощаются запасы сывороточного железа (холотрансферрин), o в последнюю очередь страдает синтез гемоглобина.
Таким образом, железодефицитная анемия является проявлением крайнего дефицита железа, и нормальная концентрация гемоглобина крови не должна быть критерием обеспеченности организма железом.
Причины
Причинами железодефицита являются недостаток его в пище, заболевания ЖКТ со снижением всасывания (гастриты), потери железа с кровью при менструальных, кишечных или иных кровотечениях. У новорожденных и грудных детей недостаток железа связан в первую очередь с недополучением его при внутриутробном развитии, и также в связи с ускоренным ростом в первый год жизни (физиологическая анемия).
Симптомы
Недостаточный синтез цитохромов, железосодержащих белков и нарушение доставки кислорода к тканям (при снижении содержания гемоглобина) вызывает ряд специфических и неспецифических симптомов:
o ухудшение внимания и памяти у детей и взрослых,
oуплощение, неровность и ломкость ногтей, появление исчерченности, белых пятен и полосок на ногтях,
o выпадающий и секущийся волос,
o поражение эпителия, проявляющееся в сухости и трещинах кожи рук и ног,
oнеинфекционный ларингофаринготрахеит (гиперемия и охриплость), что дезориентирует врача,
oмышечная слабость:
-общая утомляемость,
-недостаточное сокращение сфинктеров мочевого пузыря, при этом характерным признаком является выделение нескольких капель мочи при резком кашле, смехе, чихании,
-недостаточное сокращение кардиального сфинктера пищевода, что позволяет забрасываться соляной кислоте в пищевод и вызывать изжогу,
o атрофический гастрит – может быть как причиной, так и следствием железодефицита,
половина больных гастритом имеет недостаток железа,
o обострение ИБС и других сердечно-сосудистых заболеваний, так как усиливает гипоэнергетическое состояние клеток (снижение содержания цитохромов в миокардиоцитах),
oизвращение обонятельных предпочтений – нравится запах краски, бензина, выхлопных газов, резины, мочи,
oизвращение вкусовых предпочтений – больные едят мел, штукатурку, уголь, песок, мясной фарш, лед.
ГЕМ ОПРОТ ЕИН Ы . ОБМЕН ГЕМ А
Гемопротеины являются подвидом хромопротеинов и подразделяются на неферментативные белки и ферменты:
o гемоглобин (82% общего количества гема организма) локализован в эритроцитах и клетках костного мозга,
o миоглобин скелетных мышц и миокарда (17%),
oферменты – ферменты дыхательной цепи, P450, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза и т.д. – менее 1%.
С ТР ОЕ НИЕ И СИ Н ТЕ З ГЕ М А
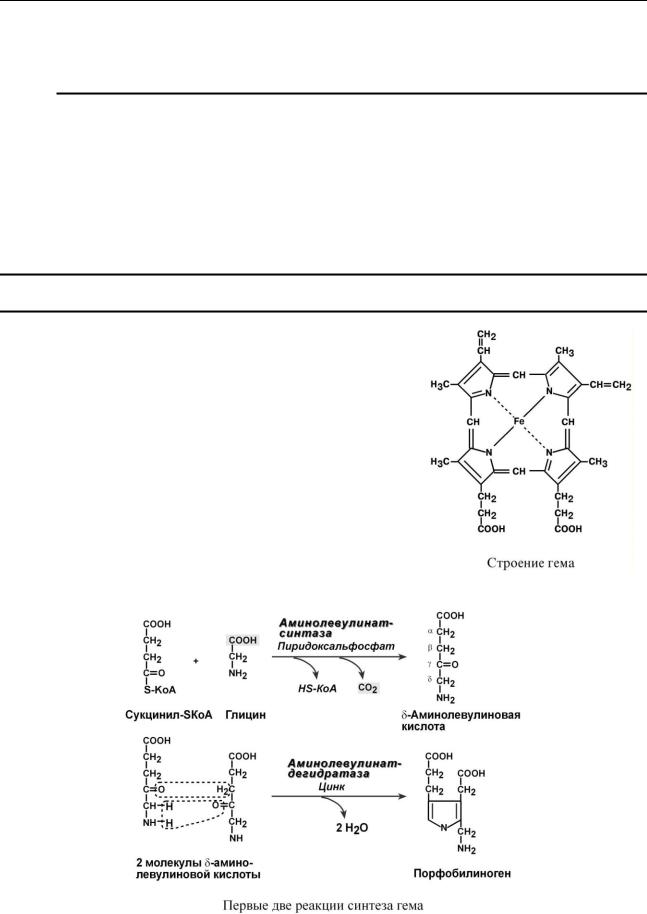
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника, в меньшем количестве в остальных тканях.
Первая реакция синтеза с участием -аминолевули- нат-синтазы ( - греч. "дельта") происходит в митохондриях.
Гемопротеины. Обмен гема |
324 |
|
|
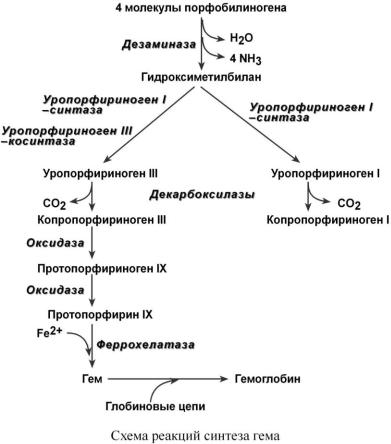
Следующая реакция при участии аминолевулинатдегидратазы протекает в цитозоле. После синтеза порфобилиногена четыре его молекулы конденсируются в гидроксиме-
тилбилан, который далее превращается в уропорфириноген типа I и уропорфириноген типа III. В синтезе обоих видов порфиринов принимает участие уропорфириноген I–синтаза, в образовании уропорфириногена III дополнительно принимает участие фермент уропорфири-
ноген III–косинтаза.
Далее уропорфириногены превращаются в соответствующие копропорфириногены. Копропорфириноген III возврашается в митохондрии и окисляется в протопорфириноген IX и далее в протопорфирин IX. Последний после связывания с железом образует гем, реакцию катализирует феррохелатаза (гемсинтаза).
Р Е Г У Л Я Ц И Я С И Н Т Е З А Г Е М А
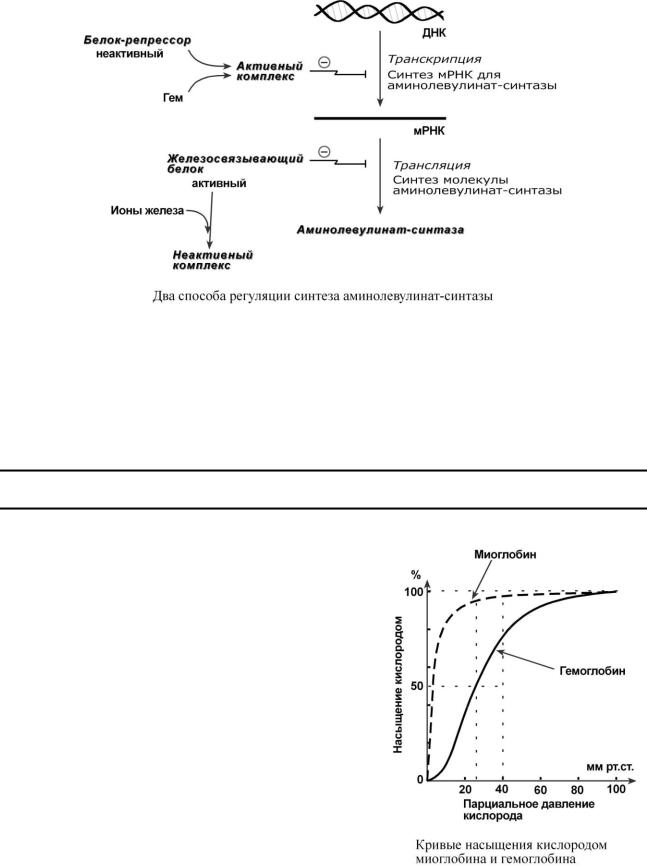
Скорость синтеза глобиновых цепей зависит от наличия гема, он ускоряет биосинтез "своих" белков.
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза. Гем после взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется
исинтез фермента прекращается. Также имеется отрицательный аллостерический эффект гема на фермент.
Сдругой стороны, достаточное количество ионов железа оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы. В клетке имеется особый железосвязывающий белок, который в отсутствии ионов железа обладает сродством к мРНК фермента
иблокирует ее трансляцию в рибосоме, т.е. синтез белковой цепи. При наличии ионов железа они связываются с этим железосвязывающим белком, образуя с ним неактивный комплекс и это инициирует синтез фермента.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2020г) |
325 |
|
|
|
|
|
Положительным модулятором этого же фермента служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
В печени повышению активности аминолевулинатсинтазы способствуют соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента.
М И О Г Л О Б И Н
Миоглобин является одиночной полипептидной цепью, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани.
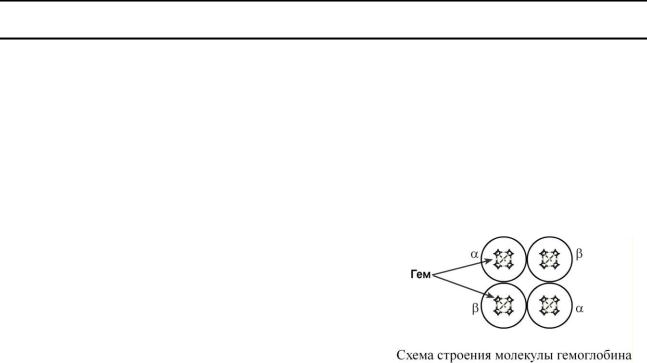
Миоглобин обладает более высоким сродством к
кислороду по сравнению с гемоглобином. Это свойство обусловливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
Кривые насыщения кислородом показывают отличия миоглобина и гемоглобина:
oодно и то же 50%-е насыщение достигается при совершенно разных концентрациях кислорода – около 26 мм рт.ст. для гемоглобина и 5 мм рт.ст.
для миоглобина,
oпри парциальном давлении кислорода от 26 до 40 мм рт.ст. (в тканях) гемоглобин насыщен на 50-80%, тогда как миоглобин – почти на 100%.
Гемопротеины. Обмен гема |
326 |
|
|
Таким образом, миоглобин остается оксигенированным до того момента, пока количество кислорода в клетке не снизится до предельных величин. Только после этого начинается отдача кислорода для реакций метаболизма.
ГЕ М О Г Л О Б И Н
СТ Р О Е Н И Е Г Е М О Г Л О Б И Н А
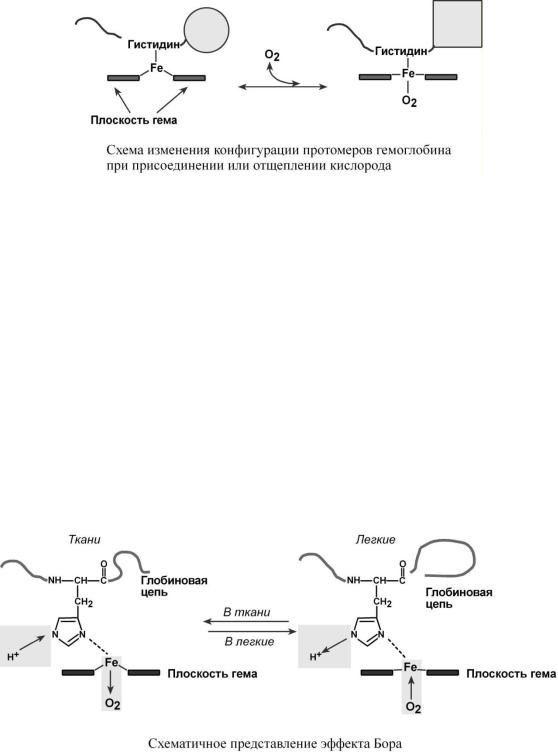
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Протомеры соединяются друг с другом благодаря образованию гидрофобных, ионных, водородных связей. При этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемо-
глобине могут быть представлены различными типами полипептидных цепей: α ("альфа"), β ("бета"), ε ("'эпсилон"), ("гамма"), ("дельта"), ("кси"). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, вопервых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи
пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
НО Р М А Л Ь Н Ы Е И П А Т О Л О Г И Ч Е С К И Е
ФО Р М Ы Г Е М О Г Л О Б И Н А
Нормальные формы
Существует несколько нормальных вариантов гемоглобина:
oHbР – примитивный гемоглобин, содержит 2 - и 2 -цепи, встречается в эмбрионе между 7-12 неделями жизни,
oHbF – фетальный гемоглобин, содержит 2α и 2 -цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
o HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
o HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α и 2 -цепи,
oHbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
oHbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого" участка. При дезоксигенации гемоглобина участок "раскрывается" и связывает одну мо-

biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2020г) |
327 |
|
|
|
|
|
лекулу гемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцита и при прохождении капилляров гемолиз.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Р Е Г У Л Я Ц И Я П Р И С О Е Д И Н Е Н И Я К И С Л О Р О Д А К Г Е М О Г Л О Б И Н У
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооператив-
ное взаимодействие.
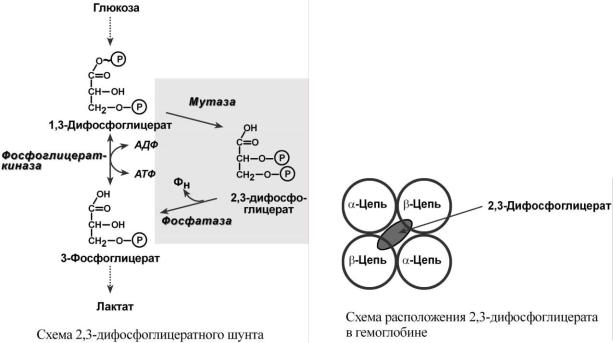
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость
Гемопротеины. Обмен гема |
328 |
|
|
гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R- форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина, в легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
H-Hb + O2 HbO2 + H+
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях кислород отрывается и ионы водорода присоединяются к остаткам гистидина, образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий кислород "вытесняет" ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
biokhimija.ru |
Тимин О.А. Лекции по общей биохимии (2020г) |
329 |
|
|
|
|
|
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
При снижении концентрации кислорода в эритроцитах повышается содержание 2,3-дифосфоглицерата. Он располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, аминогруппами радикалов лизина и гистидина.
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду. Это имеет особенное значение при подъеме на высоту, при длительной нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Н А Р У Ш Е Н И Е С И Н Т Е З А Г Е М О Г Л О Б И Н А
ПОР ФИР ИИ
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX. Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность
уропорфириноген-I-синтазы снижена на 50%.
