
- •10.1. Основные теории воспаления
- •10.2. Этиология воспаления
- •10.4. Патогенез воспаления
- •10.4.1. Роль повреждения ткани в развитии воспаления
- •10.4.2. Медиаторы воспаления
- •10.4.5. Выход лейкоцитов в воспаленную ткань (эмиграция лейкоцитов)
- •90%. Гранулоциты фагоцитируют бактерии или иные инородные тела и частицы
- •10.4.6. Восстановительные процессы в воспаленной ткани
- •000Д. В качестве других факторов роста для фибробластов называют соматотропин,
- •10.5. Хроническое воспаление
- •1. Прежде всего эти клетки вступают в тесное взаимодействие в специфическом
- •10.6. Общие проявления воспаления
- •10.7. Роль реактивности в воспалении
- •10.8. Виды воспаления
- •10.9. Течение воспаления
10.4.2. Медиаторы воспаления
В ходе первичной и вторичной альтерации высвобождаются большие количества
разнообразных медиаторов и модуляторов воспаления
Медиаторы воспаления по происхождению делятся на гуморальные (образующиеся в
жидких средах - плазме крови и тканевой жидкости) и клеточные. Все гуморальные
медиаторы являются предсуществующими, т.е. имеются в виде предшественников до
активации последних; к ним относятся производные комплемента, кинины и факторы
свертывающей системы крови. Среди клеточных медиаторов выделяют
предсуществующие (депонированные в клетках в неактивном состоянии) - вазоактивные
амины, лизосомальные ферменты, нейропептиды, и вновь образующиеся (т.е.
продуцируемые клетками при стимуляции) - эйкозаноиды, цитокины, лимфокины,
активные метаболиты кислорода.
Основными источниками клеточных медиаторов являются:
1. Нейтрофилы, которые выделяют катионные белки, стимулируют высвобождение
биогенных аминов из тромбоцитов и тучных клеток, содержат ингибитор высвобождения
гистамина и гистаминазу. Протеазы нейтрофилов участвуют в образовании кининов и
активных фрагментов комплемента (С3а, С3Ь). Нейтрофилы образуют простагландин
(PG) E 2 и другие эйкозаноиды. Ферменты нейтрофилов активируют как свертывание
крови, так и фибринолиз.
2. Макрофаги выделяют ангиотензин-конвертазу, которая инактивирует брадикинин,
превращает ангиотензин-I в ангиотензин-П. Они синтезируют PGE 2 , а также тромбоксаны
и лей-
котриены (LT). Поскольку PGE 2 препятствует высвобождению клеточных медиаторов
воспаления и подавляет агрегацию тромбоцитов, макрофаги, помимо провоспалительной,
обладают и противовоспалительной функцией. Макрофаги синтезируют различные
компоненты комплемента, обладают свертывающей и фибринолитической активностью.
3. Эозинофилы служат отрицательными модуляторами воспаления. Они содержат
гистаминазу, кининазу, ферменты, расщепляющие лейкотриены С и D (лизофосфалипазу,
арилсульфатазу В, фосфолипазу D), главный щелочной белок, осуществляющий
цитотоксическую функцию и нейтрализующий гепарин. Таким образом, ферменты
эозинофилов нейтрализуют продукты тучных клеток, способствуют уничтожению
клеточных остатков. Эозинофилы фагоцитируют секретируемые тучными клетками
гранулы и подавляют высвобождение гистамина. Особый интерес представляет
присутствие в эозинофилах лизофосфолипазы. Ее субстратом являются частично
деградированные фосфолипиды, содержащиеся в мембранах погибших клеток.
Высвобождая из фосфолипидов свободные жирные кислоты, лизофосфолипаза
способствует образованию арахидоновой кислоты.
4. Тучные клетки и базофилы выделяют гистамин и серотонин, гепарин, факторы
хемотаксиса нейтрофилов и эозинофилов, фактор активации тромбоцитов,
протеолитические ферменты, они продуцируют пероксидазу, супероксид и пероксид
водорода, а также протеазу, превращающую кининоген в кинин.
5. Тромбоциты секретируют факторы роста и свертывания, вазоактивные амины и
липиды, нейтральные и кислые гидролазы.
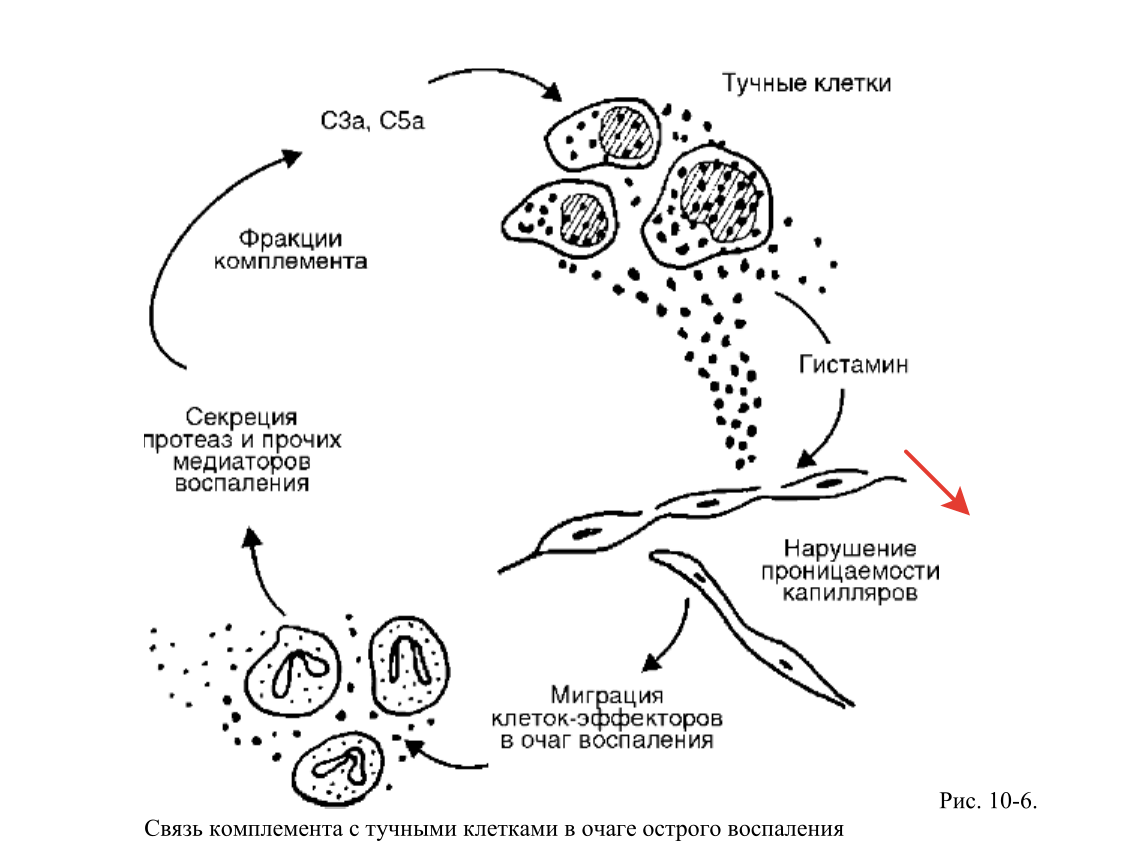
Производные комплемента (рис. 10-5) являются наиболее важными из гуморальных
медиаторов воспаления. Среди почти 20 различных белков, образующихся при активации
комплемента, непосредственное отношение к воспалению имеют его фрагменты С5а, С3а,
С3Ь и комплекс С5Ь-С9:
• С5а и С3а являются медиаторами острого воспаления и анафилатоксинами (т.е.
либераторами гистамина из тучных клеток), таким образом, они повышают
проницаемость капилляров как прямо, так и опосредованно через гистамин (рис. 10-6);
• С5а des Arg и С3а образуются из С5а в плазме и тканевой жидкости под влиянием
карбоксипептидазы N и повышают проницаемость посткапиллярных венул. Эффект С5а
не связан с гистамином, но является нейтрофилзависимым, т.е. осуществляется за счет
факторов проницаемости, высвобождаемых из полиморфно-ядерных гранулоцитов, -
лизосомальных ферментов и неферментных катионных белков, активных метаболитов
кислорода. Кроме того, С5а и С5а des Arg привлекают нейтрофилы. В отличие от них С3а
практически не обладает хемотаксическими свойствами;
• С3Ь опсонизирует патогенный агент и, соответственно, способствует иммунной адгезии
и фагоцитозу;
• комплекс С5Ь-С9 ответствен за лизис микроорганизмов и патологически измененных
клеток.
Источником комплемента служат плазма крови и в меньшей мере тканевая жидкость.
Усиленное поступление плазменного комплемента в ткань является одним из важных
назначений экссудации. Активные компоненты комплемента высвобождают не только
гистамин, но и интерлейкин (IL) 1, простагландины, лейкотриены, фактор, активирующий
тромбоциты, и синергистически взаимодействуют с простагландинами и веществом Р.
Кинины - вазоактивные пептиды, образующиеся из кининогенов (а 2 -глобулинов) под
влиянием калликреинов в плазме (брадикинин) и в тканевой жидкости (каллидин).
Пусковым фактором активации калликреин-кининовой системы является активация при
повреждении ткани фактора Хагемана (XII), превращающего прекалликреины в
калликреины. Фактор XII присутствует в крови и имеет сродство к отрицательно
заряженным поверхностям. В жидкой фазе крови он спонтанно диссоциирует на два
фрагмента: ХПа - ферментативно активный фрагмент и ХПб. ХIIa адсорбируется на
поверхности чужеродного агента (флогогена), где стабилизируется. Он обладает
протеолитической активностью, субстратом которой являются сам фактор ХП и другой
белок - прекаллекреин. Далее прекалликреин под действием ХПа превращается в протеазу
калликреин. Калликреин резко усиливает образование ХНа из фактора ХП и
одновременно действует на новый субстрат - так называемый высокомолекулярный
кининоген (ВМК). Под действием калликреина из ВМК образуется брадикинин,
являющийся одним из главных медиаторов воспаления. Брадикинин действует на
эндотелий сосудов, вызывая «размыкание» краев клеток сосудистого эндотелия и
открывая тем самым путь плазме крови в очаг воспаления. Таким образом, данная система
обнаруживает чужеродное тело по его отрицательно заряженной
поверхности. Поверхности же собственных клеток устроены так, что они не адсорбируют
ХПа, не стабилизируют его и не индуцируют тем самым дальнейшую цепь событий. Это
самый простой и примитивный способ отличать «свое» от «несвоего».
Кинины опосредуют расширение артериол и повышают проницаемость венул путем
контракции эндотелиальных клеток. Они сокращают гладкую мускулатуру вен и
повышают внутрикапиллярное и венозное давление, угнетают эмиграцию нейтрофилов,
модулируют распределение макрофагов, стимулируют миграцию и митогенез Т-
лимфоцитов и секрецию лимфокинов. Кроме того, они усиливают пролиферацию
фибробластов и синтез коллагена и, следовательно, имеют значение в репаративных
явлениях при хроническом воспалении. Одним из важнейших эффектов кининов является
присущая им способность раздражать окончания чувствительных нервов, обусловливая
возникновение воспалительной боли. Кинины усиливают высвобождение гистамина из
тучных клеток, синтез простагландинов многими типами клеток, поэтому некоторые из их
основных эффектов - вазодилатация, сокращение гладкой мускулатуры, боль - связывают
с высвобождением других медиаторов, особенно простагландинов.
Активация фактора Хагемана запускает не только процесс кининообразования, но и
свертывания крови и фибринолиза. При этом образуются такие медиаторы, как
фибринопептиды и продукты деградации фибрина, которые являются мощными
хематтрактантами.
Эйкозаноиды (рис. 10-7) являются важным медиаторным звеном воспалительной
реакции, о чем свидетельствуют их продолжительная продукция в очаге и тесная связь с
ключевым событием воспаления - лейкоцитарной инфильтрацией, а также мощный
противовоспалительный эффект ингибиторов их синтеза. В очаге воспаления основными
продуцентами эйкозаноидов являются моноциты и макрофаги, хотя они образуются почти
всеми типами ядерных клеток при стимуляции последних. Преобладающими
эйкозаноидами в очаге воспаления оказываются простагландины (PGE 2 ), лейкотриены
(LTB4) и 5-гидропероксиэйкозатетраеновая кислота (5-HPETE). Образуются также,
хотя и в меньшем количестве, тромбоксан A 1 (TхA 2 ), PGF 2a , PGD 2 , простациклин (PGI 2 ),
LTC 4 , LTD 4 , LTE 4 , другие HPETE. Главным эффектом эйкозаноидов является их влияние
на лейкоциты; как мощные хематтрактанты они играют важную роль в механизмах
самоподдержания лейкоцитарной инфильтрации.
Простагландины сами не повышают сосудистую проницаемость, но, будучи сильными
вазодилататорами, усиливают гиперемию и, следовательно, экссудацию. Простагландины
и лейкотриены имеют значение в генезе воспалительной боли. При этом PGE 2 , не обладая
прямой болевой активностью, повышает чувствительность рецепторов афферентных
болевых нервных окончаний к брадикинину и гистамину. PGE 2 является сильным
жароповышающим агентом и участвует в развитии лихорадки. Простагландины играют
ключевую роль в модуляции воспалительного процесса, регулируя экссудацию,
эмиграцию и дегрануляцию лейкоцитов, а также фагоцитоз. Так, например, PGE
потенцируют развитие отека, вызванного гистамином или брадикинином, а PGF 1a ,
напротив, ослабляют. Аналогичным образом PGE и PGF 1a действуют на эмиграцию
лейкоцитов.
Лейкотриены (синтезируются во всех клетках крови, кроме эритроцитов, а также в
адвентиции сосудов, тучных клетках, легких) способствуют сокращению гладкой
мускулатуры желудочнокишечного тракта, оказывают сосудосуживающее действие (в том
числе коронарных артерий). LTC 4 , LTD 4 , LTE 4 повышают проницаемость сосудов путем
прямой контракции эндотелиальных клеток, а LTB 4 - как нейтрофилзависимый медиатор.
Лейкотриены при-
водят к спазму гладкой мускулатуры бронхов (эффект бронхоспазма в отличие от
вызванного гистамином развивается медленнее, но является более продолжительным),
развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее
транспорта. Органом-мишенью для лейкотриенов является сердце. Выделяясь в избытке,
они ингибируют (на 60%) сократимость сердечной мышцы, уменьшая коронарный
кровоток и усиливая воспалительную реакцию. Лейкотриены широко взаимодействуют с
другими медиаторами воспаления. Они усиливают бронхоспастическое действие
гистамина, ацетилхолина, простагландинов и тромбоксанов, стимулируют высвобождение
простагландинов и тромбоксанов.
Тромбоксаны (образуются в ткани мозга, селезенки, легких и в тромбоцитах, клетках
воспалительной гранулемы) вызывают адгезию и агрегацию тромбоцитов, способствуют
развитию тромбоза при ишемической болезни сердца, оказывают вазоспастическое
действие.
Модуляторная функция эйкозаноидов осуществляется через изменения соотношения
циклических нуклеотидов в клетках.
Биогенные амины - гистамин и серотонин считаются основными медиаторами
первоначальных микроциркуляторных нарушений в очаге острого воспаления и
немедленной фазы повышения проницаемости сосудов.
Незначительное количество нейромедиатора серотонина содержится в тучных и
энтерохромаффинных клетках, но главным его источником являются тромбоциты.
Эффекты серотонина неоднозначны и меняются в зависимости от количества. В обычных
физиологических условиях серотонин является вазоконстриктором, вызывает
пролонгированный спазм сосудов, повышает их тонус. При воспалении количество
серотонина резко возрастает. В высоких концентрациях серотонин является
вазодилататором, расширяет сосуды, повышает проницаемость, причем в 100 раз более
эффективно по сравнению с гистамином. Серотонин способен вызывать
непосредственную контракцию эндотелиальных клеток венул и является также
медиатором боли. Кроме того, серотонин стимулирует моноциты в очаге воспаления.
Гистамин действует двояко в отношении сосудов и клеток. Через Н 1 -рецепторы он
расширяет артериолы и угнетает эмиграцию и дегрануляцию лейкоцитов, а через H 1 -
рецепторы суживает венулы, повышая таким образом внутрикапиллярное давление, и сти-
мулирует эмиграцию и дегрануляцию лейкоцитов. При обычном течении воспаления
гистамин действует преимущественно через Н 1 -рецепторы на нейтрофилах, ограничивая
их функциональную активность, и через Н 1 -рецепторы на моноцитах, стимулируя их.
Таким образом, наряду с провоспалительными сосудистыми эффектами он оказывает
противовоспалительное действие. Обладая способностью к регуляции пролиферации,
дифференцировки и функциональной активности фибробластов, гистамин участвует в
процессах репарации. Модуляторные эффекты гистамина также опосредуются
циклическими нуклеотидами.
Что касается взаимодействий биогенных аминов в очаге воспаления, то известно, что
гистамин через H 1 -рецепторы может запускать или усиливать синтез простагландинов, а
через Н 2 -рецепторы - угнетать. Взаимодействуя как между собой, так и с брадикинином,
нуклеотидами и нуклеозидами, веществом Р, биогенные амины повышают проницаемость
сосудов. Сосудорасширяющее действие гистамина усиливается в комплексе с
ацетилхолином, серотонином, брадикинином.
Лизосомальные ферменты высвобождаются в очаге воспаления из гранулоцитов и
моноцитов-макрофагов в ходе их хемотаксической стимуляции, миграции, фагоцитоза,
повреждения, гибели. В гранулах нейтрофилов содержатся протеиназы - эластаза,
катепсин G и коллагеназы, которые обеспечивают противомикробную защиту, лизируя
убитые микроорганизмы. Они обладают медиаторным и модуляторным эффектами в
отношении сосудистой проницаемости, эмиграции, фагоцитоза.
Повышение проницаемости сосудов под влиянием лизосомальных ферментов происходит
за счет лизиса субэндотелиального матрикса, истончения и фрагментации эндотелиальных
клеток и сопровождается геморрагией и тромбозом. Образуя или расщепляя важнейшие
хемотаксины, лизосомальные ферменты модулируют лейкоцитарную инфильтрацию. В
зависимости от концентрации они могут и сами усиливать или угнетать миграцию
нейтрофилов. Нейтральные протеиназы способны модулировать фагоцитоз. Например,
эластаза образует опсонин С3Ь, необходимый для адгезии частиц к поверхности
нейтрофила. Следовательно, нейтрофил сам обеспечивает себе механизм усиления
фагоцитоза. Как катепсин G, так и эластаза повышают сродство Fc-рецептора мембраны
нейтрофила к комплексам иммуноглобулинов и, соответственно, усиливают
эффективность поглощения частиц.
Благодаря способности лизосомальных ферментов активировать системы комплемента,
калликреин-кининовую, свертывания и фибринолиза, высвобождать цитокины и
лимфокины, воспаление развертывается и самоподдерживается в течение длительного
времени.
Неферментные кат ионные белки, содержащиеся в азурофильных и в специфических
гранулах нейтрофилов, обладают таким важным свойством, как высокая
микробицидность. В этом отношении они находятся в синергистическом взаимодействии
с системой миелопероксидаза - перекись водорода. Катионные белки сорбируются на
отрицательно заряженной мембране бактериальной клетки путем электростатического
взаимодействия, нарушая проницаемость и структуру ее оболочки. Затем наступает
гибель микроорганизма с последующим эффективным лизисом его лизосомальными
протеиназами. Кроме того, высвободившиеся катионные белки опосредуют повышение
проницаемости сосудов (способствуя дегрануляции тучных клеток и высвобождению
гистамина), а также адгезию и эмиграцию лейкоцитов.
Цитокины при воспалении продуцируются главным образом стимулированными
моноцитами и макрофагами (монокины), а также нейтрофилами, лимфоцитами,
эндотелиальными и другими клетками. Цитокины повышают сосудистую проницаемость
(нейтрофилзависимым путем), адгезию и эмиграцию лейкоцитов. Наряду с
провоспалительными свойствами цитокины важны и для непосредственной защиты
организма, поскольку стимулируют нейтрофилы и моноциты к умерщвлению,
поглощению и перевариванию внедрившихся микроорганизмов, а также усиливают
фагоцитоз путем опсонизации патогенного агента. Стимулируя раневое очищение,
пролиферацию и дифференцировку клеток, цитокины усиливают репаративные процессы.
Наряду с этим они могут опосредовать тканевую деструкцию (деградацию хрящевого
матрикса и резорбцию кости) и, таким образом, играть роль в патогенезе заболеваний
соединительной ткани, в частности ревматоидного артрита. Действие цитокинов вызывает
также ряд метаболических эффектов, лежащих в основе общих проявлений воспаления -
лихорадки, сонливости, анорексии, изменения обмена веществ, стимуляции гепатоцитов к
усиленному синтезу белков острой фазы, активации системы крови и т.д. Цитокины
взаимодействуют между собой, с простагландинами, нейропептидами и другими
медиаторами.
К медиаторам воспаления (цитокинам) относится также ряд лимфокинов - полипептидов,
продуцируемых стимулированными лимфоцитами. Лимфокины координируют
взаимодействие нейтрофилов, макрофагов и лимфоцитов, регулируя воспалительную
реакцию в целом.
Активные метаболиты кислорода, прежде всего свободные радикалы - супероксидный
анион-радикал (О* - ) , гидроксильный радикал (НО*), гидроперекисный радикал (НО*,),
вследствие наличия на их внешней орбите одного или нескольких непарных электронов
обладают повышенной реактивностью с другими молекулами и, следовательно,
значительным деструктивным потенциалом, который имеет значение в патогенезе
воспаления (рис. 10-8).
Источником активных форм кислорода - кислородных радикалов, перекиси водорода
(Н 1 О 1 ), синглетного кислорода ( 1 О 1 ), гипохлорита (HOCl) и др. - служат: респираторный
взрыв фагоцитов при их стимуляции, каскад арахидоновой кислоты в процессе
образования эйкозаноидов, ферментные процессы в эндоплазматическом ретикулуме и
пероксисомах, митохондриях, цитозоле, а также самоокисление малых молекул, таких как
гидрохиноны, лейкофлавины, катехоламины и др.
Радикалы кислорода повышают бактерицидную способность фагоцитов, а также имеют
медиаторную и модуляторную функ-ции. Будучи медиаторами воспаления, активные метаболиты кислорода вызывают
перекисное окисление липидов, повреждение белков, углеводов, нуклеиновых кислот, что
повышает проницаемость сосудов (вследствие повреждения эндотелиальных клеток) и
способствует стимуляции фагоцитов. Как модуляторы, они могут усиливать
воспалительные явления (высвобождая ферменты и взаимодействуя с ними при
повреждении ткани) или оказывать противовоспалительный эффект (инактивация
лизосомальных гидролаз и других медиаторов воспаления). Большое значение имеют
активные метаболиты кислорода в поддержании хронического воспаления.
К медиаторам и модуляторам воспаления относят также нейропептиды - вещества,
высвобождаемые С-волокнами в результате активации воспалительным агентом
полимодальных ноцицепторов, играющих важную роль в возникновении аксон-рефлексов
в конечных разветвлениях первичных афферентных (чувствительных) нейронов. Наиболее
изученными являются вещество Р, кальцитонин-генсвязанный пептид, нейрокинин А.
Нейропептиды повышают проницаемость сосудов, и эта их способность во многом
опосредована медиаторами, происходящими из тучных клеток. Между немиелиновыми
нервами и тучными клетками имеются мембранные контакты, которые обеспечивают
сообщение центральной нервной системы с очагом воспаления. Нейропептиды
синергистически взаимодействуют в повышении проницаемости сосудов как между
собой, так и с гистамином, брадикинином, С5а, фактором, активирующим тромбоциты,
лейкотриеном В 4 ; антагонистически - с АТФ и аденозином. Они оказывают также
потенцирующее воздействие на привлечение и цитотоксическую функцию нейтрофилов,
усиливают адгезию нейтрофилов к эндотелию венул. Кроме того, нейропептиды
повышают чувствительность ноцицепторов к действию различных медиаторов, в
частности простагландина E 1 и простациклина, участвуя таким образом в формировании
боли при воспалении.
Кроме вышеперечисленных веществ, к медиаторам воспаления относятся также
ацетилхолин и катехоламины, высвобождающиеся при возбуждении холин- и
адренергических структур. Ацетилхолин вызывает расширение сосудов и играет роль в
аксон-рефлекторном механизме артериальной гиперемии при воспалении. Норадреналин
и адреналин тормозят рост сосудистой проницаемости, выступая главным образом как
модуляторы воспаления.
10.4.3. Расстройства кровообращения и микроциркуляции в воспаленной ткани
Расстройства микроциркуляции. Сосудистые явления развиваются вслед за
воздействием воспалительного агента, поскольку первоначальные из них являются по
своей природе рефлекторными. Они хорошо прослеживаются под микроскопом в
классическом опыте Ю. Конгейма на брыжейке лягушки и включают ряд стадий:
1. Кратковременный спазм артериол, сопровождающийся побледнением ткани.
Является результатом рефлекторного возбуждения вазоконстрикторов от воздействия
воспалительного агента. Длится от нескольких десятков секунд до нескольких минут, так
что его не всегда удается отметить.
2. Артериальная гиперемия, обусловленная расширением артериол, механизм которой, с
одной стороны, связан аксонрефлекторным возбуждением вазодилататоров, а с другой - с
непосредственными сосудорасширяющими эффектами медиаторов воспаления:
нейропептидов, ацетилхолина, гистамина, брадикинина, простагландинов и др.
Артериальная гиперемия лежит в основе двух основных внешних местных признаков
воспаления - покраснения и повышения температуры ткани. Кроме того, в воссоздании
жара имеет значение повышенная теплопродукция в очаге из-за усиленного обмена
веществ.
3. Венозная гиперемия. Она может развиться уже через несколько минут после
воздействия флогогена и характеризуется значительной продолжительностью -
сопровождает весь ход воспалительного процесса. Одновременно, поскольку при ее
участии осуществляются основные воспалительные явления, она считается истинной
воспалительной гиперемией.
В механизме венозной гиперемии различают 3 группы факторов: а) нарушения
реологических свойств крови и ее циркуляции. Сюда относятся повышение вязкости
крови вследствие ее сгущения, обусловленного экссудацией, потери альбуминов,
увеличения содержания глобулинов, изменения коллоидного состояния белков; усиление
сопротивления кровотоку в результате краевого стояния лейкоцитов, набухания и
агрегации эритроцитов; тромбообразование вследствие активации свертывающей системы
крови; нарушение характера кровотока - замедление тока крови в осевой зоне,
уменьшение краевой плазматической зоны;
б) изменения сосудистой стенки, которые включают потерю сосудистого тонуса
вследствие паралича нервно-мышечного аппарата сосудов; снижение эластичности
сосудистой стенки; набухание эндотелия и повышение его адгезивности, в результате чего
просвет сосудов сужается, создаются условия для прилипания лейкоцитов к эндотелию;
в) тканевые изменения, состоящие в сдавлении венул и лимфатических сосудов отечной,
инфильтрированной тканью; снижении упругости соединительной ткани. Многие из
перечисленных факторов являются и причинами, и одновременно следствиями
развивающейся венозной гиперемии.
Воспалительная гиперемия отличается от других видов гиперемии (вызываемой,
например, механическим фактором) значительным ослаблением или даже извращением
реакции сосудов воспаленной ткани на действие сосудосуживающих агентов (адреналин,
кофеин) и на раздражение симпатических нервов. Это явление может быть связано с
«десенсибилизацией» сосудов, т.е. сниженной или качественно измененной их
чувствительностью к действию вазоконстрикторных стимулов, что обусловлено блокадой
рецепторов. Другие отличия воспалительной гиперемии связаны с более выраженным
кровенаполнением воспаленного участка органа или ткани, расширением и увеличением
количества функционирующих капилляров, интенсивностью микроциркуляции,
отставанием линейной скорости кровотока и др., что позволяет рассматривать
воспалительную гиперемию как специальный вид нарушений микроциркуляции.
4. Стаз. Он может развиться в некоторых разветвлениях сосудов воспаленной ткани.
Распространенный стаз характерен для острого, быстро развивающегося, например
гиперергического, воспаления. Как правило, нарушение кровотока при воспалительном
стазе является преходящим, однако при возникновении повреждений сосудистой стенки и
тромбов во многих микрососудах стаз становится необратимым.
10.4.4. Экссудация и экссудаты
Расстройства микроциркуляции при воспалении сопровождаются явлениями экссудации и
эмиграции.
Экссудация (exsudatio, от лат. exsudare - потеть) - выпотевание белоксодержащей
жидкой части крови через сосудистую стенку
в воспаленную ткань. Соответственно жидкость, выходящая при воспалении из сосудов
в ткань, называется экссудатом. Термины «экссудат» и «экссудация» употребляются
только по отношению к воспалению. Они призваны подчеркнуть отличие воспалительной
жидкости (и механизма ее образования) от межклеточной жидкости и транссудата -
невоспалительного выпота, выходящего при других, невоспалительных, отеках. Если
транссудат содержит до 2% белка, то экссудат - более 3 (до 8%).
Механизм экссудации включает 3 основных фактора:
1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия
медиаторов воспаления и в ряде случаев самого воспалительного агента;
2) увеличение кровяного (фильтрационного) давления в сосудах очага воспаления
вследствие гиперемии;
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате
альтерации и начавшейся экссудации и, возможно, снижение онкотического давления
крови из-за потери белков при обильной экссудации (рис. 10-9, 10-10).
Ведущим фактором экссудации является повышение проницаемости сосудов, которое,
как правило, имеет две фазы - немедленную и замедленную.
Немедленная фаза возникает вслед за действием воспалительного агента, достигает
максимума на протяжении нескольких минут и завершается в среднем в течение 15-30
мин, когда проницаемость может возвращаться к норме (в том случае, если сам флогоген
не оказывает прямого повреждающего влияния на сосуды). Преходящее повышение
проницаемости сосудов в немедленной фазе обусловлено главным образом
контрактильными явлениями со стороны эндотелия венул. В результате взаимодействия
медиаторов со специфическими рецепторами на мембранах эндотелиальных клеток
происходит сокращение актиновых и миозиновых микрофиламентов цитоплазмы клеток,
и эндотелиоциты округляются; две соседние клетки отодвигаются друг от друга, и между
ними появляется межэндотелиальная щель, через которую и осуществляется экссудация.
Замедленная фаза развивается постепенно, достигает максимума через 4-6 ч и длится
иногда до 100 ч в зависимости от вида и интенсивности воспаления. Следовательно,
экссудативная фаза воспаления начинается немедленно после воздействия флогогена и
продолжается более 4 суток.
Стойкое увеличение проницаемости сосудов в замедленной фазе связано с повреждением
сосудистой стенки венул и капилляров лейкоцитарными факторами - лизосомальными
ферментами и активными метаболитами кислорода.
По отношению к сосудистой проницаемости медиаторы воспаления делятся на:
1) прямодействующие, влияющие непосредственно на эндотелиальные клетки и
вызывающие их контракцию, - гистамин, серотонин, брадикинин, С5а, С3а, LTC 4 и LTD 4 ;
2) нейтрофилзависимые, эффект которых опосредуется лейкоцитарными факторами.
Такие медиаторы не способны повышать проницаемость сосудов у лейкопенических
животных. Это компонент комплемента С5а des Arg, LTB 4 , интерлейкины, в частности IL-
1, отчасти фактор, активирующий тромбоциты.
Выход жидкой части крови из сосуда и задержка ее в ткани объясняется: повышенной
проницаемостью сосудов, увеличенным фильтрационным давлением крови, осмотическим
и онкотическим давлением ткани, фильтрацией и диффузией через микропоры в самих
эндотелиальных клетках (трансцеллюлярные каналы) пассивным путем; активным путем -
с помощью так называемого микровезикулярного транспорта, который заключается в
микропиноцитозе эндотелиальными клетками плазмы крови, ее транспорте в виде
микропузырьков (микровезикул) по направлению к базальной мембране и последующем
выбросе (экструзии) в ткань.
При воспалении проницаемость сосудов повышена в большей степени, чем при любом из
невоспалительных отеков, в связи с чем количество белка в экссудате превышает таковое
в транссудате. Подобное отличие обусловлено разницей в количествах и наборе
высвобождаемых биологически активных веществ. Например, лейкоцитарные факторы,
повреждающие сосудистую стенку, играют важную роль в патогенезе экссудации и менее
значимую - при невоспалительных отеках.
Степенью повышения проницаемости сосудов определяется и белковый состав экссудата.
При сравнительно небольшом увеличении проницаемости могут выйти только
мелкодисперсные альбумины, по мере дальнейшего повышения - глобулины и, наконец,
фибриноген.
В зависимости от качественного состава различают следующие виды экссудатов:
серозный, фибринозный, гнойный, гнилостный, геморрагический, смешанные (рис.
10-11, см. цв. вклейку).
Серозный экссудат характеризуется умеренным содержанием белка (3-5%), в основном
мелкодисперсного (альбумин), и небольшим количеством полиморфно-ядерных
лейкоцитов, вследствие чего имеет невысокую удельную плотность (1015-1020) и
является
достаточно прозрачным. По составу наиболее близок к транссудату. Характерен для
воспаления серозных оболочек (серозный перитонит, плеврит, перикардит, артрит и др.),
реже встречается при воспалении в паренхиматозных органах. Экссудат при серозном
воспалении слизистых оболочек характеризуется большой примесью слизи. Такое
воспаление называется катаральным (от греч. katarrheo - стекаться, течь вниз;
катаральный ринит, гастрит, энтероколит и др.). Чаще всего серозный экссудат
наблюдается при ожоговом, вирусном, аллергическом воспалении.
Фибринозный экссудат отличается высоким содержанием фибриногена, что является
результатом значительного повышения проницаемости сосудов. При контакте с
поврежденными тканями фибриноген превращается в фибрин и выпадает в виде
ворсинчатых масс (на серозных оболочках) или пленки (на слизистых), вследствие чего
экссудат уплотняется. Если фибринозная пленка расположена рыхло, поверхностно, легко
отделяется без нарушения целостности слизистой, такое воспаление называется
крупозным. Оно наблюдается в желудке, кишечнике, трахее, бронхах. В том случае, когда
пленка плотно спаяна с подлежащей тканью и ее удаление обнажает язвенную
поверхность, речь идет о дифтеритическом воспалении. Оно характерно для миндалин,
полости рта, пищевода. Такое различие обусловлено характером эпителия слизистой
оболочки и глубиной повреждения. Фибринозные пленки могут самопроизвольно
отторгаться благодаря аутолизу, развертывающемуся вокруг очага, и демаркационному
воспалению и выходить наружу; подвергаться ферментативному расплавлению или
организации, т.е. прорастанию соединительной тканью с образованием
соединительнотканных сращений, или спаек. Фибринозный экссудат может
формироваться при дифтерии, дизентерии, туберкулезе.
Гнойный экссудат характеризуется наличием большого количества полиморфно-ядерных
лейкоцитов, главным образом погибших и разрушенных (гнойные тельца), ферментов,
продуктов аутолиза тканей, альбуминов, глобулинов, иногда нитей фибрина, особенно
нуклеиновых кислот, обусловливающих высокую вязкость гноя. Вследствие этого
гнойный экссудат является достаточно мутным, с зеленоватым оттенком. Он характерен
для воспалительных процессов, вызванных кокковой инфекцией, патогенными грибками
или химическими флогогенами, такими как скипидар, отравляющие вещества.
Гнилостный (ихорозный) экссудат отличается наличием продуктов гнилостного
разложения тканей, вследствие чего имеет грязнозеленую окраску и дурной запах.
Образуется в случае присоединения патогенных анаэробов.
Геморрагический экссудат характеризуется большим содержанием эритроцитов, что
придает ему розовый или красный цвет. Характерен для туберкулезных поражений
(туберкулезный плеврит), чумы, сибирской язвы, черной оспы, токсического гриппа,
аллергического воспаления, т.е. для воздействия высоковирулентных агентов, бурно
протекающего воспаления, сопровождающегося значительным повышением
проницаемости и даже разрушением сосудов. Геморрагический характер может принять
любой вид воспаления - серозный, фибринозный, гнойный.
Смешанные экссудаты наблюдаются при воспалении, протекающем на фоне
ослабленных защитных сил организма и присоединения вследствие этого вторичной
инфекции. Различают серозно-фибринозный, серозно-гнойный, серозно-геморрагический,
гнойно-фибринозный экссудаты.
Биологическое значение экссудации двояко. Она выполняет важную защитную роль:
обеспечивает поставку в ткань плазменных медиаторов - активных компонентов
комплемента, кининов, факторов свертывающей системы, ферментов плазмы,
биологически активных веществ, высвобождаемых активированными клетками крови.
Совместно с тканевыми медиаторами они участвуют в умерщвлении и лизисе
микроорганизмов, привлечении лейкоцитов крови, опсонизации патогенного агента,
стимуляции фагоцитоза, раневом очищении, репаративных явлениях. С экссудатом из
тока крови в очаг выходят продукты обмена, токсины, т.е. очаг воспаления выполняет
дренажную элиминативную функцию. С другой стороны, вследствие свертывания лимфы
в очаге, выпадения фибрина, усугубления венозного застоя и тромбирования венозных и
лимфатических сосудов экссудат участвует в задержке в очаге микробов, токсинов,
продуктов обмена.
Будучи компонентом патологического процесса, экссудация может приводить к
осложнениям - поступлению экссудата в полости тела с развитием плеврита, перикардита,
перитонита; сдавлению близлежащих органов; гноеобразованию с развитием абсцесса,
эмпиемы, флегмоны, пиемии. Образование спаек может вызвать смещение и нарушение
функций органов. Большое значение имеет локализация воспалительного процесса. Так,
например,
образование на слизистой оболочке гортани при дифтерии фибринозного экссудата может
привести к асфиксии.
Скопление в ткани экссудата обусловливает такой внешний местный признак воспаления,
как припухлость. Кроме того, наряду с действием брадикинина, гистамина,
простагландинов, нейропептидов давление экссудата на окончания чувствительных
нервов имеет некоторое значение в возникновении воспалительной боли.
