
877
.pdf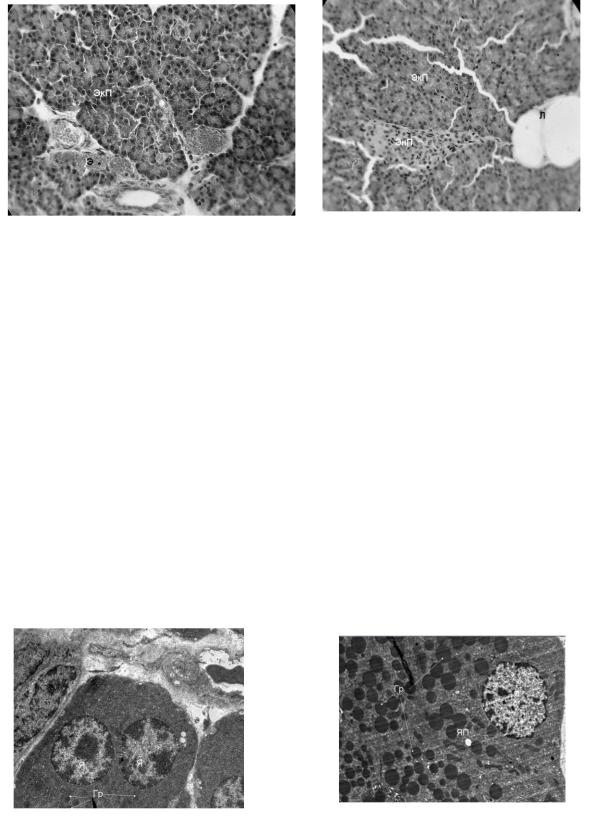
Риск 1. 1 сутки развития экспериментального ОДП. Ярко выраженные явления гиперимии и кровоязлияния. ЭкП – экзокринная паренхима. Э – эритроциты
Рис. 2. 7 сутки развития экспериментального ОДП. Ярко выраженные явления отека ЭП - экзокринной паренхимы с явлениями липоматоза. (Л) ЭнП – эндокринная паренхима
Также были обнаружены клетки В-типа. Эти клетки чаще наблюдались в перикапиллярной зоне. Эти клетки имеют округлое более темное и мелкое ядро, нежели у А-клеток. Секреторные гранулы равномерно распределены по цитоплазме, по сравнению с гранулами А-клетками более мелкие, имеют светлый поясок.
На световом уровнена третьи сутки отмечается картина очагового некроза паренхимы. Основные неакротические изменения отмечаются в ядрах ациноцитов с явлением вакуолизации ядер, в разных участках обнаруживались мелкие капли жира в виде скоплений, отмечалась очаговая гиперемия. Наблюдался процесс разрастания междольковых септ соединительной ткани с наличием фибробластов и моноцитов. При исследовании на электронном уровне отмечается картина очагового некроза паренхимы, сладжирования и стаза эритроцитов, массивные кровоизлияния и резкий отек. Также были обнаружены РР-клетки (Рис. 3). Ядра клеток овальной формы с неровными контурами ядерной оболочки. Клетки полигональной формы, не крупные секреторные гранулы, заполняющие цитоплазму, представлены мелкозернистым материалом.
Рисунок 3. 3 сутки развития эксперимен- |
Рисунок 4. 7 сутки развития экспе- |
|
риментального ОДП. Ярко выражен- |
||
тального ОДП. Ядро (Я) А клетки набух- |
||
ные явления репарации – появления |
||
шее, ядерные поры (ЯП) расширены. |
||
двуядерных В-клеток. Я-ядро. Гр- |
||
Крупные Гр-гранулы инкрета |
||
гранулы инкрета. |
||
|
||
191 |
|

Э
ГЭ
К седьмым суткам при световой микроскопии ярко выражена картина
Гр очагового некроза паренхимы с деструктивными изменениями в ядрах, отеком
стромы и сдавлением сосудов. Обнаруживались мелкие капли жира в виде скоплений, либо группами по несколько клеток (Рис. 2). Клетки А-типа реагируют позднее В-клеток, в силу своей защищенности более плотной мембраной и более тесного контакта В-клеток с капиллярами. В В-клетках на электронном уровне начинались репаративные процессы, о чем говорило значительное увеличение площади клеток и ядра, обилие митохондрий в клетках. Наблюдались двуядерные В-клетки. (Рис. 4) О возрастании функциональной активности можно судить о появлении ацино-инсулярных клеток. Также были обнаружены Д-клетки. Ядро овальной формы с равномерно распределенным хромантином, клетки выглядели просветленными по сравнению с другими клетками, это связано с более низкой электронной плотностью, секреторные гранулы располагаются плотно и более мелкие.
К четырнадцатым суткам при исследовании была ярко выражена картина липоматоза с васкуляризацией. Происходило постепенное замещение клеток поджелудочной железы, жировыми. В экзокринной части сохранялась зернистая белковая дистрофия. Эндокринная часть в состоянии отека. Строма органа отечная, более бледно окрашена. В интерстиции обнаруживалось скопление лимфоцитов и нейтрофилов. Отмечалась гиперемия с кровоизлияниеми эритроцитов в периваскулярное пространство. Обнаруживались единичные очаги липодистрофии.
Выводы. Нашими исследованиями определены в поджелудочной железе крыс при 4 цитотипа клеток: А-,В-,РР-,Д- клетки; описана их цитоархитектоника. Наиболее выраженные структурные изменения выявлены на 3 сутки ОДП в клетках В-типа, которые выражаются в изменении архитектоники ядра, вакуализации гиалоплазмы, нарушении матрикса митохондрий, фрагментации ЭПС. При этом репаративные процессы в них начинаются уже к 3 суткам, в отличии от клеток А- типа, в которых вырвженные процессы восттановления структуры клетки начинается с 7 суток, что связано с удаленными топографическими взаимоотношениями А-клеток с сосудистым руслом ПО. Обнаруженные ацино-инсулярные клетки на 7 сутки ОДП свидетельствуют о регенераторных возможностях паренхимы органа в ответ на действие стрессорного фактора.
Литература
1.Авцын А. П. Ультраструктурные основы патологии клетки. / А. П. Авцын, В. А. Шахламов – М., 1979. – 316 с.
2.Бархина Т.Г., Молдавская А.А., Савищев А.В., Донской. М В. Ультраструктура поджелудочной железы крыс линии «wistar albicans»//Морфологические ведомости.- 2008.-№ 3-4.– с.7-9
3.Пузырѐв А.А., Иванова В.Ф., Костюкевич С.В. Ультраструктура экзокринных клеток поджелудочной железы собаки»//Морфология.-2006.-№ 3-4.-с.68-71
192
УДК 576.385.7
В.В. Нифонтова – студентка; Е.О. Чугунова – научный руководитель, канд. ветеринар. наук, доцент.
ФГБОУ ВПО Пермская ГСХА, г. Пермь, Россия
ВОЗДЕЙСТВИЕ КИСЛОТ И ЩЕЛОЧЕЙ НА КЛЕТКУ
Аннотация. Клетка представляет собой элементарную целостную единицу строения и жизнедеятельности всех организмов. Все многочисленные функции клетки и происходящие в них биохимические превращения связаны с определенными структурами – органеллами, выполняющими специфические функции. Растворы кислот и щелочей с концентрацией 0,1 моль/л и 10% вызывают стопроцентную гибель клеток. Кислота с концентрацией 0,02 моль/л оказалась менее патогенной (25,6% выживших) по сравнению со щѐлочью такой же концентрации (14,3% выживших). Даже слабые растворы щелочей (0,02 моль/л) разрушают эндоплазматическую мембрану клетки.
Ключевые слова: растворы кислот и щелочей, концентрация, процент выживших инфузорий, гибель клеток, патологический эффект.
Клетка представляет собой элементарную целостную единицу строения и жизнедеятельности всех организмов, обладающая собственным обменом веществ, способная к самостоятельному существованию, самовоспроизведению и развитию. Все известные науке организмы имеют клеточное строение. Неклеточных организмов, ведущих свободный образ жизни, не существует, за исключением вирусов. Все живые организмы либо состоят из множества клеток (многоклеточные животные, растения и грибы), либо являются одноклеточными организмами (многие простейшие и бактерии).
Все многочисленные функции клетки и происходящие в них биохимические превращения связаны с определенными структурами – органеллами, выполняющими специфические функции.
Каждая клетка состоит из важнейших, неразрывно связанных между собой частей – цитоплазматической мембраны (ЦПМ), цитоплазмы с включениями и ядра [3, 4].
Действие факторов внешней среды опосредуется ЦПМ клетки, которая выполняет ряд функций: рецепторная, барьерная, контактная, транспортная и ферментативная. В клеточной мембране имеются мельчайшие поры, через которые внутрь клетки могут проникать различные патогены, нарушая ее жизнеспособность. Поэтому вопрос о воздействии патологических факторов имеет ценное практическое и теоретическое значение [1, 2].
Цель исследования – изучение патологического действия кислот и щелочей на клетку.
Задачи исследования:
1.сформировать контрольную и опытные группы парамеций;
2.определить количество живых парамеций в каждой группе;
3.изучить патологический эффект гидроокиси натрия различных концентраций на парамеций;
193
4.изучить патологический эффект серной кислоты различных концентраций на парамеций;
5.установить процент выживших простейших в ходе эксперимента;
6.сравнить степень патогенного действия кислот и щелочей на клетку. Объект исследования: лабораторные инфузории – парамеции.
Материал исследования: растворы гидроокиси натрия: 0,02 моль/л, 0,1
моль/л и 10 %; растворы серной кислоты: 0,02 моль/л, 0,1 моль/л и 10 %.
Метод исследования: микроскопический. Результаты исследований.
На организм животного постоянно воздействуют условно-патогенные и патогенные микроорганизмы. В ветеринарной практике широко используются дезинфицирующие вещества, в состав которых входят кислоты или щѐлочи. Цель дезинфектантов – гибель клеток патогенных микроорганизмов, но необходимо помнить, что действующие вещества дезинфицирующих средств также оказывают свое действие и на клетки организма животного.
Нами были сформированы 7 групп инфузорий: 6 опытных и 1 контрольная. В первой серии опытов на простейших воздействовали гидроксидом
натрия различных концентраций (табл. 1).
|
|
|
Таблица 1 |
Патогенное действие гидроокиси натрия на клетку |
|||
Количество инфузорий |
NaOH 0,02моль/л |
NaOH 0,1 моль/л |
NaOH 10% |
До |
14 |
14 |
5 |
После |
2 |
0 |
0 |
Процент выживших клеток |
14,3% |
0% |
0% |
Как следует из таблицы 1 в первом опыте к испытуемой группе из 14 инфузорий приливали NaOH 0,02 моль/л. Выжило только 2 инфузории. Процент выживших составил 14,3%. Во втором опыте к 14 парамециям добавляли NaOH 0,1 моль/л. В третьем опыте испытуемая группа составила 5 инфузорий. К этой группе добавляли 10%-й гидроксид натрия. Выживаемость в обоих опытах составила 0%, т.к. произошло разрушение эндоплазматической мембраны и выход наружу органоидов и ядра парамеций.
Во второй серии опытов на простейших воздействовали серной кислотой различной концентрации. В первом опыте к 43 простейшим добавили серную кислоту с концентрацией 0,02 моль/л. Выжило 11 инфузорий. Процент выживших составил 25,6%. Во втором опыте к группе из 31 парамеции добавили серную кислоту 0,1 моль/л. В третьем опыте к группе из 16 парамеций прилили 10%-ю серную кислоту. Выживаемость в обоих опытах составила 0% (табл. 2).
|
|
|
Таблица 2. |
Патогенное действие серной кислоты на клетку |
|
||
Количество инфузорий |
H2SO4 0,02моль/л |
H2SO4 0,1 моль/л |
H2SO4 10% |
До |
43 |
31 |
16 |
После |
11 |
0 |
0 |
Процент выживших клеток |
25,6% |
0% |
0% |
В контроле к испытуемой группе из 24 парамеций приливали дистиллированную воду. Выживаемость, ожидаемо, составила 100%.
194
Выводы:
1) растворы кислот и щелочей с концентрацией 0,1 моль/л и 10% вызывают стопроцентную гибель клеток;
2) кислота с концентрацией 0,02 моль/л оказалась менее патогенной (25,6% выживших) по сравнению со щѐлочью такой же концентрации (14,3% выживших);
3) даже слабые растворы щелочей (0,02 моль/л) разрушают эндоплазматическую мембрану клетки.
Литература
1.Лютинский, С.И. Патологическая физиология животных. – 2-е изд., испр. и доп. – М.: КолосС, 2005. – 496 с.: ил. – (Учебники и учебные пособия для студентов высш. учеб. заведений).
2.Лютинский, С.И., Степин, В.С. Практикум по патологической физиологии сельскохозяйственных животных. – М.: Колос, 2001. – 224 с.: ил. – (Учебники и учебные пособия для студентов высш. учеб. заведений).
3.Мамонтов, С.Г. Биология. Для поступающих в вузы: Учеб. Пособие. – М.:
Дрофа, 1994. – 480 с.
4.Википедия [электронный ресурс].
УДК 619:616.995.132.2
В.В. Пирогов – аспирант; Г.М. Топурия – научный руководитель, профессор.
ФГБОУ ВПО Оренбургский ГАУ, г. Оренбург, Россия
ПОКАЗАТЕЛИ КРОВИ КРУПНОГО РОГАТОГО СКОТА ПОД ДЕЙСТВИЕМ РАСТИТЕЛЬНОЙ КОРМОВОЙ ДОБАВКИ
Аннотация. Изучено влияние растительной кормовой добавки гермивита на показатели крови бычков на откорме. Установлено положительное действие препарата на морфологический состав крови молодняка крупного рогатого скота.
Ключевые слова: гермивит, бычки, кровь.
Повышение полноценности питания населения страны зависит от развития отрасли животноводства, от роста производства продуктов животноводства.
Для удовлетворения потребности населения в мясе и продуктах его переработки во всех районах, регионах страны (за небольшим исключением) всемерно должно развиваться производство говядины. Это отвечает как требованиям организации полноценного питания людей, так и наиболее рациональному использованию кормовых ресурсов, а также экономическим, природно-климатическим и национальным особенностям отдельных зон и регионов страны.
По расчетам говядина в общем объеме производства мяса должна составлять не менее 40-45%.
Повышение продуктивности сельскохозяйственных животных и птиц возможно при всестророннем изучении функциональных и иммунобиохимических процессов в организме. Для интенсификации обменных процессов в последние годы в животноводстве используются ферментные, антисрессовые препараты, минеральные вещества, витамины, пробиотики, иммуностимуляторы [1-4, 9-15].
Цель наших исследований – изучить влияние гермивита на показатели крови бычков.
195
Гермивит – препарат, полученный из зародышей пшеницы, в его состав входят витамины, аминокислоты, макро- и микроэлементы.
Гермивит с успехом используется в различных ораслях животноводства [5-8]. Для проведения опытов было сформировано четыре группы бычков на откорме. Молодняк крупного рогатого скота контрольной группы получал общехозяйственный рацион. Животным первой опытной группы дополнительно скармливали гермивит вместе с концентрированным кормом в дозе 0,5 г/кг, второй – 0,7 г/кг и третьей опытной группы в дозе 0,9 г/кг. Кровь для исследований отбирали в
начале опыта, в середине и в конце откорма.
До начала опытов в крови молодняка крупного рогатого скота содержалось: эритроцитов – 5,98-6,06∙1012л, лейкоцитов – 6,70-6,76∙109/л, тромбоцитов –
362,6-363,6∙109/л, гемоглобина – 99,0-99,8 г/л.
Ксередине откорма у бычков первой опытной группы наблюдалось повышение количества эритроцитов относительно контрольных значений на 13,33% (р<0,001), у представителей второй опытной группы число эритроцитов увеличилось на 14,00% (р<0,001), третьей – на 15,33% (р<0,001). В данный период наблюдений количество лейкоцитов в крови бычков опытных групп было на уровне контрольных значений. Количество тромбоцитов также изменилось незначительно. Что касается гемоглобина, то данный показатель у представителей опытных групп увеличился на 14,0314,82% (р<0,01-0,001).
Кконцу опытов по количеству эритроцитов превосходство оставалось за животными опытных групп. Так, у молодняка крупного рогатого скота первой опытной группы число красных кровяных клеток было больше, чем у сверстников из контрольной группы на 12,87% (р<0,001), второй – на 13,53% (р<0,001), третьей – на 13,20%) (р<0,01). Количество лейкоцитов и тромбоцитов изменялось незначительно и недостоверно.
Под влиянием гермивита происходило нарастание в крови животных количества гемоглобина в первой опытной группе – на 14,31%) (р<0,01), во второй – на 13,92% (р<0,001), в третьей – на 13,73% (р<0,01).
Таким образом, гермивит в указанных дозах оказывает положительное влияние на показатели крови бычков.
Литература
1.Топурия Г.М., Топурия Л.Ю. Иммунный статус крупного рогатого скота при применении гамавита // Известия Оренбургского государственного аграрного университета. 2011. Т.1. №29-1. С. 69-71.
2.Топурия Г.М., Топурия Л.Ю. Применение миксоферона для коррекции иммунодефицитных состояний у телят // Вестник ветеринарии. 2005. Т. 32. № 1. С. 65-67.
3.Топурия Г.М., Топурия Л.Ю. Применение препарата из тимуса северного оленя для повышения иммунного статуса телят // Зоотехния. 2002. №10. С. 21-22.
4.Топурия Г.М., Топурия Л.Ю. Профилактика иммунодефицитных состояний у телят // БИО. 2007. №7. С. 50.
5.Топурия Г.М., Топурия Л.Ю., Рубинский И.А. Влияние гермивита на обмен веществ у телок // Ветеринария. 2011. №2. С. 59-61.
6.Топурия Г.М., Топурия Л.Ю., Рубинский И.А. Показатели иммунного статуса телочек при применении гермивита // Ветеринария. 2011. №4. С. 12-14.
7.Топурия Г.М., Топурия Л.Ю., Чернокожев А.И. Гермивит - эффективная кормовая добавка для телят в молочный период выращивания // Вестник мясного скотоводства. 2011. Т. 1. № 64. С. 84-89.
196
8.Топурия Г.М., Чернокожев А.И. Применение гермивита при выращивании телят // Ветеринария Кубани. 2010. №3. С. 7-8.
9.Топурия Л. Олетим - иммуностимулятор для коров и телят // Молочное и мясное скотоводство. 2007. № 2. С. 43.
10.Топурия Л., Топурия Г. Эффективность применения рибава стельным коровам для нормализации иммунного статуса новорожденных телят // Главный зоотехник. 2007. №10. С. 59-61.
11.Топурия Л.Ю. Влияние олетима на воспроизводительную функцию свиноматок и сохранность поросят // Ветеринария. 2006. № 11. С. 34-36.
12.Топурия Л.Ю. Иммуномодуляторы в системе лечебно-профилактических мероприятий при болезнях молодняка сельскохозяйственных животных // Известия Оренбургского государственного аграрного университета. 2006. Т. 2. № 10-1. С. 166-169.
13.Топурия Л.Ю. Коррекция иммунологической недостаточности крупного рогатого скота // Вестник Российской академии сельскохозяйственных наук. 2005. № 6. С. 17-19.
14.Топурия Л.Ю., Топурия Г.М. Лечебно-профилактическая эффективность олетима при болезнях телят // Известия Оренбургского государственного аграрного университета. 2008. Т. 1. № 17-1. С. 109-111.
15. Топурия Л.Ю., Топурия Г.М. Основные принципы иммунокоррекции в ветеринарной медицине // Ветеринария Кубани. 2010. №4. С. 3-4.
УДК 619:615.33
С.В. Семенов – аспирант; Г.М. Топурия – научный руководитель, профессор.
ФГБОУ ВПО Оренбургский ГАУ, г. Оренбург, Россия
ВЛИЯНИЕ ГУМИНОВЫХ ВЕЩЕСТВ НА Т- И В-СИСТЕМУ ИММУНИТЕТА СВИНЕЙ
Аннотация. Изучено влияние лигногумата-КД-А на Т- и В-систему иммунитета свиноматок и их приплода. Установлено, что препарат оказывает позитивное влияние на количественное содержание иммунокомпетентных клеток в крови свиней.
Ключевые слова: свиньи, гуминовые препараты, Т-лимфоциты, В- лимфоциты.
Актуальная проблема современного животноводства – это максимальная реализация генетического потенциала продуктивности животных, что напрямую связано с повышением воспроизводительной способности, увеличением сохранности молодняка, нормализацией иммунобиохимического статуса организма. В последние годы для улучшения иммунного статуса у животных и повышения их продуктивности широко используют препараты природного происхождения с иммуностимулирующей активностью [1-13].
Цель наших исследований – изучить влияние гуминового препарата лигногу- мат-КД-А на содержание Т- и В-лимфоцитов в крови свиноматок и их приплода.
Лигногумат-КД-А – кормовая добавка на основе калиевых солей гуминовых кислот, полученных методом окислительно-гидролитической деструкции лигнинсодержащего сырья от переработки древесины хвойных и лиственных пород.
В условиях свинокомплекса «Оренбургский бекон» было сформировано четыре группы супоросных свиноматок породы йоркшир. Животные контрольной группы находились на хозяйственном рационе и препарат не получали. Свино-
197
маткам первой опытной группы за 2 месяца до опороса скармливали лигногумат- КД-А в дозе 10 мг/кг живой массы в течение 10 дней с 10-дневным перерывом. Животным второй и третьей опытных групп препарат скармливали по аналогичной схеме в дозах 20 и 30 мг/кг соответственно.
Кровь для исследований отбирали у свиноматок за два и один месяц до опороса, в первый день лактации, в день отъема поросят. У поросят, пробы крови брали в день отъема. В крови определяли количество Т- и В-лимфоцитов.
За два месяца до опороса у свиноматок всех подопытных групп содержание Т-лимфоцитов в крови составляло 54,36-54,46%, В-лимфоцитов –
21,32-24,42%.
Существенных различий по содержанию Т-лимфоцитов в крови свиноматок контрольной и опытных групп за месяц до родов не установлено. Сразу после опороса, у животных первой опытной группы наблюдалось увеличение числа Т- лимфоцитов по сравнению с контрольными значениями на 3,65% (р<0,05), у свиноматок второй опытной группы эта разница составила 9,89% (р<0,001), третьей опытной – 10,74% (р<0,001). У свиноматок опытных групп в день отъема поросят изучаемый показатель был выше, чем у интактных животных на 7,21 (р<0,001), 11,65 (р<0,001) и 12,13% (р<0,001) соответственно.
Поросята, полученные от свиноматок, которым скармливали лигногумат- КД-А, в день отъема имели превосходство над контрольными животными по количеству Т-лимфоцитов на 3,56-3,39%.
Лигногумат-КД-А оказал позитивное влияние и на количественное содержание В-лимфоцитов в крови подопытных животных. Так, за 30 дней до опороса у свиноматок первой опытной группы число В-лимфоцитов превышало контрольные значения ни 11,51% (р<0,01), у представителей второй и третьей опытных групп эта разница составила 10,86% (р<0,05). В первый день лактации изучаемый показатель оставался на достаточно высоком уровне у свиней, которым применяли гуминовый препарат. Разница в пользу животных опытных групп составила,
соответственно, 11,88 (р<0,001), 14,92 (р<0,01) и 14,73% (р<0,001). В период отъ-
ема количество В-лимфоцитов у свиноматок, первой и третьей опытных групп было больше, чем у контрольных животных на 20,56% (р<0,001), а у представителей второй опытной группы – на 20,94% (р<0,001),
Введение в рацион супоросных свиноматок лигногумата-КД-А способствовало увеличению количества В-лимфоцитов в крови поросят-отъемышей на 2,68-4,23% по сравнению с поросятами контрольной группы.
Таким образом, применение супоросным свиноматкам гуминового препарата лигногумат-КД-А в изученных дозах способствует увеличению количества иммунокомпетентных клеток в крови животных.
Литература
1.Топурия Г.М., Бибикова Д.Р. Коррекция иммунного статуса поросят-отъемышей // Вестник ветеринарии. 2013. №3. С. 58-61.
2.Топурия Г.М., Топурия Л. Ю., Инякина К. А. Экология и воспроизводство животных: монография. Оренбург: Издательский центр ОГАУ, 2009. 98 с.
3.Топурия Г.М., Топурия Л.Ю. Иммунный статус крупного рогатого скота при применении гамавита // Известия Оренбургского государственного аграрного университета. 2011. Т.1. №29-1. С. 69-71.
4.Топурия Г.М., Топурия Л.Ю. Коррекция иммунного статуса и воспроизводительной способности у крупного рогатого скота в условиях экологического неблагополучия // Ветеринария Кубани. 2011. №1. С. 22-23.
198
5.Топурия Г.М., Топурия Л.Ю. Применение препарата из тимуса северного оленя для повышения иммунного статуса телят // Зоотехния. 2002. №10. С. 21-22.
6.Топурия Г.М., Топурия Л.Ю., Рубинский И.А. Показатели иммунного статуса телочек при применении гермивита // Ветеринария. 2011. №4. С. 12-14.
7.Топурия Г.М., Топурия Л.Ю., Чернокожев А.И. Гермивит - эффективная кормовая добавка для телят в молочный период выращивания // Вестник мясного скотоводства. 2011. Т. 1. № 64. С. 84-89.
8.Топурия Г.М., Чернокожев А.И. Применение гермивита при выращивании телят // Ветеринария Кубани. 2010. №3. С. 7-8.
9.Топурия Л.Ю. Влияние олетима на воспроизводительную функцию свиноматок и сохранность поросят // Ветеринария. 2006. № 11. С. 34-36.
10. Топурия Л.Ю. Влияние рибава на физиологическое состояние и воспроизводительную способность свиноматок // Вестник ветеринарии. 2007. Т. 43. № 4. С. 49-52.
11.Топурия Л.Ю., Стадников А.А., Топурия Г.М. Фармакокоррекция иммунодефицитных состояний у животных: монография. Оренбург: Издательский центр ОГАУ, 2008. 176 с.
12.Топурия Л.Ю., Топурия Г.М. Влияние препаратов природного происхождения на воспроизводительную способность и иммунный статус коров // Вестник Алтайского государственного аграрного университета. 2007. №5. С. 52-55.
13.Топурия Л.Ю., Топурия Г.М. Основные принципы иммунокоррекции в ветеринарной медицине // Ветеринария Кубани. 2010. №4. С. 3-4.
УДК 619:616.1/.4
Е.В. Устюжанина – студентка; Л.В. Пилип – научный руководитель, доцент;
О.В. Бякова – научный руководитель, старший преподаватель. ФГБОУ ВПО Вятская ГСХА, г. Киров, Россия
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ОСТРЫХ ЖЕЛУДОЧНО-КИШЕЧНЫХ ЗАБОЛЕВАНИЙ У ПОРОСЯТ
Аннотация. Острые желудочно-кишечные заболевания новорождѐнных поросят широко распространены во всех свиноводческих хозяйствах. Одной из причин развития данных заболеваний является снижение естественной резистентности матерей, являющееся причиной дисбиотических состояний поросят и проявляющееся расстройствами в функционировании желудочно-кишечного тракта поросят.
Ключевые слова: желудочно-кишечные заболевания, этиология, поросята, биохимические и иммунологические исследования крови.
Диарейные болезни неинфекционной этиологии распространены повсеместно, развиваются в первые часы жизни животного, сопровождаются тяжелыми токсическими явлениями, характеризуются высоким падежом и наносят большой экономический ущерб [2]. Желудочно-кишечные заболевания поросят являются огромной проблемой, несмотря на огромное количество препаратов, применяемых в животноводстве [3]. В связи с этим на первый план выходит выяснение причин возникновения данной патологии. Причинами заболевания и отхода молодняка в условиях промышленного комплекса многие авторы называют нарушение микробного равновесия: преобладание условно-патогенной и патогенной микрофлоры над симбионтной, гинекологическую патологию свиноматок, гиповитаминозы, дефициты микро- и макроэлементов, гипопротеинемии с последую-
199
щим развитием вторичных иммунодефицитов у матерей и рождением физиологически неполноценного приплода, гипоксии, гипотрофии и иммунопатологии [1,3].
Целью исследований было изучение причин развития острых желудочнокишечных заболеваний у новорожденных поросят подсосного периода в крупных свиноводческих хозяйствах г. Кирова.
Работу проводили в ЗАО «Заречье» и Агрофирме «Дороничи» г. Кирова. Опыты проводили на супоросных свиноматках крупной белой породы и полученных от них клинически здоровых и больных диспепсией поросятах в возрасте от рождения до 2-месяцев.
Кровь для исследования у супоросных свиноматок получали из большой ушной вены за 5-10 дней до опороса, у новорожденных поросят из хвостовой вены или бедренной вены. Общий белок в сыворотке крови определяли рефрактометрически, бактерицидную активность сыворотки крови (БАСК) исследовали по методу О. В. Смирновой и Т. А. Кузьминой (1966), лизоцимную активность сыворотки крови (ЛАСК) определяли по методу В. Г. Дорофейчука (1968).
Для выяснения причин возникновения желудочно-кишечных заболеваний у поросят подсосного периода в свиноводческих хозяйствах города Кирова были проведены биохимические и иммунологические исследования крови у супоросных свиноматок и поросят подсосного периода. Результаты исследований представлены в таблицах 1,2,3.
Таблица 1
Иммунобиохимические показатели крови супоросных свиноматок в крупных свиноводческих хозяйствах г. Кирова (n = 10)
Обследо |
|
|
|
Показатели |
|
|
|
|
ванное хо- |
Общий |
Альбу- |
α-глобу- |
|
Β глобу- |
γ-глобу- |
ЛАСК, |
БАСК, |
зяйство |
белок, |
мины, |
лины, |
|
лины, |
лины, |
% М±м |
% М±м |
|
г/ М±м |
% М±м |
% М±м |
|
% М±м |
% М±м |
|
|
ЗАО |
65,82± |
44,4± |
13,60± |
|
16,69± |
25,32± |
25,4± |
50,0± |
«Заречье» |
0,62 |
1,94 |
1,77 |
|
1,80 |
1,69 |
1,19 |
0,86 |
АФ «Доро- |
66,3± |
45,5± |
11,68± |
|
22,45± |
20,85± |
46,4± |
52,36± |
ничи» |
1,25 |
6,4 |
3,8 |
|
4,7 |
5,2 |
4,65 |
3,2 |
Количество общего белка у супоросных свиноматок (таблица 1) было от
65,82 ± 0,62 до 66,3 ± 1,25 г/л, альбуминов от 44,4 ± 1,94 до 45,5 ± 6,4 %, альфа -
глобулинов от 11,68 ± 3,8 до 13,60 ± 1,77 %, бета – глобулинов от 16,69 ± 1,80 до
22,45 ± 4,7 %, гамма – глобулинов от 20,85 ± 5,2 до 25,32 ± 1,69 %. Показатели неспецифической резистентности были на низком уровне: ЛАСК от 25,4 ± 1,19 до
46,4 ± 4,65 %, БАСК от 50,0 ± 0,86 до 52,36 ± 3,2 %.
У клинически здоровых поросят подсосного периода (таблица 2) наблюдается снижение показателей общего белка от 54,49 ± 0,83 до 56,23 ± 2,54 г/л, аль-
буминов от 38,14 ± 0,77 % до 38,66 ± 1,96, альфа - глобулинов от 13,59 ± 3,99 до 13,60 ± 0,48 %, гамма – глобулинов от 22,49 ± 0,68 до 24,9 ±9,22 %, а кроме того происходит увеличение бета – глобулинов от 21,57 ± 5,33 до 25,26 ± 0,78 % и изменение альбумино – глобулинового соотношения в сторону увеличения глобулиновой фракции. Показатели неспецифической резистентности также оказались на низком уровне: ЛАСК от 21,17 ± 7,57 до 41,60 ± 0,64 %, БАСК от 35,56 ± 3,52 до 40,62± 0,95 %.
200
