
755
.pdf
Д.И.Менделеева отражает периодический закон, а вместе с тем и строение атомов элементов.
3.3.1. Периодический закон Д.И.Менделеева
Современная формулировка периодического закона:
Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра их атомов (и электронной структуры их атомов).
Физический смысл периодического закона состоит в периодическом повторении строения внешнего энергетического уровня атомов элементов при возрастании положительных зарядов их ядер.
3.3.2. Периодическая система элементов Д.И.Менделеева
Периодическая система элементов (ПСЭ), представляющая собой классификацию химических элементов, составлена Д.И.Менделеевым. В основу этой классификации ученый положил атомную массу элемента. С позиций современной теории строения атома периодичность изменения свойств элементов обусловлена периодичностью изменения строения их атомных оболочек.
Физический смысл периодической системы: ПСЭ – графическое обозначение периодического закона.
Структура ПСЭ отражена на схеме 3.1.
|
|
|
|
|
|
|
|
|
|
Периодическая система |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Периоды |
|
|
|
|
|
|
Элементы |
|
|
|
|
|
|
Группы |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Порядковый номер элемента |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Малые |
|
Большие |
|
|
|
|
|
|
|
|
|
Побочные |
|
|
Главные |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2, 3 |
|
4 и далее |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Схема 3.1. Структурные составляющие периодической системы элементов
Порядковый номер имеет каждый элемент в периодической системе
свой.
Физический смысл порядкового номера: он соответствует заряду ядра атома и суммарному количеству электронов в нем.
21

Период – горизонтальный ряд периодической таблицы, в котором элементы расположены в порядке возрастания зарядов ядер их атомов. Номер периода совпадает со значением главного квантового числа.
Физический смысл номера периода: Он соответствует числу энергетических уровней, заполняемых электронами, в атомах элементов, составляющих период.
Всего в таблице 7 периодов. 1-ый период состоит только из двух s- элементов: водорода и гелия. 7-ой период не завершен, новые элементы ещѐ предстоит открыть. Два периода, второй и третий, называются малыми, каждый из них состоит только из восьми элементов. Они называются типичными.
Вмалых периодах с ростом положительного заряда ядер атомов возрастает число электронов на внешнем уровне (от 1 до 8). Это объясняет изменение свойств элементов: в начале периода находятся щелочной металл, затем металлические свойства постепенно ослабевают и усиливаются неметаллические свойства.
Вбольших периодах (с 4-го по 7-ой) с ростом заряда ядер заполнение уровней электронами происходит сложнее: после полного заполнения s- подуровня у щелочноземельных металлов, происходит заполнение d-подуровня предвнешнего уровня у десяти элементов. После чего электроны заполняют р- подуровень внешнего уровня, заполнение последнего завершается у благородных газов.
Четвертый и пятый периоды состоят из 18 элементов.
Ватомах элементов шестого и седьмого периодов после d-элементов лантана (Z=57) и актиния (Z=89) начинается заполнение f-подуровней 14 электронами, соответственно, четвертого и пятого энергетических уровней. Шестой период состоит из 32 элементов, при этом 14 f-элементов (лантаноиды) вынесены в отдельный ряд. Отдельный ряд представлен 14 f-элементами седьмого периода (актиноиды). Однако как уже отмечалось выше, этот период еще не завершен.
Группа – вертикальный ряд (столбец) в периодической системе. Всего в таблице 8 групп.
Физический смысл номера группы: Он соответствует высшей
валентности элементов, составляющих группу, т.е. номер группы указывает максимальное число электронов, которые могут участвовать в образовании химических связей.
Группы делятся на подгруппы: главную и побочную. Такое деление основано на различии в заполнении электронами энергетических уровней. У элементов главных подгрупп заполняются s- подуровни (это s-элементы) или р- подуровни (р-элементы) внешних уровней. У элементов побочных подгрупп заполняется d-подуровень второго снаружи уровня (d-элементы). Таким образом, в каждой подгруппе объединены элементы, атомы которых имеют сходную электронную структуру. Они называются полными электронными аналогами, проявляют одинаковые химические свойства. Элементы главной и
22
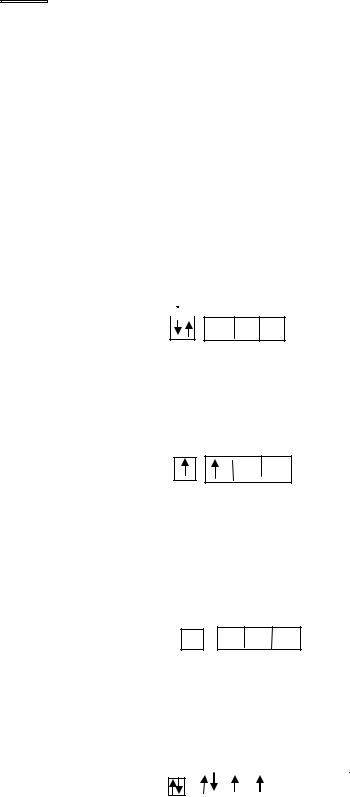
побочной подгрупп являются неполными электронными аналогами, их свойства одинаковы только при максимальной валентности, равной номеру группы.
Изменение свойств химических элементов в группе: с ростом заряда ядра (направление в группе сверху вниз) металлические свойства элементов в каждой подгруппе усиливаются, а неметаллические – ослабевают. Причиной тому является ослабление связи электронов внешнего уровня с ядром по мере увеличения радиуса атома.
Задачи и упражнения
Пример 1. Дать характеристику, исходя из положения в периодической системе, элементу с порядковым номером 12.
Решение: это s-элемент магний
12Mg﴿ ﴿ ﴿ |
1s22s2p63s2 |
|
2 8 2 |
3 |
|
S p
Mg – металл, т.к. на внешнем уровне 2 электрона.
Пара электронов на внешнем уровне и наличие на последнем свободных орбиталей (на 3-ем уровне имеется три подуровня: s, p, d) позволяет сделать вывод, что у магния есть одно возбужденное состояние
Mg* 3 s1p1 |
3 |
3 |
Sp
Ввозбужденном состоянии в атоме магния на внешнем уровне имеется
два неспаренных электрона, следовательно, валентность его равна 2 (В=2). Ей соответствует степень окисления с.о. = +2.
Электронная структура магния в химических соединениях: MgOоксид магния (основной оксид), Mg(OH)2 – гидроксид магния (нерастворимое основание), MgSO4 – сульфат магния (средняя соль)
Mg+2 3s0p0 |
3 |
S p
Пример 2. Дать характеристику, исходя из положения в периодической системе, элементу с порядковым номером 16.
Решение: это p-элемент сера
16S﴿ ﴿ ﴿ |
1s22s2p63s2p4 |
|
|
|
|
|
|
|
|
|
2 8 4 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
S |
|
p |
|
|
|
d |
|||
S – неметалл, так как на внешнем уровне 6 электронов (более 4-х). Из них два электрона неспаренные, следовательно:
min B = II. Ей соответствует min с.о. = -2.
23
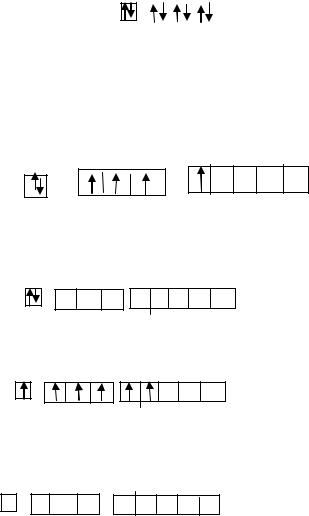
Электронная структура серы в химических |
соединениях: |
H2S – |
|||||||||
сероводород, CaS – сульфид кальция (соль) |
|
|
|
|
|
|
|
|
|
|
|
S-2: 3s2p6 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
S |
p |
|
|
|
d |
|
||||
С.о. = +2 соответствует соединение SO, являющееся неустойчивым оксидом.
Атом серы имеет два возбужденных состояния благодаря наличию на внешнем уровне двух пар электронов и свободных орбиталей на 3d-подуровне.
S*: 3 s2p3d1 |
3 |
3 |
S |
p |
d |
При первом возбужденном состоянии В = IV, с.о. = +4 электронная структура серы в химических соединениях: SO2-сернистый ангидрид (кислотный оксид), H2SO3 – сернистая кислота и ее соли (сульфиты)
S+4 : 3s2p0 |
3 |
S |
p |
d |
Второе возбужденное состояние, характеризующееся max В = VI, S**: 3s1p3d2
3
S |
p |
d |
Приводит к образованию соединений, в которых сера имеет max с.о. = +6: кислотный оксид SO3 – серный ангидрид, H2SO4 – серная кислота и еѐ соли (сульфаты)
S+6: 3s0p0 |
3 |
S |
p |
d |
Пример 3. Пользуясь периодической системой элементов, напишите формулы высших оксидов и летучих водородных соединений элементов, порядковые номера которых 7, 12, 35.
Решение: 7N – азот находится в главной подгруппе V группы, следовательно, его высшая с.о. = +5 в кислотном оксиде N2O5, в азотной кислоте HNO3 и в еѐ солях (нитратах). Минимальной с.о.= -3 соответствует летучее водородное соединение NH3 – аммиак.
Для углерода 12С, находящегося в главной подгруппе IV группы max с.о.= +4 в кислотном оксиде СО2, в угольной кислоте H2CO3, min с.о. = -4 в летучем водородном соединении СН4 (метан).
35Br – бром, элемент VII группы главной подгруппы имеет max с.о. = +7 в кислотном оксиде Br2O7. Min с.о. = -1 в HBr – бромоводороде, летучем водородном соединении.
24
Пример 4. Какому химическому элементу соответствует электронная формула 1s22s2p63s2p1?
Решение: Согласно электронной формуле у данного элемента электроны заполняют р-подуровень внешнего, 3 по счету, уровня, следовательно, это р- элемент, у которого имеется три электрона на внешнем уровне, и его место в главной подгруппе III группы. Суммарное число электронов в его атоме равно 13. Элемент с порядковым номером 13 – алюминий.
Вопросы для самопроверки
1.Какие элементарные частицы входят в состав атома?
2.Физический смысл порядкового номера элемента в периодической
системе.
3.Физический смысл номера группы в периодической системе.
4.Как изменяются химические свойства элементов в группах периодической системы?
5.Какие подгруппы называются главными, и какие побочными? Какие элементы являются полными и неполными электронными аналогами?
6.Что называется орбиталью? Формы s-, p- и d-орбиталей?
7.Что называется s-, p-, d- и f-элементами?
8.Что такое основное и возбужденное состояние атома?
9. Какова современная формулировка периодического закона Д.И.Менделеева?
10.Физический смысл номера периода в периодической системе.
11.Как изменяются химические свойства элементов в периоде периодической системы?
12.Напишите электронные и электронно-графические формулы атомов элементов с порядковыми номерами: а) 20; б) 25; в) 32.
13.Электронная формула элемента изображена в виде …5d46s2. определить порядковый номер этого элемента.
25

Глава 4. Химическая связь. Строение вещества
Важнейшие понятия
Типы связей: ковалентная, координационная, ионная, металлическая и водородная.
Механизмы возникновения ковалентной связи: обменный и донорноакцепторный.
Характеристики связей: направленность, насыщаемость, энергия и длина связи.
Геометрия молекул.
Механизм образования ионной связи. Особенности ионной связи и строение кристаллов с одноатомными и многоатомными ионами. Металлическая связь и строение металлических кристаллов. Степень окисления и валентность с точки зрения строения атома и вещества.
При изучении темы необходимо:
-получить общее представление об образовании химической связи в молекулах веществ;
-понять природу и характерные свойства ковалентной, ионной и металлической связи;
-знать валентность и объяснять еѐ с точки зрения учения о строении
атома.
Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи. Наиболее устойчивым является состояние атома с завершенным внешним уровнем, содержащим максимальное число электронов. Таковы внешние уровни атомов благородных газов: у гелия на внешнем уровне два электрона (1s2), у остальных – по восемь электронов (ns2p6). Атомы других элементов, не имеющих завершенного внешнего уровня, приобретают такую структуру в процессе химического взаимодействия с другими атомами (Правило «октета»). Химическое взаимодействие атомов друг с другом приводит к образованию химических связей и возникновению молекул. В тоже время и молекулы вещества взаимодействуют друг с другом.
Химическая связь – это совокупность сил, связывающих атомы или молекулы друг с другом в устойчивые структуры.
При образовании химической связи между атомами в молекуле вещества участвуют валентные электроны атомов.
4.1.Валентность. Степень окисления. Относительная
электроотрицательность
Валентность атома (элемента) относится к основным понятиям химии. Валентность – это количество связей, которые образует атом с другими атомами в молекуле вещества. В образовании химических связей между атомами участвуют наиболее слабо связанные (валентные) электроны. К
26
валентным электронам относятся, как отмечалось ранее (3.2.4.), электроны внешних незавершенных уровней, а также неспаренные электроны второго снаружи уровня (у d-элементов).
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов, а молекула в целом электронейтральна. Отрицательную степень окисления имеют атомы, которые приняли электроны от других атомов, положительную – атомы, отдавшие свои валентные электроны другим атомам. Нулевую степень окисления имеют атомы в молекулах простых веществ.
Алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе – заряду иона.
Степень окисления, как правило, численно равна валентности атома элемента в молекуле вещества. В молекулах органических соединений этого совпадения может не быть.
Относительная электроотрицательность (Χ) – это способность атома в молекуле притягивать к себе валентные электроны. Это условная величина. Обычно электроотрицательность лития принимают за единицу, и с ней сравнивают электроотрицательность других элементов. Наиболее электроотрицательным элементом является фтор, наименьшее значение Χ имеет франций (87Fr).
Таким образом, эта величина является мерой неметалличности элементов: чем больше относительная электроотрицательность, тем сильнее элемент проявляет неметаллические свойства.
При химическом взаимодействии элементов электроны, участвующие в образовании химической связи, смещаются от атома с меньшей к атому с большей относительной электроотрицательностью. При составлении химических формул соединений, как правило, наиболее электроотрицательные элементы помещают правее, например, SO2, CaCl2, H2S и т.д.
Согласно современным представлениям, образование химической связи между двумя атомами происходит путем обобществления (образования общих электронных пар) или перераспределения их валентных электронов. В связи с этим различают три типа химической связи: ковалентную, ионную и металлическую.
4.2. Химическая связь и составление графической формулы вещества
Графическая формула химического соединения показывает, в каком порядке и каким количеством валентных связей атомы связаны в молекуле друг с другом. Каждая валентная связь между атомами обозначается черточкой. Перед построением графической формулы необходимо определить степень окисления атомов, входящих в состав молекулы. Соединять, как правило, можно только атом, имеющий положительную степень окисления, с атомами, имеющими отрицательную степень окисления.
27

Так, например, в молекуле сернистого газа SO2 степень окисления серы равна +4, кислорода -2. Поэтому от S должно исходить четыре связи (обозначим их чѐрточками), а от атома О две:
—S— —О—
В целом, вся молекула нейтральна, поэтому все валентные связи должны быть «замкнуты»:
О=S=O.
4.3.Ковалентная связь
Химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов, называется ковалентной связью. Это двухэлектронная и двуцентровая связь (удерживает два ядра).
4.3.1. Механизм образования ковалентной связи
Ковалентная связь существует в молекулах между атомами неметаллов. В зависимости от того, как возникает общая электронная пара, эта связь может образовываться по обменному или донорно-акцепторному механизму.
При обменном механизме в образовании общей электронной пары от каждого атома участвуют и атомная орбиталь, и неспаренный электрон, находящийся на этой орбитали, т.е. происходит обобществление электронов:
а) Н· + ·Н → Н:Н
 общая электронная пара
общая электронная пара
|
·· |
·· |
·· |
·· |
б) |
:Cl· + ·Cl: → :Cl : Cl: неподеленная пара электронов |
|||
|
·· |
·· |
·· |
·· |
неспаренный электрон |
|
|
общая электронная пара |
|
|
|
·· |
|
·· |
в) |
Н· + ·Cl: → Н |
: Cl: |
||
|
|
·· |
|
·· |
|
|
|
|
общая электронная пара |
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи (схемы а, б) электронное облако, образованное общей парой электронов (электронное облако связи) распределяется в пространстве симметрично относительно ядер обоих атомов. Такая связь реализуется в молекулах простых веществ неметаллов O2, N2 и др., в которых общая электронная пара в одинаковой мере принадлежит обоим атомам.
28
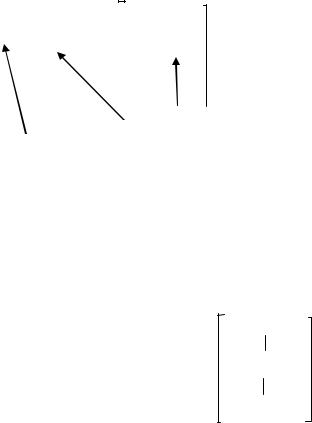
В случае полярной ковалентной связи (схема в) электронное облако смещено к атому с большей электроотрицательностью. Этот атом приобретает небольшой отрицательный заряд. Другой атом, участвующий в образовании связи, приобретает такой же по абсолютной величине положительный заряд. Такая связь существует, например, в молекулах летучих неорганических соединений: H2S, NH3 и др.
При донорно-акцепторном механизме химическая связь возникает за счет свободной электронной пары (двуэлектронного облака) одного атома (донора) и свободной орбитали другого атома (акцептора). В качестве примера рассмотрим механизм образования иона аммония NH4+.
Н |
|
Н |
+ |
|||
·· |
|
·· |
|
|
|
|
Н :N: + Н+ → |
Н :N |
: |
Н |
|
||
·· |
|
·· |
|
|
|
ион аммония |
Н |
ион |
Н |
|
|
|
|
молекула |
водорода |
|
|
общая электронная пара |
||
аммиака |
( акцептор) |
свободная орбиталь |
||||
( донор) |
свободная электронная пара |
|
|
|
||
Донорно-акцепторная связь - это особый механизм образования ковалентной связи. По свойствам четвертая N–H-связь в ионе аммония ничем не отличается от остальных трех.
В структурных формулах принято электронные пары показывать в виде ‖—‖. Например, H—H, H—Cl, H—O—H. Структурную формулу катиона аммония можно записать, показывая наличие донорно-акцепторной связи в виде ײ→ײ:
Н +
H—N→H
H
4.3.2. Свойства ковалентной связи
Характерные свойства ковалентной связи: еѐ длина, энергия, направленность и насыщаемость.
Длина связи – это межъядерное расстояние. Чем она меньше, тем прочнее химическая связь.
Энергия связи – мера прочности связи, определяется количеством энергии, необходимой для разрыва связи. Единицы измерения: кДж/моль.
Насыщаемость связи – способность атомов образовывать ограниченное число ковалентных связей, что определяется их валентностью. Вследствие
29

насыщаемости связей молекулы с ковалентной связью имеют определенный состав: H2O, NH3 и др.
Направленность ковалентной связи определяет пространственную структуру молекул, т.е. их геометрию (форму). Молекулы H2, HCl имеют линейную форму; молекула Н2О – угловую форму, NH3 – форму пирамиды, а СН4 - тетраэдрическую.
4.4. Ионная связь
Химическая связь между ионами (заряженными частицами), в которые превращаются атомы в результате отдачи или присоединения электронов называется ионной связью.
4.4.1. Механизм образования ионной связи
В результате перераспределения электронов между атомами элементов, сильно различающимися по электроотрицательности (атом металла и атом неметалла), возникает ионная связь. Исходные нейтральные атомы становятся ионами: атомы металлов положительными ионами катионами, сильно электроотрицательные атомы неметаллов отрицательными ионами анионами. Противоположно заряженные ионы притягиваются друг к другу.
Схема образования ионной связи:
··
Na· + ·Cl:
··
атом металла атом неметалла ионное соединение
Процесс образования ионной связи можно представить совокупностью трех элементарных стадий:
1. Потеря атомами натрия (1s22s2p63s1) электрона, занимающего 3sорбиталь.
2. Присоединение атомом хлора (1s22s2p63s2р5) электрона, заполняющего 3р-орбиталь.
3. Электростатическое притяжение образующихся ионов: катиона натрия
(1s22s2p6) и аниона хлора (1s22s2p63s2р6).
4.4.2. Свойства ионной связи
Ионная связь наблюдается только в соединениях типичных металлов и типичными неметаллами (соли безкислородных кислот) и только в твердом состоянии.
Характерная особенность соединений с ионной связью – ассоциация. Благодаря ассоциации ионов между собой все соединения с ионной связью в твердом состоянии имеют ионную кристаллическую структуру. Их расплавы и растворы проводят электрический ток.
Ненасыщенность связи: в ионном кристалле к данному положительному иону, может притягиваться любое число отрицательных ионов.
30
