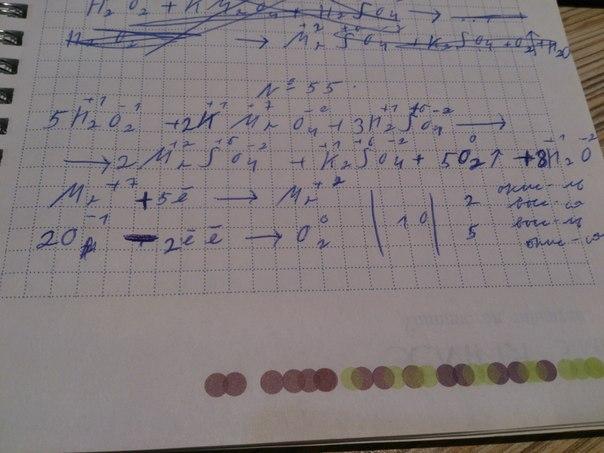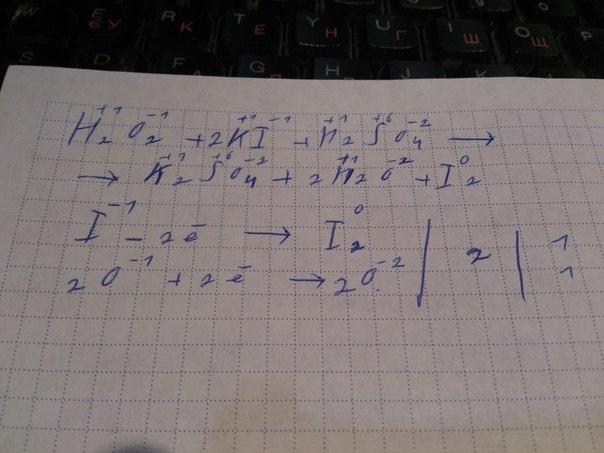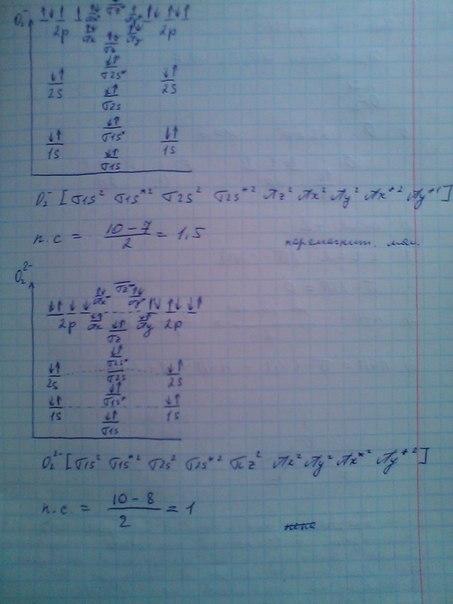химия
.docx

2. ) I. Главное квантовое число (совпадает с номером периода): n=1, 2, 3, 4, …,
Характеризует: 1) номер энергетического уровня, равный номеру периода
2) энергию электрона на уровне
3) радиус ядра, т.е. степень удаления от ядра:
4) максимальное число электронов на энергетическом уровне: N = 2n2
II. Орбитальное квантовое число: ln=0, 1, 2, 3, …, n-1
Характеризует: 1) энергию электрона на подуровне
2) форму электронной орбитали: l=0, то s-орбиталь; l=1, то p-орбиталь; l=2, то d-орбиталь; l=3, то f-орбиталь
III. Магнитное квантовое число: m = —1, 0, 1
Характеризует: 1) энергию электрона в энергетическом состоянии
2) ориентацию электронной орбитали в пространстве
3) проекцию орбитального момента на направление поля
IV. Спиновое квантовое число: ms = ½, — ½
Орбитальное и магнитное квантовые числа зависят от значения главного квантового числа.
В атоме не может существовать двух электронов, у которых все 4 квантовых числа одинаковые.
3) Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
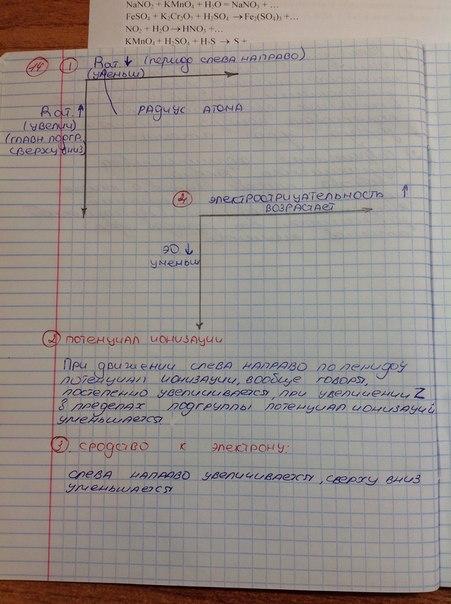
Энергии ионизации атома-энергия, необходимая для удаления электрона от нейтрального атома (молекулы), зависит от эффектного заряда ядра. эВ
Электронные конфигурации:
F - 1s2 2s2 2p5
Cl - 1s2 2s2 2p6 3s2 3p5
Br - 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
I - 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
4. "Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов".Энергия ионизации атома - та энергия, что требуется для разрыва связей в атоме водорода, была определена экспериментально. Она равна 13,6 эВ (электронвольт). Также экспериментально была определена энергия, необходимая для отрыва электрона от ядра в атоме, состоящем из одного электрона и ядра, заряд которого в два раза больше, заряда ядра атома водорода. В этом случае необходимо затратить в четыре раза больше энергии (54,4 эВ).Как известно из электростатики, энергия (Т), необходимая для разрыва связи между противоположенными зарядами (Z и е), находящимися друг от друга на расстоянии R, определяется равенством T=Z.e/R
Она пропорциональна величине зарядов и обратно пропорциональна расстоянию между ними. Такая корреляция вполне понятна: чем больше заряды, тем сильнее их притяжение друг к другу, следовательно, больше энергии требуется для разрыва связи между ними.
Be- 1s2 2s2
Mg- 1s2 2s2 2p6 3s2
Ca- 1s2 2s2 2p6 3s2 3p6 4s2
Sr- 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d1 5s2
Ba- 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6 6s2
Ra- 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2 6p6 7s2
5. Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов VII-группы, O, Kr, Xe), а низкая — у активных металлов (s-элементов I группы).
Электоотрицательность элементов позволяет оценить способность атома элемента оттягивать на себя электронную плотность, по сравнению с атомом электрона в соединении.
Фтор — наиболее электроотрицательный элемент.
электроотрицательность в пределах периода растет слева направо, в пределах группы падает сверху вниз.
OF2 (O +2, F -1)
NF3 (N +3, F -1)
NO2 (N +4, O -2)
6) Орбиталь-волновая ф-ция, описывающая состояние одного электрона в атоме, молекуле или др. квантовой системе.
Квантовое число n – главное . Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He +, Li 2+ и т. д.).
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1.
Квантовое число m l называют магнитным . Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений.

Правило минимума энергии:при заполнении электронами уровней и подуровней последовательность размещения электронов в атоме должна отвечать как наименьшей энергии электрона , так и наименьшей энергии атома в целом.
Правила Паули:в многоэлектронных системах нет двух электронов, находящихся в одинаковых квантовых состояниях, или в атоме не может быть 2 электронов,имеющих одинаковый набор всех квантовых чисел.
Правило Хунда:суммарное спиновое число электронов данного подслоя должно быть максимальным или электроны располагаются симмтрично.
8) Корпускулярно-волновой дуализм.Принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций.В частности, свет -- это и корпускулы (фотоны), и электромагнитные волны. Свет демонстрирует свойства волны в явлениях дифракции и интерференции при масштабах, сравнимых с длиной световой волны. Например, одиночные фотоны, проходящие через двойную щель, создают на экране интерференционную картину, определяемую уравнениями Максвелла. Тем не менее, эксперимент показывает, что фотон не есть короткий импульс электромагнитного излучения, например, он не может быть разделён на несколько пучков оптическими делителями лучей. Корпускулярные свойства света проявляются при фотоэффекте и в эффекте Комптона. Фотон ведет себя и как частица, которая излучается или поглощается целиком объектами, размеры которых много меньше его длины волны (например, атомными ядрами), или вообще могут считаться точечными (например, электрон). Не только каждая электромагнитная волна обладает свойствами частицы, но и каждая движущаяся микрочастица обладает свойствами волны. Чем больше масса частицы, тем меньше длина ее волны.
9)Чем точнее определены координаты частицы, тем менее определ. Становится величина ее скорости ,т.е .произведение минимальных неточностей в положении частицы и ее импульса есть величина порядка постоянной Планка.Квантование по энергии определяется главным квантовым числом п; п характеризует общую энергию электрона в атоме, энергию связи электрона с ядром, размер орбитали.Главное кв. число принимает значения п=1,2,3,……..,бесконеч.Квантование по симметрии определяется (англ.с,п,д,ф,ж,н) орбитальным кв. числом.



12. Главное (радиальное) квантовое число — целое число, обозначающее номер энергетического уровня. Характеризует энергию электронов, занимающих данный энергетический уровень. Является первым в ряду квантовых чисел, который включает в себя главное, орбитальное и магнитное квантовые числа, а также спин. Эти четыре квантовых числа определяют уникальное состояние электрона в атоме (его волновую функцию) . Главное квантовое число обозначается как n. При увеличении главного квантового числа возрастают радиус орбиты и энергия электрона. Главное квантовое число равно номеру периода элемента.
Наибольшее число электронов на энергетическом уровне с учётом спина электрона определяется по формуле N=2n^2
характер изменения орбитального радиуса атомов s- и р-элементов в группе : Увеличиваются, т-к главное квантовое число растет.
Можно условно принять за радиус атома теоретически рассчитанное значение расстояния от ядра до наиболее удаленного от него максимума электронной плотности (орбитальный радиус атома) или половину расстояния между центрами 2-х смежных атомов в кристаллах (эффективные радиусы атомов). Наблюдается периодичность изменение атомных радиусов, особенно у s- и p-элементов. У d- и f-элементов кривая изменения радиусов атомов по периоду имеет более плавный характер. В одной и той же группе с увеличением номера периода атомные радиусы, как правило, возрастают в связи с увеличением числа электронных оболочек. Однако увеличение заряда ядра при этом производит противоположный эффект, поэтому увеличение атомных радиусов с увеличением номера периода относительно невелико, а в некоторых случаях, например у p-элементов III группы значение орбитального радиуса у Al больше, чем у Ga.
У Ga радиус больше чем у In.
13. Периодичность изменения свойств элементов.Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами.
Главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов. Самые сильные окислители (неметаллы) находятся в правом верхнем углу ПСЭ: F, Cl, O. Самые сильные восстановители (металлы) находятся в левом нижнем углу: Fr, Ba, Ra.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
В верхнем правом углу неметаллы, а в нижнем левом металлы. + см табл Менд.
13)Свойства химических элементов определяются зарядом ядра, которое определяет распределение электронов.
Св-ва элементов, а также образуемых ими простых и сложных в-в находятся в периодич. зависимости от заряда ядра.
Диагональ от водорода к радону примерно делит все элементы на металлы и неметаллы, при этом неметаллы находятся выше диагонали. (К неметаллам относят 22 элемента – H, B, C, Si, N, P, As, O, S, Se, Te, галогены и инертные газы, к металлам – все остальные элементы. ) Вдоль этой линии располагаются элементы, которые обладают некоторыми свойствами металлов и неметаллов (металлоиды – устаревшее название таких элементов) . При рассмотрении свойств по подгруппам сверху вниз наблюдается увеличение металлических свойств и ослабление неметаллических свойств.
16. Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая в основном идёт на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
-экзотермические реакции, которые идут с выделением тепла (положительный тепловой эффект).
-эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект).
Теплота расходуется на изменение внутренней энергии системы дельте U на совершение работы против внешних сил А.
∆Н0f, 298=[2моль*(-110,5 кДж/моль)]-[1моль*0кДж/моль +1моль*(-393,5 кДж/моль)]= 172,5 кДЖ/моль
Эндотермическая реакция.







23) Энтропия —мера беспорядка (неупорядоченности) системы, состоящей из многих элементов. Энтропия зависит от температуры и плотности. При переходе из более упорядоченного в менее упорядоченное состояние энтропия уменьшается. Возрастанием энтропии называется энтропийным фактором. Этот фактор проявляется тем сильнее, чем выше температура. Чем энтропия больше, тем металл более мягкий. Наиболее мягким является Ra.

24. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения выделяющихся газов и т.д. В 1840 г. Г. Н. Гесс формулирует закон: «Тепловой эффект химической реакции не зависит от промежуточных стадий, а зависит только от начального и конечного состояния системы». Тепловой эффект зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса , т.е. от числа и характера промежуточных стадий.Закон Гесса позволяет рассчитать тепловые эффекты или приращение энтальпии только при стандартных условиях (р = 1 атм = 105 Па, Т = 273 К + 25 = 298 К).Теплоты при стандартных условиях сведены в таблицу (справочник под редакцией Нищенко). Для индивидуальных веществ: С, Н2, Fe и др. – ?Н = 0.
25. Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами).
Моле́кула— электрически нейтральная частица, образованная из двух или более связанных ковалентными связями атомов.
Силы притяжения и отталкивания объединяют атомы в молекулы.
Основные характеристики химической связи — прочность, длина, полярность.
Основные параметры химической связи - Электронная плотность, энергия электронов.
Основные типы химической связи:
Ионная химическая связь
Ковалентная химическая связь
Металлическая химическая связь.Типы хим связи:Сигма, Пи, Дельта.
26) Ковалентная связь— химическая связь, образованная перекрытием пары валентных электронных облаков. Обеспечивающие связь электроны называются общей электронной парой.Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 год].
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах:
1. Химическая связь между двумя атомами осуществляется за счет одной или нескольких общих электронных пар.
2. При образовании общей электронной пары электронные облака перекрываются; область повышенной электронной плотности между ядрами способствует их притяжению. Чем сильнее перекрывание электронных облаков (соотношение R1 и R2), тем прочнее химическая связь.
3. При образовании общей электронной пары спины взаимодействующих электронов должны быть антипараллельны (т.к. электроны с параллельными спинами отталкиваются, и связь не образуется).
4. В образовании общих электронных пар по вышеописанному механизму могут участвовать только неспаренные электроны атомов.
Донорно-акцепторный механизм – образование ковалентной связи за счёт двухэлектронного облака одного атома(донор) и свободной орбитали другого(акцептор).
Если имеется ввиду геометрическая структура, то COCL4 - имеет 4 валентные пары, значит это тетраэдр ; PF3 имеет три пары - плоский треугольник; тоже самое с COCL2 и HF имеет линейную структуру, потому как две пары имеются.
28. Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
29. Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).







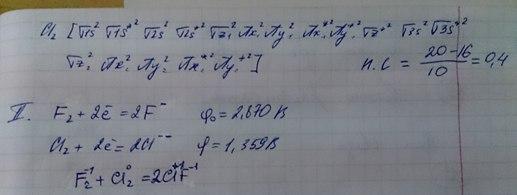
39. )Фтор имеет аномально низкую энергию связи (151 кДж/моль), это объясняется тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов.
От хлора к брому энергия связи постепенно ослабевает, что связано с увеличением атомного радиуса. 39.(дополнение) 1) Большую устойчивость молекулы cl2 по сравнению с f2 можно объяснить тем, что в f2 несвязывающие электроны отталкиваются друг от друга сильнее, чем в более крупной по размерам молекуле cl2. 2) В молекуле cl2 в отличие от f2 имеется пи-связывание, которое возникает по донорно-акцепторному механизму за счет неподеленной пары электронов одного атома и свободной 3d-орбитали другого. на картинке а-диаграмма фтора, б-диаграмма хлора(у брома такая же как у хлора, только 3 меняем на 4)








46) возрастание силы кислот происходит скорее всего из-за возрастания степени окисления хлора: у первой кислоты - хлор в степени +1, затем +3, потом +5 и соответственно +7
Ну, это мне так кажется. степень диссоциации сказать (-10)


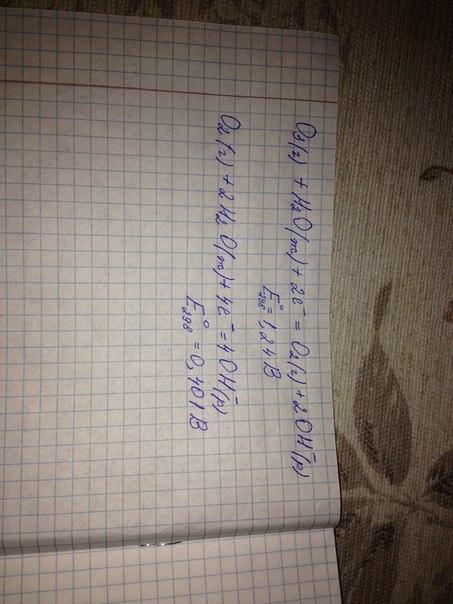
55)