
ГД
2004
Модель
сплошной среды
Модель сплошной среды
Атомно-молекулярная структура тел.
Молекулярные свойства твердого тела, жидкости и газа.
Различия жидкого и газообразного состояния.
Основная особенность газообразного состояния.
Газокинетическая и феноменологическая модель.
Физически малый объем и материальная точка. Проблема бесконечно малого.
Гипотеза сплошной среды. Континуум. Постулат Даламбера-Эйлера.
Длина свободного пробега молекул. Критерий Кнудсена.
Мы определили газовую динамику как обширную физико-математическую дисциплину, занимающую прочное место в фундаменте системы знаний о поведении сплошных легкоподвижных сред.
Поскольку объектом изучения газовой динамики является легкоподвижная или текучая сплошная среда, то имеет смысл определиться с понятием «сплошная среда» и выяснить, что представляет собой модель сплошной среды и почему «модель»?
Существует ли реально «сплошная среда» или это лишь плод нашего воображения?
Ну, конечно же
«сплошная среда» -
это чисто научная абстракция
- гипотетическая среда
- Континуум
«Гипотетическая среда» - значит основанная на какой-то гипотезе, т.е. говоря по-русски, основанная на каком-либо предположении.
В чем заключается это предположение или гипотеза?
Прежде чем мы попытаемся ответить на этот новый вопрос, а также на два других - поставленных чуть выше, но пока еще не выясненных вопроса («модель» - ? и «существуют ли реально сплошная среда»?), обратимся к известным нам из физики (и не только) сведениям о строении вещества вообще и материальных тел и сред в частности, а также опытным данным о реальных (действительных) свойствах этих тел и сред.
Всякое вещество состоит из мельчайших частиц - в большинстве случае такими частицами являются различного рода (вида) молекулы и атомы, которые находятся в постоянном хаотическом движении. В определенных условиях вещества могут быть ионизированными, т.е. состоящими из электронов, ионов (атомов и молекул с «лишним или недостающим» числом электронов) и нейтральных частиц.
Таким образом, любые физические тела, состоящие из того или иного вещества (или смеси веществ), представляют собой
«Совокупности микроскопических частиц».
Размеры этих частиц очень малы, например, диаметр атома
составляет величину порядка 10 -8 см.
Между элементарными частицами (в частности, молекулами), из которых состоят все материальные тела, имеют место определенные взаимодействия.
Материальные тела могут находиться в различных состояниях: твердом, жидком и газообразном.
Каждое из этих состояний характеризуется специфическими свойствами, которые определяются особенностями атомно-молекулярной структуры тел, непосредственно связанной с силами взаимодействия между частицами (в частности, молекулами).
В газах (особенно разряженных) взаимодействия связаны только со столкновениями частиц. В жидкостях и твердых телах существенны силовые или квантовые взаимодействия, поскольку частицы расположены достаточно близко относительно друг друга.
«В этом можно убедиться, рассматривая в общем виде силу, действующую между двумя типичными изолированными молекулами в зависимости от расстояния между ними. При малых расстояниях между центрами простых молекул d (порядка 10 -8 см) между молекулами действует интенсивная сила квантовой природы – притяжения или отталкивания, в соответствии с возможностью обмена электронными оболочками молекул. Если такой обмен возможен, то возникает сила притяжения, и она составляет основу химической связи. Если обмен невозможен, то действует сила отталкивания, которая очень быстро уменьшается с увеличением расстояния между молекулами. При бóльших расстояниях между центрами молекул, например порядка 10 –7 или 10 -6 см, между ними действует слабая сила притяжения (предполагается, что молекулы неионизированы, как это и бывает при обычных температурах). Сила притяжения уменьшается сначала как d -7 и в конце концов как d -8, когда расстояние между центрами молекул становится достаточно велико. Описанный характер зависимости обычно объясняют поляризацией одной молекулы под влиянием другой».
(Бэтчелор) с.?
Силами взаимодействия между молекулами являются силы притяжения и отталкивания, зависящие от расстояния между молекулами. График силы взаимодействия двух молекул, между которыми нет химической связи, в зависимости от расстояния d имеет вид, представленный на рисунке 1.
Если центры двух молекул отстоят друг от друга на расстоянии d = do, т.е. молекулы находятся на расстоянии так называемого «эффективного диаметра», при котором сила взаимодействия меняет знак, то сила взаимодействия между молекулами равна нулю и одна молекула по отношению к другой, очевидно, находится в положении устойчивого равновесия.
Отметим, что благодаря этой устойчивости твердые тела сохраняют объём и форму, а жидкости – только объём.
Сила взаимодействия становится силой притяжения, если d > do, и силой отталкивания, если d < do (см. рисунок 1).
В случае твердого тела расположение молекул в нём фактически не изменяется и может иметь простую периодическую структуру, как в кристалле (в твердых кристаллических телах молекулы располагаются на расстояниях порядка do и образуют кристаллическую решетку). Молекулы совершают колебания относительно своих устойчивых положений (кинетическая энергия такого колебательного движения составляет часть тепловой энергии твердого тела). Таким образом, молекулярные движения, которыми обусловлена тепловая энергия твердого тела, представляет собой неупорядоченные колебания молекул около устойчивых центров. Еще раз подчеркнем: именно благодаря этой устойчивости твердые тела сохраняют объем и форму.
Однако молекулярная решётка сохраняется только до тех пор, пока температура тела ниже точки плавления. Плотность большинства веществ при плавлении понижается всего лишь на несколько процентов (увеличение плотности при переходе льда в воду – аномальное явление), и поэтому кажется парадоксальным тот факт, что такое малое изменение расстояния между молекулами сопровождается таким резким изменением подвижности материала.
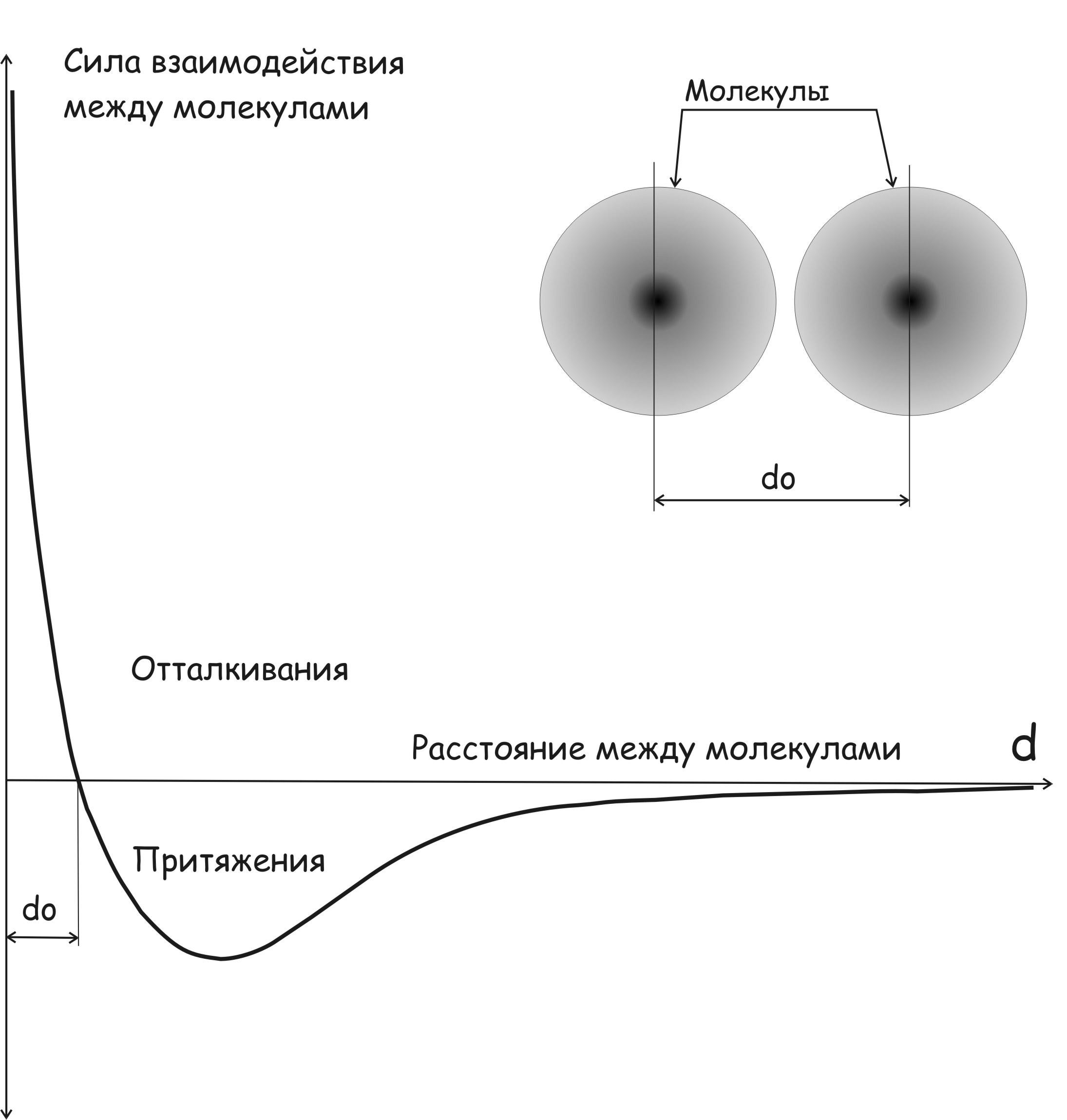
Рисунок 1 - Зависимость силы взаимодействия простых (неионизированных) молекул от расстояния между их центрами
Жидкости по молекулярному строению занимают промежуточное положение между кристаллическими твердыми телами и газами. Жидкости, как и твердые тела, устойчиво сохраняют занимаемый ими объём.
«О строении жидкостей известно значительно меньше, чем о строении твердых тел или газов. Для вывода приближенных результатов применительно к жидкостям не имеется никакой простой модели, подобной модели «совершенного газа» с динамически независимыми молекулами. Вследствие этого невозможно логически установить многие из наблюдаемых свойств жидкости или объяснить их через свойства отдельных молекул. Ещё одна помеха заключается в том, что вода, которая представляет собой частную жидкость исключительно большого практического значения, обладает многими аномальными свойствами. Поэтому сведения о жидком состоянии вещества до сих пор остаются ещё неполными».
(Бэтчелор) с.?
Считается, что молекулы жидкостей расположены практически так же плотно, как и молекулы твердых тел: молекулы жидкости настолько плотно упакованы, насколько позволяют силы отталкивания. Очевидно, что в этом случае межмолекулярные силы и потенциальная энергия молекул жидкости имеют тот же порядок, что и для твердых тел. В жидкой и твердой фазах каждая отдельная молекула находится все время под воздействием интенсивного поля сил нескольких соседних молекул. Расположение молекул в жидкости лишь отчасти упорядочено, так как группы молекул, в целом обладающие подвижностью, иногда располагаются в правильный ряд с другими группами молекул, а иногда разделяются на меньшие группы. Расположение молекул непрерывно изменяется, и вследствие этого любая сила, приложенная к жидкости (кроме силы объёмного сжатия), вызывает деформацию, которая растет до тех пор, пока действует сила.
«Характер теплового движения молекул в жидкостях более сложный, чем в твердых телах. Согласно упрощённой модели тепловые движения молекул жидкости представляют нерегулярные колебания, относительно некоторых центров. Кинетическая энергия колебаний отдельных молекул в какие-то моменты может оказаться достаточной для преодоления межмолекулярных связей. Тогда эти молекулы получают возможность скачком перейти в окружение других молекул, тем самым, поменяв центр колебаний. Таким образом, каждая молекула некоторое время, называемое «временем оседлой жизни», находится в упорядоченном строю с несколькими ближайшими молекулами. Совершив перескок, молекула жидкости оказывается среди новых молекул, выстроенных уже другим образом. Поэтому в жидкости наблюдается только ближний порядок в расположении молекул.
Скачки молекул совершаются хаотически, новое место «оседлой жизни» каждой отдельной молекулы никак не предопределено её прежним расположением. Непрерывно и в большом количестве совершающиеся скачкообразные переходы молекул с места на место обеспечивают их диффузию и текучесть жидкостей. Если на границе жидкости приложена сдвигающая (касательная к поверхности) сила, то появляется преимущественная направленность скачков и возникает течение жидкости в направлении действия силы. Для большинства жидкостей сила при этом может быть сколь угодно малой».
(Емцев) с.9
(К вопросу о реологических жидкостях!)
Однако существуют жидкости с настолько упорядоченной молекулярной структурой, что требуется некоторое усилие для осуществления сдвига. Такие жидкости называют пластичными. Если время действия сдвигающей силы мало по сравнению со «временем оседлой жизни», то направленного перемещения молекул вообще не возникает, и жидкости, подобно твердым телам, оказывают упругое сопротивление сдвигу. Если время действия сдвигающей силы больше «временем оседлой жизни» молекул, то возникают направленное движение молекул, т.е. течение жидкости, и одновременно с ним - сопротивление сдвигу, обусловленное вязкостью жидкости.
(К вопросу о вязкости!)
Вязкостью называют свойство жидкости оказывать сопротивление сдвигу, т.е. сдвиговым деформациям. Однако по определению вязкость не может помешать появлению деформации, поскольку сила сопротивления обращается в нуль вместе со скоростью деформации, т.е. вязкость проявляется только при движении жидкости. Это обстоятельство лежит в основе одного из определяющих характерных свойств (характеристик) жидкостей – легкоподвижности или текучести. Легкоподвижность или текучесть жидкостей является результатом слабых связей между их молекулами.
В газах при нормальных условиях межмолекулярные расстояния велики, а силы притяжения малы. Молекулы газов при нормальных условиях разделены пустотами с линейными размерами, значительно превышающими размер самих молекул.
В одном «кубике» (объёме в один кубический сантиметр) воздуха при температуре 0˚С и давлении в одну атмосферу содержится порядка 2,710 19 молекул
(более точное значение равно 2,68710 19 и называется числом Лошмидта, а тот факт, что оно (количество молекул) одинаково для всех газов, известен как закон Авогадро).
По закону Авогадро одинаковые объемы газов содержат при одинаковых давлениях и температурах одинаковое количество молекул.
Если бы молекулы газа были размещены в узлах кубической решётки (по типу твердого тела), расстояние между соседними молекулами было бы 3,310 -7 см.

Диаметр молекулы точно не известен,
однако для его оценки можно вполне обоснованно воспользоваться величиной
«эффективного диаметра» do,
определяемого расстоянием между центрами двух отдельных молекул, на котором сила межмолекулярного взаимодействия изменяет знак (см. рисунок 3).
Для многих простых молекул этот эффективный диаметр находится в интервале
do=(3…4)10 -8 см.
Таким образом,
средняя величина удаления молекул
друг от друга в указанном выше смысле (т.е. в воображаемой кубической решётке)
составит величину порядка 10do .
На таком расстоянии силы сцепления (притяжения) молекул, действующие между ними, столь малы, что большую часть своей жизни молекулы движутся свободно по прямым линиям с постоянной скоростью (мы предполагаем, что молекулы электрически нейтральны).
Сравнение некоторых молекулярных свойств твердого тела, жидкости и газа представлено в таблице 0.1.
Таблица 0.1
|
Вид материальной среды |
Межмолекулярные силы |
Отношение амплитуды случайного теплового движения к do |
Расположение молекул |
Тип требуемой статистики |
|
Твердое тело |
Сильные |
|
Упорядоченное |
Квантовая |
|
Жидкость |
Средние |
|
Частично упорядоченное |
Квантовая + классическая |
|
Газ |
Слабые |
|
Неупорядоченное |
Классическая |
Понятие «столкновения между двумя молекулами» точно не определено, однако если определить столкновение как событие, которое происходит всякий раз, когда одна молекула приближается к другой настолько близко, что действующая между ними сила становится отталкивающей, то можно вычислить среднее расстояние, проходимое молекулами между столкновениями, т.е.
«путь свободного пробега»
или
«длину свободного пробега»
молекул.
Эта величина равна 8,310–21 do-2 см, т.е. 710–6 см или, с учетом приведенной выше оценки для эффективного диаметра, порядка 200do.
Основная особенность газов, с которой связано большинство их характерных свойств, заключается в том, что молекулы газа находятся на большом удалении друг от друга и каждая молекула с динамической точки зрения изолирована от других молекул в течение большей части своей жизни.
Представление о газе как о скоплении молекул, движущихся почти свободно, исключая случайные столкновения, лежит в основе кинетической теории газов. В этой теории принято рассматривать свойства, так называемого, «совершенного газа», молекулы которого занимают пренебрежимо малый объём и не оказывают никакого силового воздействия друг на друга, не считая актов столкновений. Для совершенного газа потенциальная энергия молекулы, обусловленная её соседями, мала по сравнению с её кинетической энергией. В совершенном газе каждая молекула движется независимо от соседних, исключая те случаи, когда происходят их столкновения.
Частота столкновений молекул стремиться к нулю вместе с объёмом молекул, однако она (частота столкновений) играет малую роль в теории совершенного газа и достаточно лишь знать, что некоторые столкновения происходят.
Для атмосферного воздуха при обычных условиях скорость молекул можно приближенно оценить величиной порядка 350 м/с (35103 см/с). Тогда, с учетом полученной выше оценки для величины длины свободного пробега (710 –6 см), одна молекула за отрезок времени своей, протекающей в микромире, жизни, равный достаточно малой в макромире величине - всего лишь одной секунде, должна принять участие в 510 9 актах «некоторых случайных столкновений».
Из приведенных выше числовых данных кажется вполне вероятным, что при нормальных условиях реальные газы обладают свойствами, которые мало отличаются от свойств гипотетического совершенного газа, и наблюдения показывают, что это именно так. Напомним, что некоторые из эмпирических законов, открытые ранее при исследовании свойств газов, такие как закон Бойля или закон Шарля, можно вывести, исходя из молекулярно-кинетической теории, как свойства совершенного газа.
Не особо желая того, мы сейчас с вами практически обосновали другую гипотезу, а именно предположение о том, что при нормальных условиях реальные газы обладают свойствами, которые мало отличаются от свойств совершенного газа.
Но вернемся, все же к той первой гипотезе, о которой мы, собственно говоря, так ничего еще толком и не сказали. (Гипотезе сплошной среды)
В том, что молекулы газов при нормальных условиях разделены пустотами с линейными размерами, значительно превышающими размер самих молекул, мы с вами вполне убедились.
Но! Даже в жидкостях и твердых телах, в которых
молекулы «упакованы» достаточно плотно
- среднее расстояние между ними имеет порядок do,
масса сконцентрирована в ядрах атомов,
составляющих молекулы, и также распределена по объёму, занимаемому телом, дискретно,
т.е. далеко не равномерно.
Радиус ядра атома имеет величину порядка rя= 10-13 см,
радиус молекул rм 0,5do=(1,5…2)10 -8 см,
т.е. размер ядра атома намного меньше размеров молекул, но в то же время
именно в ядре сосредоточена основная масса вещества.
Для железа, например, плотность распределения массы в объёме определяется величиной ,8 г/см3, а плотность ядерного вещества составляет величину несравнимо бόльшую яв1,161014 г/см3.
Таким образом, мы видим, что объемы, занимаемые телами, независимо от их агрегатного состояния, намного больше объёмов, в которых, собственно говоря, сосредоточено само вещество.
