
- •Билет №1
- •1Вопрос: Основные термодинамические параметры состояния газа.
- •Вопрос3 Теплопроводность. Уравнение Фурье и его анализ.
- •Билет №2
- •Билет n 3
- •1 Вопрос Равновесное и неравновесное состояние термодинамической системы
- •2 Вопрос Методы расчетов и определения температуры горения
- •3 Вопрос Свободная и вынужденная конвекция жидкости. Основной закон конвективного теплообмена.
- •Билет n4
- •Билет n5
- •Основные критерии подобия,изпользуемые при тепловых расчетах
- •Билет n6
Билет №1
1Вопрос: Основные термодинамические параметры состояния газа.
Давление Р – мера силы, которая действует на единицу поверхности: Р = lim ∆Fn / ∆S = dFn/ dS, где DS → 0; ∆Fn – сила, направленная перпендикулярно участку поверхности. Удельный объем V – величина, обратная плотности rвещества: v = 1 / r= dV/ dm, где dV– бесконечно малый элемент объема; dm– масса вещества. Моль Количество вещества, которое содержит число молекул, равное числу атомов, содержащихся в 12 г изотопа углерода 12С, называется молем. Число Авогадро NA= 6,02 ч 1023 моль-1. Величина, необходимая при расчетах. Показывает, сколько молекул содержится в одном моле любого вещества. Молярная масса М – масса одного моля: М = NAm × 1а. е. м, где NA– число Авогадро; m– молекулярная масса. Молярная масса [M] = кг/моль и молярный объем [VM] = м3/моль. Объем одного моля – молярный объем: VM = M / r где M– молярная масса; r– плотность вещества. Формулы для определения числа молей вещества и числа молекул вещества имеют следующий вид: u= m /M= V/ VM, N = uNA= (m / M)NA = (V/ VM)NA. Температура За меру температуры принято брать среднюю кинетическую энергию поступательного движения молекул. Если два тела при соприкосновении не обмениваются энергией путем теплообмена, можно говорить, что эти тела имеют одинаковую температуру и в системе существует тепловое равновесие.
2вопрос: Материальный баланс процесса горения: Для расчета процессов горения твердого и жидкого топлива составляют материальный баланс процесса горения.
Материальный баланс процесса горения выражает количественные соотношения между исходными веществами (топливо, воздух) и конечными продуктами (дымовые газы, зола, шлак) При сжигании твердого и жидкого топлива горючие вещества могут окисляться с образованием оксидов различной степени окисления. Стехиометрические уравнения реакций горения углерода, водорода и серы можно записать так:
а) С+О2=СО2;
б) С+(1/2)·О2=СО;
в) S+О2=SО2;
г) H2+(1/2)·О2=H2О;
При расчете объемов воздуха и продуктов сгорания условно принимают, что все горючие вещества окисляются полностью с образованием только оксидов с наивысшей степенью окисления (реакции а, в, г).
Из уравнения (а)следует, что для полного окисления 1 кмоль углерода (12 кг) расходуется 1 кмоль, т. е. 22,4 м3, кислорода и образуется 1 кмоль (22,4 м3) оксида углерода. Соответственно для 1 кг углерода потребуется 22,4/12 = 1,866 м3 кислорода и образуется 1,866 м3 СО2. В 1 кг топлива содержится Сp/100 кг углерода. Для его горения необходимо 1,866·Сp/100 м3 кислорода и при сгорании образуется 1,866 Сp/100 м3 CO2.
Аналогично из уравнений
(в) и (г)на окисление горючей серы
(μs = 32), содержащейся в 1 кг топлива,
потребуется (22,4/32) Spл/100 м3 кислорода
и образуется такой же объем SO2. А на
окисление водорода (![]() ),
содержащегося в 1 кг топлива, потребуется
0,5·(22,4/2,02) Нp/100 м3 кислорода и образуется
(22,4/2,02) Нp/100 м3 водяного пара.
),
содержащегося в 1 кг топлива, потребуется
0,5·(22,4/2,02) Нp/100 м3 кислорода и образуется
(22,4/2,02) Нp/100 м3 водяного пара.
Суммируя полученные выражения и учитывая
кислород, находящийся в топливе(![]() ),после
несложных преобразований получим
формулу для определения количества
кислорода, теоретически необходимого
для полного сжигания 1 кг твердого или
жидкого топлива, м3/кг:
),после
несложных преобразований получим
формулу для определения количества
кислорода, теоретически необходимого
для полного сжигания 1 кг твердого или
жидкого топлива, м3/кг:
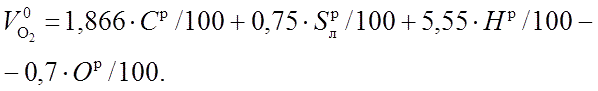
В воздухе содержится кислорода примерно 21 % по объему, поэтому количество воздуха, теоретически необходимое для полного сжигания 1 кг топлива V0, м3/кг, составляет:

В процессе полного горения с теоретически необходимым количеством воздуха образуются газообразные продукты, которые состоят из CO2, SO2, N2 и H2O - оксиды углерода и серы являются сухими трехатомными газами. Их принято объединять и обозначать через RO2 = CO2 + SO2.
