
- •Глава 8. Окислительно-восстановительные и электрохимические процессы
- •8.1. Окислительно-восстановительные реакции
- •Раздел I.
- •Раздел II
- •8.1.3. Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Экспериментальная часть
- •8.2. Электродные процессы
- •3) Хлорный электрод.
- •Раздел I
- •Раздел II
- •8.3. Электрохимические системы
- •8.3.1.Химические источники тока.
- •8.3.1.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.1.2. Задания для текущих и промежуточных контролей.
- •8.3.2. Электролиз
- •8.3.2.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.2.2. Задания для текущих и промежуточных контролей.
- •8.3.3.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.3.2. Лабораторная работа №6
- •Теоретическое введение
- •Задания на ргр 3. Срок-15 мая 2014.
- •Задания на ргр 3. Срок-15 мая 2014.
3) Хлорный электрод.
Устройство хлорного электрода аналогично устройству водородного электрода с той разницей, что в качестве электролита используется раствор соляной кислоты, в который подаётся ток газообразного хлора. Процесс описывается реакцией
1/2Cl2 + e → Cl-
Электродный потенциал при стандартном парциальном давлении хлора может быть найден по формуле
![]() (8.10)
(8.10)
Пример 8.4. Вычислить электродный потенциал системы Cu |CuSO4(0,01M) при температуре 25 С.
Решение. Вычисление электродного потенциала производим по уравнению Нернста
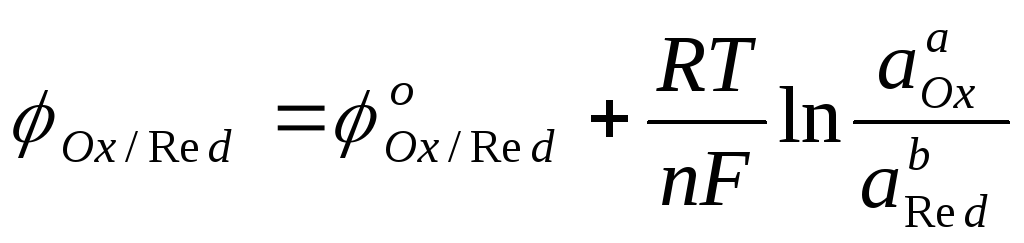 ,
,
которое для данной системы запишется следующим образом:
![]()
Различиями между активной и аналитической концентрациями пренебрегаем и используем аналитическую концентрацию ионов меди.
Стандартный электродный потенциал меди
![]() .
.
Отсюда
![]() .
.
Пример 8.5. Вычислить электродный потенциал системы Fe FeSO4(0,1 M) при 25С, если степень диссоциации сульфата железа равна 60 %.
Решение. Для того чтобы найти электродный потенциал указанной системы, определяем концентрацию ионов Fe2+ в 0,1 М FeSO4:
Сион = Сэлектрn,
где Сэлектр – молярная концентрация электролита; n – число ионов данного вида; – степень диссоциации электролита.
![]()
По уравнению Нернста находим
![]()
Стандартный электродный потенциал железа равен –0,44 В. Тогда
![]() .
.
Пример 8.6. Вычислить активность ионов Н+ в растворе, в котором потенциал водородного электрода равен –82 мВ.
Решение.
Из уравнения (8.5)
![]() находим
находим
![]() .
.
Следовательно,
![]() ,
отсюда
,
отсюда
![]() .
.
Пример 8.7. Определить активность ионов хлора в растворе, в котором электродный потенциал хлорного электрода при 25С равен 1,3 В. Стандартный потенциал хлорного электрода 1,36 В.
Решение. Для хлорного электрода уравнение Нернста имеет вид
![]()
Парциальное
давление хлора
![]() считаем
равным 1. Тогда
считаем
равным 1. Тогда
![]()
![]()
Откуда
![]() .
.
Пример 8.8.
Гальванический
элемент состоит из металлического
цинка, погруженного в 0,1 М раствор
нитрата цинка, и металлического свинца,
погруженного в 0,02 М раствор нитрата
свинца. Вычислить ЭДС элемента, написать
уравнения электродных процессов,
составить схему элемента.
![]() ;
;![]() .
.
Решение. Чтобы определить ЭДС элемента, вычисляем электродные потенциалы по уравнению Нернста:
![]() ;
;
![]() .
.
Находим ЭДС элемента:
![]()
Поскольку
![]() ,
то на свинцовом электроде будет
происходить восстановление:
,
то на свинцовом электроде будет
происходить восстановление:
Pb2+ + 2e- = Pb,
т. е. он будет служить катодом. На цинковом электроде будет протекать процесс окисления:
Zn = Zn2+ + 2e-,
т.е. этот электрод будет анодом.
Схема рассматриваемого гальванического элемента имеет следующий вид:
(-) Zn Zn(NO3)2 (0,1 M) Pb(NO3)2 (0,02 M) Pb (+).
Пример 8.9. Какова ЭДС гальванического элемента, состоящего из водородного и кислородного электродов, в растворе с рН=4 при 25С?
Решение. Уравнение реакции, протекающей на кислородном электроде, со стандартным давлением кислорода в кислой среде запишем в виде
О2
+ 4Н+
+ 4е-
2Н2О,
![]() .
.
Потенциал кислородного электрода
![]()
Потенциал водородного электрода со стандартным давлением водорода находится по уравнению
![]()
Поскольку
![]() ,
то кислородный электрод будет служить
катодом, а водородный электрод – анодом.
Тогда
,
то кислородный электрод будет служить
катодом, а водородный электрод – анодом.
Тогда
ε = φк –φа = 0,991 – (-0,236) = 1,227 В.
Кинетика электродных процессов. Электрохимическая поляризация. Уравнение Нернста описывает равновесные электродные процессы, т.е. процессы, протекающие в отсутствие электрического тока. Прохождение электрического тока является неравновесным процессом. Эти процессы изучает раздел электрохимии, называемый кинетикой электродных (или электрохимических) процессов.
Прохождение тока вызывает изменение потенциала электрода. Это явление, а также величина изменения потенциала называются электрохимической поляризацией:
ΔЕ = Еi - Ep , (8.11)
где ΔЕ – поляризация; Еi – неравновесный потенциал электрода, т.е. потенциал при прохождении электрического тока; Ep – равновесный потенциал.
Изменение потенциала электрода также называют перенапряжением.
Поляризация имеет место, как на катоде, так и на аноде, поэтому различают катодную (ΔЕк) и анодную (ΔЕа) поляризации. Катодная поляризация всегда отрицательна, а анодная – всегда положительна.
П оляризация
определяется из экспериментально
получаемой зависимости потенциала
электрода от плотности тока, т.е. отношения
токаI
к площади электрода S
(i=I/S).
График зависимости потенциала от
плотности тока носит название
поляризационной
кривой (рис.8.3).
Из кривой следует, что величина поляризации
зависит от плотности тока.
На поляризацию
влияет также материал электрода,
состояние его поверхности и целый ряд
других факторов.
Возникновение
поляризации может быть понято из
рассмотрения механизма протекания
электродных процессов. Электродный
процесс состоит из трех основных стадий:
1) подвод реагирующих веществ к электроду;
2) процесс электрохимического превращения
на поверхности электрода, который может
сопровождаться дополнительными
химическими реакциями; 3) отвод
продуктов реакции от электрода. Эти
процессы протекают последовательно и
имеют обычно различные скорости. Скорость
наиболее медленной (лимитирующей) стадии
определяет общую скорость процесса.
Ускорение лимитирующей стадии
достигается повышением потенциала
электрода, т.е. поляризацией. В зависимости
от того, какая стадия является лимитирующей,
различают концентрационную
и электрохимическую
поляризацию.
оляризация
определяется из экспериментально
получаемой зависимости потенциала
электрода от плотности тока, т.е. отношения
токаI
к площади электрода S
(i=I/S).
График зависимости потенциала от
плотности тока носит название
поляризационной
кривой (рис.8.3).
Из кривой следует, что величина поляризации
зависит от плотности тока.
На поляризацию
влияет также материал электрода,
состояние его поверхности и целый ряд
других факторов.
Возникновение
поляризации может быть понято из
рассмотрения механизма протекания
электродных процессов. Электродный
процесс состоит из трех основных стадий:
1) подвод реагирующих веществ к электроду;
2) процесс электрохимического превращения
на поверхности электрода, который может
сопровождаться дополнительными
химическими реакциями; 3) отвод
продуктов реакции от электрода. Эти
процессы протекают последовательно и
имеют обычно различные скорости. Скорость
наиболее медленной (лимитирующей) стадии
определяет общую скорость процесса.
Ускорение лимитирующей стадии
достигается повышением потенциала
электрода, т.е. поляризацией. В зависимости
от того, какая стадия является лимитирующей,
различают концентрационную
и электрохимическую
поляризацию.
Концентрационная поляризация обусловлена замедленным переносом исходных веществ или конечных продуктов реакций, протекающих на электроде. В результате концентрации исходных веществ в зоне реакции понижаются, а конечных – повышаются. Это смещает равновесие в сторону обратной реакции. Приложение дополнительной разности потенциалов (поляризация) увеличивает скорость переноса компонентов и компенсирует нежелательные процессы. Концентрационная поляризация уменьшается при перемешивании раствора, т.к. это ускоряет выравнивание концентраций компонентов на поверхности электродов.
Электрохимическая поляризация (перенапряжение) обусловлена пониженной скоростью электрохимических реакций на электроде. Согласно современным представлениям наиболее медленной стадией электрохимического процесса является процесс разряда ионов. Это связано с тем, что разряд ионов, как и любая химическая реакция, требует значительной энергии активации и по этой причине скорость процесса может быть мала.
Скорость электрохимических реакций можно увеличить нагреванием и использованием катализатора, а также повышением потенциала электрода по сравнению с его равновесным значением, т.е. при поляризации. Роль поляризации сводится к уменьшению энергии активации, и величина этого снижения пропорциональна величине поляризации. Уменьшение энергии активации сопровождается увеличением скорости реакции, что в случае электрохимических процессов ведет к увеличению плотности тока. Между плотностью тока (i) и электрохимическим перенапряжением (ΔЕэл) существует взаимосвязь, выражаемая уравнением Тафеля
ΔЕэл = a + blgi , (8.12)
где a и b – константы, определяемые опытным путем. Константа а зависит от природы реакции, материала электрода, состава раствора и температуры. Константа b зависит от природы реакции и температуры.
Численные значения констант уравнения Тафеля можно найти в справочных изданиях.
Электрохимическое перенапряжение может быть снижено использованием соответствующих материалов для электродов, а также проведением процессов при повышенных температурах и концентрациях растворов. Использование электродов большой площади снижает плотность тока и также ведет к уменьшению перенапряжения.
8.2.1. Вопросы и задачи для самостоятельной подготовки
1. Опишите механизм возникновения электродного потенциала.
2. Приведите схему стандартного водородного электрода. Опишите его устройство.
3. Запишите
выражение уравнения Нернста для процесса:
![]()
4. Определите, какое вещество является более сильным восстановителем:
1) Mg
или Al
(![]() ;
;
![]()
2) H2S
или Н2
![]()
![]()
3) Ni
или Н2О2
![]() ;
;
![]()
5. Определите, какое из веществ является более сильным окислителем:
1) N2
или Fe3+
![]()
![]()
2) Ti3+
или Fe3+
![]()
![]()
3) Cl2
или HClO
![]()
6. Может ли BrO-
окислить I-?
![]()
![]()
7. Может ли HBrO
окислить Ag?
![]()
![]()
8. Может ли
![]() окислить I-?
окислить I-?
![]()
![]()
9. Может ли PbO2
окислить Cl-?
![]()
![]()
10. Может ли
![]() окислить Fe2+?
окислить Fe2+?
![]()
![]()
11. Вычислите
электродный потенциал системы Ni|NiSO4
(0,02M)
при стандартной температуре.
![]()
Ответ: -0,286 В.
12. Вычислите электродный потенциал кислородного электрода в растворе с рОН=4 при стандартной температуре.
Ответ: 0,64 В.
13. Потенциал водородного электрода составляет 0,236 В. Вычислите активность ионов водорода в растворе.
Ответ:1.10-4М.
14. Вычислите электродный потенциал системы Cu CuSO4(0,1 M) при 25С, если степень диссоциации сульфата меди равна 50 %.
Ответ: 0,278 В.
15. Вычислите
электродный потенциал системы
Pt|
Fe3+(0,005M),
Fe2+(0,1M).
![]()
Ответ :0,847 В.
8.2.2. Задания для текущих и промежуточных контролей.
