
- •Глава 8. Окислительно-восстановительные и электрохимические процессы
- •8.1. Окислительно-восстановительные реакции
- •Раздел I.
- •Раздел II
- •8.1.3. Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Экспериментальная часть
- •8.2. Электродные процессы
- •3) Хлорный электрод.
- •Раздел I
- •Раздел II
- •8.3. Электрохимические системы
- •8.3.1.Химические источники тока.
- •8.3.1.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.1.2. Задания для текущих и промежуточных контролей.
- •8.3.2. Электролиз
- •8.3.2.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.2.2. Задания для текущих и промежуточных контролей.
- •8.3.3.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.3.2. Лабораторная работа №6
- •Теоретическое введение
- •Задания на ргр 3. Срок-15 мая 2014.
- •Задания на ргр 3. Срок-15 мая 2014.
8.3.3.1. Вопросы и задачи для самостоятельной подготовки
1. Опишите механизм электрохимической коррозии железа.
2. Объясните, почему используемая в теплоэнергетике в качестве теплоносителя и рабочего тела вода должна содержать минимальное количество растворённого кислорода?
3. Объясните, почему используемая в теплоэнергетике в качестве теплоносителя и рабочего тела вода должна содержать минимальное количество растворённого углекислого газа?
4.. Питательная
вода котлов должна иметь
![]() Как повлияет на коррозию оборудования
отклонения от нормативных значений рН?
Как повлияет на коррозию оборудования
отклонения от нормативных значений рН?
5. Для уменьшения коррозии в теплоноситель (вода) вводят аммиак. Объясните влияние добавки на скорость коррозии оборудования.
6. Для уменьшения коррозии в теплоноситель (вода) вводят гидразин (N2H4). Объясните влияние добавки на скорость коррозии оборудования.
8.3.3.2. Лабораторная работа №6
Коррозия и защита металлов
Цель работы: ознакомление с процессами, протекающими при электрохимической коррозии металлов, и методами защиты от неё.
Теоретическое введение
Привести определение коррозии, механизм электрохимической коррозии, факторы влияющие на протекание коррозии, методы защиты металлов от коррозии.
Экспериментальная часть
Опыт 1. Влияние образования гальванической пары на процесс растворения металла в кислоте.
Поместите кусочек цинка в пробирку, добавьте несколько миллилитров 0,005М раствора Н2SO4. Отметьте скорость образования газа. Добавьте в пробирку несколько капель 0,5М раствора сульфата меди. Отметьте увеличение скорости образования газа.
Какой газ выделяется при взаимодействии цинка с разбавленной серной кислотой. Объясните причину увеличения скорости образования газа. Напишите уравнения реакции взаимодействия цинка с серной кислотой и схемы электрохимических процессов, протекающих в растворе при добавлении сульфата меди.
Опыт 2. Коррозия в результате неравномерного доступа кислорода.
Очистите стальную пластину наждачной бумагой и промойте водопроводной водой. Нанесите на поверхность пластины большую каплю раствора, состоящего из 3 %-ого раствора КСl и гексацианоферрата (III) калия K3[Fe(CN)6] (красная кровяная соль) и раствора фенолфталеина. Через 5-7 минут наблюдайте появление в центре капли синего окрашивания гексацианоферррата(III) железа(II) Fe3[Fe(CN)6]2 (турнбулева синь) и розовой окраски по краям капли.
Объясните причину образования гальванопары на поверхности пластины. Составьте схему действия гальванопары.
Чем объясняется появление ионов Fe2+ в растворе, ведущего к образованию синего окрашивания Fe3[Fe(CN)6]2 в центре капли?
Розовая окраска фенолфталеина по краям капли свидетельствует о щелочной реакции раствора. Сделайте вывод о катодном процессе, протекающем по краям капли.
Опыт 3. Активирующие действия иона хлора на коррозию.
В две пробирки поместите по кусочку алюминия, добавьте 5%-ный раствор СuSO4 и каплю 0,5 н серной кислоты. В одну из пробирок добавьте несколько капель раствора NaCl.
Объясните, почему в пробирке без NaCl реакция не протекает.
Напишите уравнения реакций протекающих в пробирке с NaCl.
Опыт 4. Катодная защита.
а) Коррозия металлов в отсутствии катодной защиты.
Очистите стальную пластину наждачной бумагой и промойте водопроводной водой. Нанесите на поверхность пластины большую каплю раствора, состоящего из 3 %-ого раствора КСl и гексацианоферрата (III) калия K3[Fe(CN)6] (красная кровяная соль). Через 5-7 минут наблюдайте появление в центре капли синего окрашивания гексацианоферррата(III) железа(II) Fe3[Fe(CN)6]2 (турнбулева синь).
 Чем
объясняется образование турнбулевой
сини?
Составьте
схему действия гальванопары.
Чем
объясняется образование турнбулевой
сини?
Составьте
схему действия гальванопары.
б) Коррозия железа в присутствии катодной защиты.
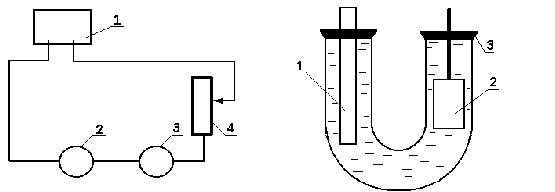
а б Рис.8.7. Схема установки (а) и сосуда (б) для проведения катодной защиты:
а) 1-выпрямитель, 2-сосуд с раствором NaCl, 3-амперметр, 4-реостат,
б) 1-угольный стержень, 2-стальная пластинка, 3-изолирующая крышка.
Соберите установку для проведения катодной защиты (рис.8.7). Сосуд заполните раствором, состоящим из 3%-ного раствора NaCl с добавленной красной кровяной солью K3[Fe(CN)6]. Угольный стержень закрепите в крышке сосуда. На полоску фильтрованной бумаги, смоченной фенолфталеином, нанесите каплю раствора NaCl и подведите к ней концы проводов от вилки, включенной в сеть. Наблюдайте за появлением красного окрашивания капли у одного из концов проводов (катод). Подсоедините данный конец провода (катод) к стальной пластине, а другой – к угольному стержню. Погрузите стальную пластинку на 3/4 высоты в свободное колено сосуда в раствор и при помощи реостата установите ток в системе силой 30-50 mA. Наблюдайте за процессами, протекающими на электродах. Через 7-10 мин после начала опыта выключите ток и быстро извлеките стальную пластину из раствора. Содержимое сосуда перелейте в склянку. Ополосните сосуд дистиллированной водой и разберите схему.
Объясните появление красного окрашивания капли у одного из концов проводов. Напишите уравнения реакций.
Напишите уравнения реакций, протекающих при катодной защите на катоде и аноде.
Подвергается ли стальная пластина коррозии в этом случае?
Выводы.
