
- •Глава 8. Окислительно-восстановительные и электрохимические процессы
- •8.1. Окислительно-восстановительные реакции
- •Раздел I.
- •Раздел II
- •8.1.3. Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Экспериментальная часть
- •8.2. Электродные процессы
- •3) Хлорный электрод.
- •Раздел I
- •Раздел II
- •8.3. Электрохимические системы
- •8.3.1.Химические источники тока.
- •8.3.1.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.1.2. Задания для текущих и промежуточных контролей.
- •8.3.2. Электролиз
- •8.3.2.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.2.2. Задания для текущих и промежуточных контролей.
- •8.3.3.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.3.2. Лабораторная работа №6
- •Теоретическое введение
- •Задания на ргр 3. Срок-15 мая 2014.
- •Задания на ргр 3. Срок-15 мая 2014.
Глава 8. Окислительно-восстановительные и электрохимические процессы
8.1. Окислительно-восстановительные реакции
Рабочая программа Сущность процесса окисления - восстановления. Окислители, восстановители, окислители-восстановители. Типы окислительно-восстановительных реакций. Степень окисления.
Составление уравнений окислительно-восстановитель-ных реакций методом электронно-ионных полуреакций. Влияние среды на процесс окисления-восстановления. Количественные характеристики окислителей и восстановителей: число эквивалентности, молярная масса эквивалента.
Окислительно-восстановительные процессы связаны с переносом электронов от одних частиц к другим. Процессы, сопровождающиеся изменением степеней окисления реагирующих частиц, называют окислительно-восстановитель-ными реакциями. Эти реакции могут быть использованы для получения электрического тока. Равным образом процессы окисления и восстановления могут протекать под действием электрического тока. В этих двух случаях окислительно-восстановительные реакции относят к электрохимическим процессам.
В окислительно-восстановительной реакции
Zn + CuSO4 = ZnSO4 + Cu
атом цинка отдает два электрона:
Zn -2e → Zn2+,
а ион меди принимает два электрона:
Cu2+ + 2e → Cu.
Процесс потери электронов называют окислением, а вещество, отдающее электроны, является восстановителем; цинк является восстановителем, он окисляется. Процесс принятия электронов называют восстановлением, а вещество, принимающее электроны, является окислителем; ион меди Cu2+ является окислителем, он восстанавливается. Основные группы простых веществ и соединений, относящихся к восстановителям, окислителям или окислителям-восстановителям, были приведены в главе 1. (разд. 1.12.).
Процессы окисления и восстановления протекают одновременно; окисление одного вещества всегда связано с восстановлением другого.
Степень окисления. Под степенью окисления или окислительным числом понимают условный заряд, который приобрел бы атом, если бы все общие электроны, образующие химическую связь, целиком принадлежали более электроотрицательному атому. Хотя эта характеристика весьма условна, но очень полезна при составлении уравнений окислительно-восстановительных реакций и для классификации неорганических и комплексных соединений. Правила определения степени окисления элементов в соединениях изложены в главе 1. (разд. 1.12.).
Окислительно-восстановительные реакции подразделяются на три типа.
Межмолекулярные реакции. Окислитель и восстановитель – это два разных вещества. Реакции этого типа наиболее многочисленны. Например:
SO2 + 2HNO3 = H2SO4 + NO2.
Оксид серы (IV) является восстановителем, а азотная кислота– окислителем.
2. Внутримолекулярные реакции. Окислитель и восстановитель – это два различных элемента или один и тот же элемент, но в различных степенях окисления, входящих в состав одного и того же вещества. Например:
2HgO = 2Hg + O2.
Ион Hg2+ является окислителем, а О2- - восстановителем.
NH4NO2 = N2 + 2H2O.
Аммиачный азот в степени окисления 3- является восстановителем, а нитритный азот в степени окисления 3+ - окислителем.
3. Реакции диспропорционирования (дисмутации, самоокисления-самовосстановления). Один и тот же элемент, входящий в состав одного и того же вещества является одновременно и окислителем и восстановителем. Например:
3AuF = AuF3 + 2 Au.
Ион Au+ является восстановителем, окисляясь до Au3+ и окислителем, восстанавливаясь до свободного золота.
3S + 6NaOH = 2Na2S + Na2SO3 + 3H2O.
Свободная сера принимая два электрона восстанавливается до сульфид-иона и отдавая четыре электрона окисляется с образованием сульфит-иона.
Составление уравнений окислительно-восстанови-тельных реакций. Составление уравнений окислительно-восстановительных реакций основано на том, что число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Существует два основных метода составления уравнений окислительно-восстановительных реакций: 1) метод электронного баланса (рассмотрен в главе 1. (разд. 1.12.)); 2) метод электронно-ионных полуреакций.
Метод электронно-ионных полуреакций является более удобным, т.к. позволяет избежать недостатков, присущих методу электронного баланса. Среди них: 1) использование при уравнивании частиц реально не существующих (Сr6+, Mn7+ и др.); 2) необходимость определения численного значения степени окисления, что в ряде случаев затруднительно (KO3, Na2S5 и др.); 3) невозможность учесть влияние среды на протекание реакции, что часто определяет продукты реакции и даже направление ее протекания. Кроме того, электронно-ионные полуреакции используются для расчёта восстановительных потенциалов электродов по уравнению Нернста (8.2).
Составление уравнений окислительно-восстановитель-ных реакций осуществляется в несколько стадий:
1) составление молекулярной схемы реакции, содержащей все исходные и конечные продукты;
2) составление ионной схемы реакции в соответствии с правилами записи ионных уравнений, т.е. сильные электролиты записывают в виде ионов, слабые электролиты, осадки, газы – в виде молекул; в схему включают частицы, характеризующие среду (Н2О, Н+, ОН‾), и не включают частицы, состояние которых в ходе реакции не изменяется;
3) составление электронно-ионных схем отдельно для процесса окисления восстановителя и восстановления окислителя, при этом руководствуются следующими правилами:
а) если конечный продукт содержит больше кислорода, чем начальный, то в нейтральных и кислых растворах расходуется вода по схеме
Н2О → 2Н+ + О2- ,
а в щелочных растворах – гидроксид-ион:
2ОН- → Н2О + О2- ;
б) если конечный продукт содержит меньше кислорода, чем исходный, то его избыток связывается в кислых растворах ионами водорода:
2Н+ + О2- → Н2О,
а в нейтральных и щелочных растворах – молекулами воды:
О2- + Н2О →2ОН‾.
Число атомов каждого элемента в левой и правой частях схемы должно быть одинаковым;
4) определение числа отданных или принятых электронов, с учетом того, что сумма зарядов левой и правой частей схемы должна быть одинаковой;
5) определение коэффициентов для окислителя и восстановителя на основе того, что число отданных электронов должно быть равно числу принятых электронов; эти коэффициенты называют фиксированными, т.к. при дальнейшем уравнивании они не изменяются или изменяются одновременно в одно и то же число раз;
6) составление ионного уравнения реакции умножением электронно-ионных полуреакций на фиксированные коэффициенты с их почленным сложением и приведением подобных членов;
7) составление молекулярного уравнения на основе ионного; на этом этапе иногда приходится учитывать помимо основной окислительно-восстановительной реакции и реакции ионного обмена;
8) проверка правильности уравнения по балансу атомов.
Пример 8.1. Составить уравнение реакции взаимодействия перманганата калия с сульфитом калия в кислой среде методом электронно-ионных полуреакций.
Решение.
Составим молекулярную схему реакции:
KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O.
2) Составим сокращенную ионную схему реакции:
![]()
Ионы калия и сульфат-ионы в схему не включены, т.к. их состояние в ходе реакции не изменяется. Одновременно сульфат-ионы присутствуют среди продуктов реакции, т.к. они являются результатом превращения сульфит-ионов. Ионы водорода и молекулы воды включены в схему, т.к. они характеризуют среду.
3) Составим электронно-ионные схемы для процессов окисления и восстановления:
![]()
4) Определим число отданных и принятых электронов. Суммарный заряд ионов левой части схемы превращения перманганат-иона равен (1-)+(8+)=7+, а правой – (2+); следовательно, заряд левой части должен быть уменьшен на пять единиц, что эквивалентно добавлению пяти отрицательных зарядов, т.е. зарядов пяти электронов. Суммарный заряд ионов левой части схемы превращения сульфит-иона равен (2-), а правой – 0, (2-)+(2+)=0; следовательно, заряд левой части должен быть увеличен на две единицы, что эквивалентно вычитанию двух отрицательных зарядов, т.е. зарядов двух электронов. В результате суммы зарядов левых и правых частей будут уравнены. Схемы приобретут следующий вид:
![]()
Из полученных уравнений видно, что перманганат-ион принимает электроны, следовательно, он является окислителем и восстанавливается, а сульфит-ион отдает электроны, значит, он играет роль восстановителя и окисляется.
5) Для того чтобы уравнять число отданных и принятых электронов, необходимо принять следующие фиксированные коэффициенты: пять для восстановителя и два для окислителя. Схемы запишутся следующим образом:
![]() |2,
|2,
![]() |5.
|5.
Схема означает, что два перманганат иона примут 2*5=10 электронов, а пять сульфит-ионов отдадут 5*2=10 электронов.
Разумеется, что в процессе уравнивания нет необходимости переписывать схему трижды – в данном случае это сделано для наглядности.
6) Составим полное ионное уравнение реакции:
![]()
Приведем подобные члены:
![]()
7) Составим молекулярное уравнение:
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O.
Проверку проводят обычно по кислороду. Число атомов кислорода в левой и правой частях уравнения равно 35, следовательно, уравнение составлено верно.
В случае окислительно-восстановительных реакций эквивалентом окислителя или восстановителя называется реальная или условная частица, которая может присоединить или отдать один электрон в реакции восстановления или окисления соответственно. Число эквивалентности, соответственно, равно числу электронов, принятых или отданных одной формульной единицей окислителя или восстановителя.
Для количественной характеристики окислительно-восстановительных процессов используют, в частности, молярную массу эквивалентов окислителя и восстановителя, определяемую по формуле, аналогичной соотношению (2.5); она равна частному от деления молярной массы окислителя или восстановителя на число эквивалентности, т.е. число электронов, принятых или отданных одной формульной единицей вещества:
![]() ,
(8.1)
,
(8.1)
где zB – число эквивалентности окислителя или восстановителя.
Для перманганата калия в выше приведённой реакции число эквивалентности равно 5, а молярная масса эквивалентов составляет
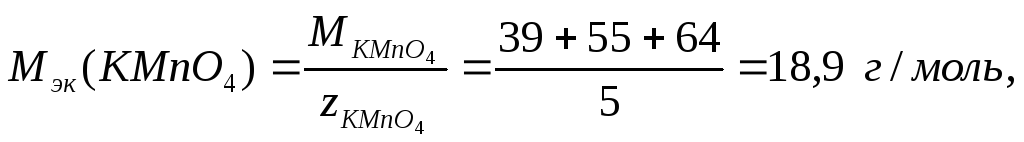
а для сульфита калия –

8.1.1. Вопросы и задания для самостоятельной подготовки
1. Дайте определения процессов окисления и восстановления.
2. Какие вещества называют окислителями и восстановителями?
3.Укажите степень окисления водорода в соединениях CaH2, KH, NaAlH4.
4.Какие частицы могут выполнять только восстановительную функцию: а) РО43-; б) Cr3+; в) Cr2O72-; г) S2-?
5. Какие частицы могут выполнять только окислительную функцию: а) SО43-; б) Au3+; в) Cr2O72-; г) Cl-?
6. Какие частицы могут быть и окислителями и восстановителями: а) SО33-; б) Fe3+; в) CrO42-; г) ClO -?
7. Уравняйте окислительно-восстановительные реакции методом электронно-ионных полуреакций, найдите молярную массу эквивалента окислителя и восстановителя:
а) KMnO4 + KNO2+ H2SO4 → MnSO4 +KNO3+K2SO4+H2O
б) KMnO4+К2С2О4+КОН→ K2MnO4+ K2CO3+ H2O;
в) KMnO4 + KNO2+H2O→KNO3+MnO2+KOH;
г)K2Cr2O7+FeSO4+H2SO4→Fe2(SO4)3+Cr2(SO4)3+K2SO4+ +H2O;
д) СrCl3+NaClO+NaOH→Na2CrO4+NaCl+H2O;
е) K2Cr2O7+K2SO3+H2SO4→ Cr2(SO4)3+K2SO4+H2O;
ж) K2MnO4+Cl2→KMnO4 + KCl;
з) KMnO4 +HCl→KCl+MnCl2+H2O;
и)KI+KIO3+ H2SO4 →I2+K2SO4+H2O;
к)I2+NaOH→ NaI+NaIO3+H2O;
л)Сu+HNO3(разб) →Сu(NO3)2+NO+ H2O;
м)Zn+NaOH+ H2O →Na2[Zn(OH)4]+H2;
н)As2S3+ HNO3+H2O→H3AsO4+ H2SO4+NO;
o) KMnO4 + C6H12O6+ H2SO4 → MnSO4 + CO2+K2SO4+H2O.
8.1.2. Задания для текущих и промежуточных контролей.
