
- •Глава 8. Окислительно-восстановительные и электрохимические процессы
- •8.1. Окислительно-восстановительные реакции
- •Раздел I.
- •Раздел II
- •8.1.3. Лабораторная работа № 5 Окислительно-восстановительные реакции
- •Экспериментальная часть
- •8.2. Электродные процессы
- •3) Хлорный электрод.
- •Раздел I
- •Раздел II
- •8.3. Электрохимические системы
- •8.3.1.Химические источники тока.
- •8.3.1.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.1.2. Задания для текущих и промежуточных контролей.
- •8.3.2. Электролиз
- •8.3.2.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.2.2. Задания для текущих и промежуточных контролей.
- •8.3.3.1. Вопросы и задачи для самостоятельной подготовки
- •8.3.3.2. Лабораторная работа №6
- •Теоретическое введение
- •Задания на ргр 3. Срок-15 мая 2014.
- •Задания на ргр 3. Срок-15 мая 2014.
8.2. Электродные процессы
Рабочая программа. Электродные процессы. Равновесие металл – раствор. Двойной электрический слой Электродный потенциал. Стандартный электродный потенциал. Стандартный водородный электрод. Стандартный восстановительный потенциал. Зависимость электродного потенциала от температуры и концентрации. Уравнение Нернста. Ряд напряжений. Восстановительный потенциал как мера окислительной и восстановительной способности.
Окислительно-восстановительный потенциал. Направление окислительно-восстановительных реакций.
Газовые электроды (водородный, кислородный, хлорный).
Кинетика электродных процессов. Поляризация катодная и анодная. Концентрационная и электрохимическая поляризация. Уравнение Тафеля.
Рассмотрим систему (рис.8.1), состоящую из металла 2, погруженного в воду 1. Под действием полярных молекул воды часть ионов металла перейдет в воду. Установится равновесие:
![]()

В металле образуется
избыток электронов. Металл приобретет
отрицательный заряд. Это приведет к
появлению вблизи поверхности металла
избытка положительно заряженных ионов.
Образуется двойной
электрический слой.
Между металлом и раствором возникнет
разность потенциалов. Если ввести в
раствор соль этого металла, то равновесие
сместится влево. Часть ионов перейдет
из раствора на поверхность металла. При
этом изменится величина разности
потенциалов. Если число ионов, перешедших
из раствора на поверхность металла,
окажется достаточно большим, то это
может привести к смене знака заряда
металла. Потенциал двойного электрического
слоя, образующегося на границе между
металлом и раствором его соли, носит
название электродного
потенциала,
а при стандартной температуре Т=298,15 К
и
![]() моль/л
–стандартного
электродного потенциала.
Величина и знак стандартного электродного
потенциала могут служить мерой химической
активности металлов. Однако абсолютная
величина стандартного электродного
потенциала не может быть измерена, т.к.
измерительная цепь будет неизбежно
включать в себя несколько потенциалов.
Поэтому обычно измеряют величину
электродного потенциала относительно
второго электрода. В качестве такого
электрода, т.е. электрода сравнения,
принято использовать стандартный
водородный электрод (рис.8.2).
моль/л
–стандартного
электродного потенциала.
Величина и знак стандартного электродного
потенциала могут служить мерой химической
активности металлов. Однако абсолютная
величина стандартного электродного
потенциала не может быть измерена, т.к.
измерительная цепь будет неизбежно
включать в себя несколько потенциалов.
Поэтому обычно измеряют величину
электродного потенциала относительно
второго электрода. В качестве такого
электрода, т.е. электрода сравнения,
принято использовать стандартный
водородный электрод (рис.8.2).

Водородный электрод состоит из платины 1, покрытой платиновой чернью, т.е. тонкодисперсной платиной. Платина помещена в раствор серной кислоты. Через раствор пропускают ток водорода. Платиновая чернь очень хорошо растворяет водород. В результате образуется система, состоящая из водорода, растворенного в платине, и ионов водорода в растворе. В системе имеет место равновесие:
2Н+ + 2е- ↔Н2.
Возникает скачок
потенциала между платиной и раствором.
Если активность ионов водорода равна
единице, парциальное давление газообразного
водорода составляет 101,3 кПа, а Т=298,15 К,
то такой электрод называют стандартным
водородным электродом.
Потенциал стандартного водородного
электрода условно принят равным нулю
(![]() ).
).
Для определения потенциалов электродов собирают гальванический элемент, состоящий из стандартного водородного и измеряемого электродов. В схеме гальванического элемента слева записывают водородный электрод, а справа – измеряемый электрод. Например, схема гальванического элемента, состоящего из стандартного водородного электрода и цинкового электрода, запишется как
![]()
Символ «Pt» обозначает индифферентный (химически инертный) платиновый электрод, вертикальная черта означает контакт двух фаз, двойная вертикальная черта − контакт двух отличающихся по составу и концентрации растворов, в данном случае серной кислоты и сульфата цинка; в круглых скобках указывается концентрация раствора. Возможна также сокращенная запись, в которой не указываются частицы, не участвующие в электродных процессах (сульфат-ионы):
![]()
Схема элемента, состоящего из стандартного водородного электрода и медного электрода, помещенного в раствор сульфата меди, имеет следующий вид:
![]()
При замыкании цепи на электродах будет происходить окислительно-восстановительная реакция. В случае элемента, состоящего из цинкового и водородного электродов, на цинковом электроде пойдет процесс окисления цинка:
Zn – 2e- → Zn2+,
а на водородном электроде – восстановление ионов водорода:
2H+ + 2e -→ H2.
Суммарная реакция водородно-цинкового элемента запишется как
Zn + 2H+ → Zn2+ + H2.
В процессе окисления цинка выделяются свободные электроны, которые по внешней цепи переходят к водородному электроду, где используются в процессе восстановления ионов водорода. При работе этого гальванического элемента цинковый электрод заряжается отрицательно и носит название анод, а водородный электрод заряжается положительно и носит название катод. Следовательно, на аноде происходит окисление, а на катоде – восстановление. Во внешней цепи гальванического элемента электроны перемещаются от анода к катоду, во внутренней цепи анионы перемещаются к аноду, т.к. в анодном пространстве происходит накопление избытка катионов цинка, а катионы перемещаются к катоду, поскольку при работе гальванического элемента катионы водорода удаляются из катодного пространства. В результате сохраняется электронейтральность раствора.
ЭДС гальванического
элемента, равная разности потенциалов
измеряемого электрода при условии, что
активность его ионов в растворе равна
единице, а Т=298,15 К, и стандартного
водородного электрода, носит название
стандартного
электродного потенциала (![]() ).
Для водородно-цинкового элемента
стандартный электродный потенциал
запишется следующим образом:
).
Для водородно-цинкового элемента
стандартный электродный потенциал
запишется следующим образом:
![]() ,
,
а для медно-водородного элемента –
![]() .
.
Стандартные электродные потенциалы принято относить к электродным полуреакциям восстановления, и по этой причине их называют стандартными восстановительными потенциалами.
Металлы, расположенные в порядке возрастания их величин стандартных восстановительных потенциалов, называют рядом активности металлов: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Pd, Pt, Au. Чем отрицательнее значение стандартного восстановительного потенциала металла, тем сильнее его восстановительные свойства. Наоборот, чем положительнее значение стандартного восстановительного потенциала металла, тем сильнее окислительные свойства иона металла. Наиболее сильным восстановителем является литий, а наиболее сильными окислителями являются ионы золота, платины, палладия.
Работа гальванического
элемента всегда связана с протеканием
окислительно-восстановительной реакции,
поэтому стандартный электродный
потенциал характеризует
окислительно-восстановительные свойства
участников реакции. Положительная
величина
![]() означает, что ионы металла являются
более сильным окислителем, чем ионы
водорода, а водород – более сильный
восстановитель, чем металл. Следовательно,
водород будет восстанавливать ионы
металла. Отрицательная величина
означает, что ионы металла являются
более сильным окислителем, чем ионы
водорода, а водород – более сильный
восстановитель, чем металл. Следовательно,
водород будет восстанавливать ионы
металла. Отрицательная величина![]() ,
напротив, указывает на то, что ионы
водорода являются более сильным
окислителем, чем ионы металла, а металл
– более сильный восстановитель, чем
водород. В этом случае металл будет
восстанавливать ионы водорода до
свободного водорода.
,
напротив, указывает на то, что ионы
водорода являются более сильным
окислителем, чем ионы металла, а металл
– более сильный восстановитель, чем
водород. В этом случае металл будет
восстанавливать ионы водорода до
свободного водорода.
Электродные потенциалы могут быть измерены не только для металлических электродов, но и для любой системы окислитель–восстановитель, связанной соотношением
аOx + ne- →bRed,
где Ox – окисленная форма вещества; Red – восстановленная форма вещества; ne- – число электронов, принимаемых одной структурной единицей окислителя. В качестве материала электрода обычно используют инертный металл, например платину, погруженную в раствор, содержащий окислитель и восстановитель.
Схема электрода записывается в этом случае следующим образом: Pt|Red,Ox.
Запятая в этой записи означает, что окислитель и восстановитель находятся в одной и той же фазе.
Зависимость величины электродного потенциала от температуры и концентрации описывается уравнением Нернста
 ,
(8.2)
,
(8.2)
где R – универсальная газовая постоянная; Т – температура, К; n – число электронов, принимаемых одной формульной единицей окислителя, F – постоянная Фарадея; aOx и aRed – активности окислителя и восстановителя соответственно; a и b – их стехиометрические коэффициенты.
Если в окислительно-восстановительном процессе участвуют ионы Н+ или ОН‾, то величина электродного потенциала зависит от рН. Приведем в качестве примера выражение уравнения Нернста для реакции
![]() :
:
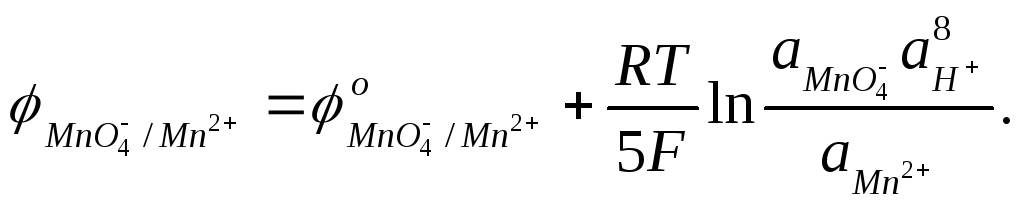
Активность воды является величиной постоянной и учитывается величиной стандартного восстановительного потенциала. Переходя от натуральных логарифмов к десятичным и подставляя значения универсальной газовой постоянной, стандартной температуры и постоянной Фарадея, можно записать уравнение Нернста в следующем виде:
(8.3)
Восстановительные
потенциалы являются мерой окислительной
и восстановительной способности. Если
для двух любых окислительно-восстановительных
полуреакций
![]() ,
то окисленная форма первой полуреакции
(Ox1)
будет более сильным окислителем, чем
окисленная форма второй полуреакции
(Ox2).
Следовательно, окисленная форма первой
полуреакции (Ox1)
будет восстанавливаться, а восстановленная
форма второй полуреакции (Red2)
– окисляться. Одновременно это означает,
что восстановленная форма второй
полуреакции (Red2)
является более сильным восстановителем,
чем восстановленная форма первой
полуреакции (Red1),
следовательно, восстановленная форма
второй полуреакции (Red2)
будет восстанавливать окисленную форму
первой полурекции (Ox1).
,
то окисленная форма первой полуреакции
(Ox1)
будет более сильным окислителем, чем
окисленная форма второй полуреакции
(Ox2).
Следовательно, окисленная форма первой
полуреакции (Ox1)
будет восстанавливаться, а восстановленная
форма второй полуреакции (Red2)
– окисляться. Одновременно это означает,
что восстановленная форма второй
полуреакции (Red2)
является более сильным восстановителем,
чем восстановленная форма первой
полуреакции (Red1),
следовательно, восстановленная форма
второй полуреакции (Red2)
будет восстанавливать окисленную форму
первой полурекции (Ox1).
Пример 8.2.
Какой из трех окислителей
![]() или
или![]()
![]() может окислить ионыCl-
до Cl2?
может окислить ионыCl-
до Cl2?
Решение. Воспользуемся справочными значениями восстановительных потенциалов следующих реакций:
![]() ;
;
![]()
![]()
![]()
![]()
Из величин
стандартных восстановительных потенциалов
следует, что только
![]() и
и![]() в кислой среде могут окислитьCl-
до свободного хлора, т.е.
в кислой среде могут окислитьCl-
до свободного хлора, т.е.
![]() и
и![]() являются более сильными окислителями,
чем свободный хлор. В свою очередь,Cl2
сможет окислить
являются более сильными окислителями,
чем свободный хлор. В свою очередь,Cl2
сможет окислить
![]() в
щелочной среде до
в
щелочной среде до![]() ,
аCr3+
– до
,
аCr3+
– до
![]() .
.
Пример 8.3. Указать наиболее сильные окислитель и восстановитель в приведенных ниже парах: Cl2(г)/Сl‾; I2(т)/I‾.
![]() .
.
Решение.
![]() ,
следовательно, окисленная форма первой
пары (Cl2)
является наиболее сильным окислителем,
а I‾
– наиболее сильным восстановителем.
Свободный хлор может окислить иодид-ионы
до свободного иода.
,
следовательно, окисленная форма первой
пары (Cl2)
является наиболее сильным окислителем,
а I‾
– наиболее сильным восстановителем.
Свободный хлор может окислить иодид-ионы
до свободного иода.
Газовые электроды.
1) Водородный электрод. Уравнение Нернста для водородного электрода при стандартной температуре запишется следующим образом:
 ,
(8.4)
,
(8.4)
где
![]() –
активность ионов водорода в растворе;
–
активность ионов водорода в растворе;![]() – парциальное давление водорода.
– парциальное давление водорода.
Учитывая, что
стандартный электродный потенциал
, а
![]() ,
получим
,
получим
![]() (8.5)
(8.5)
Из формулы (8.5) следует, что при стандартном парциальном давлении водорода потенциал водородного электрода определяется только величиной рН:
![]() (8.6)
(8.6)
2) Кислородный электрод. Устройство кислородного электрода аналогично устройству водородного электрода. Пластинка из инертного металла, например платины, помещается в раствор, содержащий гидроксид-ионы. Через раствор пропускают ток кислорода. Схема кислородного электрода запишется следующим образом:
Pt|O2|OH‾.
Процесс восстановления на кислородном электроде протекает по уравнению
О2 + 2Н2О+4е- ↔ 4ОН‾.
Уравнение Нернста для электродного потенциала кислородного электрода при стандартной температуре имеет вид
 (8.7)
(8.7)
Активность воды является величиной практически постоянной, и она учитывается стандартным потенциалом кислородного электрода, который равен 0,401 В.
Используя
соотношения
![]() и
и![]() ,
получим выражение
,
получим выражение
![]() , (8.8)
, (8.8)
или при стандартном парциальном давлении кислорода
![]() (8.9)
(8.9)
