
- •1) Идеальный газ
- •2) Основное уравнение молекулярно-кинетической теории идеального газа
- •Вывод основного уравнения мкт[править | править исходный текст]
- •3) Теорема о равномерном распределении кинетической энергии по степеням свободы. Уравнение состояния идеального газа.
- •Уравнение состояния идеального газа[править | править исходный текст]
- •4) Работа идеального газа. Внутренняя энергия и теплоемкость (молярная и удельная) идеального газа.
- •Адиабатический[править | править исходный текст]
- •Изотермический[править | править исходный текст]
- •Изохорный[править | править исходный текст]
- •Внутренняя энергия идеального газа
- •5) Первый и второй законы термодинамики (различные формулировки). Первый закон термодинамики
- •Частные случаи первого закона термодинамики для изопроцессов
- •Цикл Карно для тепловой машины
- •Эффективность теплового двигателя
- •6) Политропические процессы. Уравнения политропы для идеального газа
- •Уравнения политропы для газа Ван-дер-Ваальса
- •Адиабата Пуассона[править | править исходный текст]
- •Вывод уравнения[править | править исходный текст]
- •8) Циклические процессы. Коэффициент полезного действия и холодильный коэффициент. Циклические процессы
- •9) Цикл Карно. Коэффициент полезного действия и холодильный коэффициент.
6) Политропические процессы. Уравнения политропы для идеального газа
Политропическим называется процесс, в котором теплоемкость остается постоянной: С = const. Для идеального газа
CdT = Cv dT + vRT/V dV. Если Сv = const, то отсюда следует PV^n = const. Число n = 1 - vR/(C - Cv) = (C -Cp)/(C - Cv) называется показателем политропы. Примеры политропических процессов:
Адиабатический: C = 0, n = гамма. Изобарический: C = Cp, n = 0. Изохорический: C = Cv, n = беск. Изотермический: C = беск, n = 1.
(В случае изобарического и изохорического процессов предполагается соответственно Ср = const и Сv = const).
Уравнения политропы для газа Ван-дер-Ваальса
P(V,T) = RT/(V-b)-a/V^2, U(V,T) = C_V T - a/V;
дельта Q = C dT
дельта Q = dU + PdV
dU = C_V dT + a/V^2 dV
C_V dT + a/V^2 dV + RT/(V-b) dV - a/V^2 dV = СdT
(C - C_v)dT/T = R dV / (V - b)
(C - C_v)ln (T2/T1) = R ln ((V2 - b)/(V1 - b))
(T2^((C - C_v)/R))/(V2-b) = (T1^((C - C_v)/R))/(V1-b)
T = (P + a/V^2)(V - b)/R
(P + a/V^2)^((C - C_v)/R) (V - b)^((C - C_v)/R - 1) = const
(P + a/V^2)(V - b)^((C - C_v - R)/(C - C_v)) = const - уравнение политропы для газа Ван-дер-Ваальса.
7) Адиабати́ческий, или адиаба́тный проце́сс (от др.-греч. ἀδιάβατος — «непроходимый») — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
Адиабатический процесс является частным случаем политропного процесса, так как при нём теплоёмкость газа равна нулю и, следовательно, постоянна[2]. Адиабатические процессы обратимы только тогда, когда в каждый момент времени система остаётся равновесной (например, изменение состояния происходит достаточно медленно) и изменения энтропии не происходит. Некоторые авторы (в частности, Л. Д. Ландау) называли адиабатическими только обратимые адиабатические процессы[3].
Адиабата Пуассона[править | править исходный текст]
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.

![]()
График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
диаграмме
для газа.
![]() —
давление газа;
—
давление газа;
![]() —
объём.
—
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где ![]() — абсолютная
температура газа.
Или к виду
— абсолютная
температура газа.
Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении ![]() )
газ нагревается (
)
газ нагревается (![]() возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент ![]() .
.
Вывод уравнения[править | править исходный текст]
Согласно закону Менделеева — Клапейрона[6] для идеального газа справедливо соотношение
![]()
где
R — универсальная
газовая постоянная.
Вычисляя полные дифференциалы от обеих
частей уравнения, полагая
независимыми термодинамическими
переменными ![]() ,
получаем
,
получаем
-
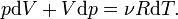
(3)
Если
в (3) подставить ![]() из (2),
а затем
из (2),
а затем ![]() из (1),
получим
из (1),
получим
![]()
или,
введя коэффициент ![]() :
:
![]() .
.
Это уравнение можно переписать в виде
![]()
что после интегрирования даёт:
![]() .
.
Потенцируя, получаем окончательно:
![]()
что и является уравнением адиабатического процесса для идеального газа.
