
method
.pdfДонецкий национальный медицинский университет им. М.Горького Кафедра медицинской химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к практическим занятиям по медицинской химии
(для студентов первого курса медицинских факультетов).
Донецк - 2011
1
Методические указания подготовили:
−зав. кафедрой, доцент Рождественский Е.Ю.
−доцент Сидун М.С.;
−ст. преподаватель Павленко В.И.;
−ассистенты кафедры: Игнатьева В.В., Бойцова В.Е., Бусурина З.А., Стрелецкая Л.П., Сидоренко Л.М.
2
ВВЕДЕНИЕ В ПРАКТИКУМ ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВ. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
АКТУАЛЬНОСТЬ ТЕМЫ:
Отличительная черта современной медицины – активное внедрение достижений химии в теорию и практику исследований функций живого организма. Еще великий ученый М.В. Ломоносов говорил, что «понимаемые в глубоком смысле химия и медицина неотделимы». Медицинская химия изучает химические основы процессов жизнедеятельности живого организма, которые подчиняются основным химическим закономерностям. Большинство процессов, происходящих в живом организме, объясняется на основании теоретических положений неорганической, физической и коллоидной химии. Например, изменение структуры и функций клеток крови в растворах кровезаменителей объясняется законами осмотического давления. Не менее важную роль играют законы кинетики и катализа, которые дают возможность понимать закономерности протекания ферментативных процессов.
Поэтому особую роль приобретает знание основ медицинской химии, которая служит фундаментом при последующем изучении биоорганической и биологической химии, фармакологии, физиологии, гистологии, санитарии и гигиены, анестезиологии.
Прогресс современной медицины во многом обусловлен достижениями в химии. Положительный эффект врачебной деятельности на 70% определяется наличием лекарственных препаратов, большинство которых синтезировано химиками.
Периодический закон и созданная на его основе периодическая система элементов Д.И. Менделеева являются одним из основных законов естествознания, фундаментом современного учения о строении материи. Химия получила теоретический фундамент и приобрела черты современной науки. Значение этого закона выходит далеко за пределы химии. Так, успехи атомной и ядерной физики атома стали возможны лишь благодаря периодическому закону. С другой стороны, развитие квантовой механики расширили и углубили содержание закона.
Вокружающей природе, в живом организме химические элементы образуют большое число неорганических соединений. Их классификация позволяет проследить закономерности изменений свойств соединений, выявить взаимосвязь между ними, произвести обобщение. Это помогает изучению большого объема фактического материала и дает возможность прогнозировать протекание той или иной реакции между веществами.
Впериодической системе элементов нашли своё подтверждение все основные законы философии: закон единства и борьбы противоположностей, переход количества в качество, отрицание отрицания.
Знание периодического закона и периодической системы Д.И. Менделеева,
атак же основных классов неорганических соединений необходимы студентам
3
для дальнейшего изучения ими курсов биохимии, фармакологии и клинических дисциплин.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь трактовать периодическую систему Д.И. Менделеева для составления электронных и электронно-графических формул элементов и на основании положения элемента в системе характеризовать его свойства и свойства его важнейших соединений, а так же анализировать основные классы неорганических соединений.
Достижение данной цели обеспечивается решением конкретных целей.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Трактовать понятия период, группа, подгруппа.
2.Интерпретировать сущность порядкового номера элемента, периодичность изменения свойств элементов, а также понятий: потенциал ионизации, сродство к электрону, электроотрицательность, радиус атома и ионов.
3.Анализировать изменение металлических и неметаллических, окислительно-восстановительных свойств элементов в группах и периодах.
4.Интерпретировать оксиды, гидроксиды, кислоты и соли.
5.Анализировать зависимость кислотно-основных свойств оксидов и гидроксидов от положения элемента в периодической системе Д.И. Менделеева.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ:
1.Вступление к практикуму. Роль курса медицинской химии.
2.Развитие периодического закона. Закон Мозли. Современная трактовка периодического закона.
3.Структура периодической системы и её обоснование с позиций теории строения атома.
4.Периодичность изменения свойств атомов: атомных и ионных радиусов, потенциала ионизации, энергии ионизации, энергии сродства к электрону, электроотрицательности.
5.Классы оксидов, гидроксидов, кислот и солей. Их классификация.
6.Изменение окислительно-восстановительных, кислотно-основных свойств кислородных соединений, устойчивости водородных соединений.
7.Роль периодического системы Д.И. Менделеева в современной химии.
4
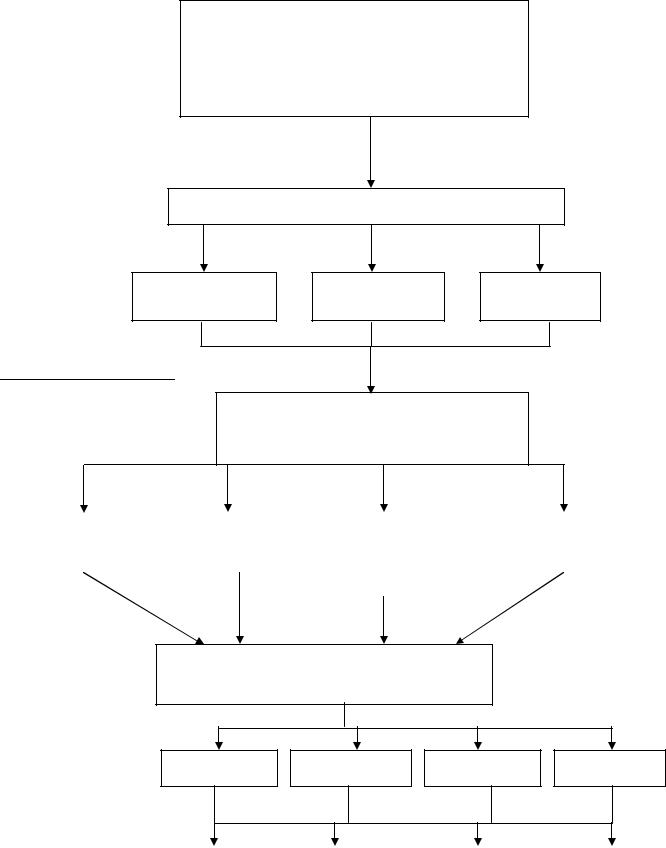
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ:
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА.
ЗАКОН МОЗЛИ. СОВРЕМЕННАЯ ФОРМУЛИРОВКА ПЕРИОДИЧЕСКОГО ЗАКОНА.
ПЕРИОДИЧЕСКАЯ СИСИТЕМА
Структура |
Периоды |
Группы. |
Подгруппы. |
|
Свойства химических
соединений
Периодичность изменения свойств элементов в группах и периодах.
Атомные и |
|
Е ионизации и |
|
Окислительно- |
|
Кислотно-основные |
ионные R |
|
сродства к е, Э.О. |
|
восстановитель |
|
свойства |
|
|
|
|
ные свойства |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Характеристика свойств элементов и его важнейших соединений.
Медико-биологическое |
|
|
|
|
значение |
Оксиды |
Гидроксиды |
Кислоты |
Соли |
Биология |
|
Биохимия |
|
Гигиена |
|
Хирургия |
|
|
|
|
|
|
|
5
3. ИСТОЧНИКИ ИНФОРМАЦИИ: Основная литература:
1.Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 7-24.
2.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 20-44.
Дополнительная литература:
3.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 41-60, 99-125.
4.Н.И. Михайличенко. Общетеоретические основы химии. – К.: Высшая школа, 1979. – С. 35-49.
5.Ершов Ю.А., Попков В.А., Берлянд А.З. Общая химии. Биофизическая химия. Химия биогенных элементов. Учебник для ВУЗов. – М.: Высшая школа,
2000. – С. 153-164.
6. Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 27-45.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к практическому занятию.
РЕШЕНИЕ ОБУЧАЮЩИХ ЗАДАЧ:
Задача 1.
Напишите электронные формулы атомов элементов с порядковыми номерами 20 и 50 и укажите к каким элементам они относятся.
Эталон решения:
Элементы с порядковыми номерами 20 и 50 в периодицеской системе – это кальций и олово. Порядковый номер элемента показывает заряд ядра и число электронов в атоме. Используя номер периода, в котором находится каждый из элементов, их электронные формулы можно изобразить:
Са |
KL 3s23p64s2; |
Кальций – s- элемент; |
Sn |
KLM 4s24p65s2; |
Олово – р-элемент. |
Задача 2.
Напишите электронные формулы атомов хлора и стронция, и их ионов Сl– , Sr2+.
Эталон решения:
Электронные формулы атомов элементов имеют вид:
Сl |
KL 3s23p5; |
Sr |
KLM 4s24p65s2. |
Атом хлора, принимая электрон, превращается в однозарядный ион с восьмиэлектронной внешней оболочкой, а атом стронция, отдавая 2 электрона превращается в двузарядный катион. Электронные фрмулы ионов имеют вид:
Сl– |
KL 3s23p6; |
Sn2+ |
KLM 4s24p65s0. |
6
Задача 3.
Пользуясь правилом Клечковского и положением элементов в периодической системе, укажите, нейтральным атомам каких элементов, отвечают электронные формулы: KL 3s23p63d14s2 и KLM 4s24p2. Приведите формулы их ионов Е3+ и Е2+.
Эталон решения:
Значения главного квантового числа внешнего электронного уровня указывают на то, что элементы находятся в 4-м периоде, причем один из них d-элемент, а другой – р-элемент, на это указывают незаполненные d-орбитали и соответственно р-орбитали. Число валентных электронов 3d14s2 и 4s24p2 подтверждают, что эти элементы соответственно 3-ей и 4-ой групп периодической системы. Значит это элементы – скандий и германий. Для получения катиона Sc3+ из атома нужно удалить два s- и один d-электрон, для получения катиона германия необходимо удалить из нейтрального атома два р- электрона. Тогда электронные формулы ионов имеют вид:
Sc3+ |
KL 3s23p63d104s0; |
Ge2+ |
KLM 4s24p0. |
Задача 4.
Дайте сравнительную характеристику элементов хлора и марганца.
Эталон решения:
Хлор и марганец – элементы седьмой группы, атомы которых имеют одинаковые число валентных электронов, равное номеру группы. Высшая степень окисления элементов +7, поэтому формулы высших оксидов – Cl 2O7 и Mn2O7. Они характеризуются кислотными свойствами, в качестве гидроксидов им соответствуют сильные кислоты HClO4 и HMnO4. Валентные электроны этих элементов находятся на разных энергетических уровнях: у атома хлора это s- и р-электроны внешнего уровня, для завершения которого не хватает одного электрона. Поэтому хлор – типичный неметалл, сильный окислитель.
У атома марганца валентные 2 s-электрона внешнего 5 d-электронов предпоследнего энергетических уровней, поэтому марганец – типичный металл, сильный восстановитель.
Соединения этих элементов в низших степенях окисления отличаются по свойствам. Низший оксид марганца MnO – основной оксид, которому соответствует слабое основание Mn(OH)2, а низший оксид хлора Cl2O – кислотный оксид, ангидрид слабой хлорноватистой кислоты HClO.
Задача 5.
Назовите валентные электроны атомов s-, p-, d-, f-элементов. Подчеркните их в электронных формулах атомов элементов с порядковыми номерами 5,15,17,24,25,35 и укажите, к каким электронным семействам они принадлежат.
Задача 6.
Напишите электронные формулы ионов элементов 4-ого периода аналогов аргона.
7
Задача 7.
Объясните причину «проскока» внешнего s-электрона в атомах хрома и меди.
Задача 8.
Напишите формулы высших оксидов и гидроксидов элементов третьего периода и охарактеризуйте порядок изменения кислотно-основных свойств этих веществ с увеличением заряда ядра атома.
Задача 9.
Разместите гидроксиды в порядке возрастания основных свойств: NaOH, CsOH, Ca(OH)2, Ba(OH)2, Zn(OH)2, Cd (OH)2.
Задача 10.
Пользуясь положением элементов в периодической системе, определите какой из гидроксидов более сильное основание Sn(OH)2 или Pb(OH)2.
Задача 11.
Укажите символы химических элементов, ионам которых отвечают электронные формулы:
E–2 [He] 2s22p6
E– [Ne] 3s23p6
E+2 [Ne] [Ar]3d5; [Ar] 3d2; [Ar] 3d3
Задача 12.
На основании электронного строения атомов дайте сравнительную характеристику элементов хрому и сере.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Элементы характеризуются определенной периодичностью в изменении их свойств в периодической системе. Укажите фактор, определяющий эти изменения:
A.Заряд атома;
B.Степень окисления;
C.Валентность;
D.Атомный радиус;
E.Электроотрицательность.
Задание 2.
Одна из классификаций химических элементов основана на строении их электронных оболочек. Согласно неё все элементы можно разделить на s-, p-, d-
иf-элементы. Какие из приведенных элементов относятся к р-элементам? A. S, P, Cl;
8
B.K, Ca, Se;
C.Ba, Mg, Al;
D.Mn, Br, Mo;
E.P, S, Cr.
Задание 3.
Все водородные соединения элементов V-A группы обладают токсичностью. Какое из этих летучих водородных соединений является наиболее стойким?
A.NH3;
B.PH3;
C.AsH3;
D.SbH3;
E.BiH3.
Задание 4.
Свойства ионов зависят от их положения в периодической системе. Укажите, как изменяются восстановительные свойства в ряду: Сl– – Br – – I –
A.Уменьшаются;
B.Увеличиваются;
C.Не изменяются;
D.Бром сильный восстановитель, чем хлор;
E.Не проявляют восстановительных свойств.
Задание 5.
Основные свойства гидроксидов определяются положением элемента в периодической системе. Какой из перечисленных гидроксидов имеет наиболее выраженные свойства?
A.CsOH;
B.LiOH;
C.KOH;
D.Ca(OH)2;
E.Mg(OH)2.
Задание 6.
Степень окисления элемента определяется его электронной структурой, которая зависит от положения элемента в периодической системе. Укажите элемент, который имеет только положительную степень окисления.
A.Магний;
B.Сера;
C.Хлор;
D.Кислород;
E.Фтор.
9
Задание 7.
Сила галогеноводородных кислот зависит от положения кислотнообразующего элемента в периодической системе. Какая из ниже приведенных кислот является наиболее сильной?
A.HF;
B.HBr;
C.HI;
D.HCl;
E.HBi.
Задание 8.
Все элементы в периодической системе распределены по периодам, группам и подгруппам. Периоды делятся на малые и большие. Чем они отличаются друг от друга?
A.Наличием d- и f-элементов;
B.Наличием металлов;
C.Наличием инертных газов;
D.Наличием s-элементов;
E.Наличием неметаллов.
Задание 9.
К р-элементам IV группы периодической системы относятся углерод, кремний, германий, олово и свинец. Укажите, как изменяются кислотные свойства элементов в этом ряду?
A.Увеличиваются;
B.Уменьшаются;
C.Не изменяются;
D.Сначала увеличиваются, потом уменьшаются;
E.Сначала уменьшаются, потом увеличиваются.
Задание 10.
Соединение меди CuSO4∙5H2O используется в фармации в качестве бактерицидного препарата. Какая формула отвечает электронной конфигурации элемента 29Cu?
A.3d104s1;
B.3d94s2;
C.3d64s2;
D.3d84s2;
E.3d74s2.
Задание 11.
Для количественного определения многих лекарственных средств используют неводные растворы хлорной кислоты. Какой из приведенных оксидов соответствует этой кислоте?
A. Cl2O7;
10
