
method
.pdfНеобходимо рассчитать концентрацию ионов Н+ (моль/л) в данной биологической жидкости:
A.10-1;
B.10-2;
C.10-3;
D.10-4;
E.10-5.
Задание 8.
С целью определения функционирования поджелудочной железы, методом кислотно-основного титрования, определена концентрация гидроксид-ионов в образце жидкости данной секреции: [OH-] = 1·10-5 моль/л. Определите величину рН:
A.5;
B.7;
C.9;
D.11;
E.13.
Задание 9.
С целью определения основного содержания аскорбиновой кислоты (витамина С) в медицинском препарате, необходимо провести кислотноосновное титрование с использованием индикатора метилового красного. Укажите окрашивание, которое будет определять завершение титрования:
A.Розовое;
B.Желтое;
C.Синее;
D.Фиолетовое;
E.Отсутствие окрашивания.
Задание 10.
При клиническом анализе образца крови больного, экспериментально определен водородный показатель: рН=7,2. Установите кислотно-основное состояние крови для дальнейшего выбора курса лечения:
A.Физиологическое;
B.Ацидоз;
C.Алкалоз;
D.– ;
E.– .
Эталоны ответов: |
|
|
|
|
1 |
– D; |
5 |
– A; |
9 – В; |
2 |
– D; |
6 |
– B; |
10 – B. |
3 |
– C; |
7 |
– A; |
|
4 |
– B; |
8 |
– С; |
|
61
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ:
В начале занятия осуществляется определение уровня самостоятельной подготовки студентов к занятию с помощью фронтального опроса.
Следующим этапом является решение учебных задач по теме "Кислотноосновное равновесие в организме. Водородный показатель биологических жидкостей". Затем выполняется лабораторная работа с использованием приведенной инструкции.
После завершения лабораторной работы происходит анализ и коррекция знаний студентов путем рассмотрения вопросов: классификация электролитов и диссоциация их водных растворов, кислотно-основные теории, процесс диссоциации и ионное произведение воды, а также понятия о водородном показателе биологических жидкостей. Далее рассматриваются методы кислотно-основного титрования и принцип действия кислотно-основных индикаторов.
Следующим этапом является проведение тестового контроля знаний студентов по теме "Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей" с использованием тестов формата А.
После завершения тестового контроля, студенты оформляют протокол лабораторной работы, в который вносят результаты экспериментального определения концентрации кислоты или щелочи и расчет величин рН.
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля, и осуществляется проверка протоколов выполненной лабораторной работы.
БУФЕРНЫЕ СИСТЕМЫ, КЛАССИФИКАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ.
АКТУАЛЬНОСТЬ ТЕМЫ:
Постоянство величин рН биологических жидкостей является основой нормального функционирования организма: обуславливает каталитическое действием ионов Н+ в реакциях гидролиза органических веществ, обеспечивает биологическую активность ферментов при определенных значениях рН, поддерживает на постоянном уровне осмотическое давление биологических жидкостей и др. Механизм поддержания величин рН жидкостей на определенном уровне реализуется за счет работы физиологических (почки, печень, легкие) и физико-химических (буферные растворы) систем. При этом работа буферные системы компенсирует сдвиг рН жидкостей мгновенно, в отличие от физиологических систем.
Наиболее важными являются буферные системы крови, которые предотвращают изменение рН при попадании из тканей органических кислот (угольная, молочная, масляная) и основных веществ (аммиак, креатин). При этом буферные системы условно можно классифицировать на органические (белковая, гемоглобиновая-оксигемоглобиновая) и неорганические
62
(гидрокарбонатная, фосфатная). Следует отметить, что неорганические буферы присутствуют как в плазме, так и в эритроцитах, однако, белковый буфер локализован лишь в плазме, а гемоглобиновый – в эритроцитах.
При проведении клинических исследований, широко применяют буферные растворы с определенным диапазон значений рН, максимально приближенным к биологических жидкостей. Подобное "моделирование" основных жидкостных сред организма позволяет изучать протекание биохимических процессов, рассматривать возможные изменения кислотного баланса при введении лекарственных средств и разрабатывать способы устранения подобных изменений.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь интерпретировать состав буферных растворов организма и механизм их действия.
Достижение данной цели обеспечивается решением конкретных целей.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать состав буферных растворов.
2.Интерпретировать расчет величины рН буферных систем.
3.Анализировать механизм действия буферных систем.
4.Трактовать величину буферной емкости.
5.Интерпретировать компоненты и механизм действия буферных систем организма.
6.Трактовать кислотно-основное состояние крови.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ:
1.Классификация и основные компоненты буферных растворов.
2.Уравнения Гендерсона-Гассельбаха. Влияние разведения и концентрирование на величину рН буферов.
3.Механизм действия ацетатного и аммонийного буферных систем.
4.Буферная емкость и факторы, которые определяют данную характеристику.
5.Основные буферные системы организма, механизм их действия и расчет
рН:
−гидрокарбонатная;
−фосфатная;
−белковая;
−гемоглобиновая-оксигемоглобиновая.
6. Кислотно-основное состояние крови. Резервная щелочность крови.
63

2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ:
БУФЕРНЫЕ СИСТЕМЫ
Состав, классификация
Механизм действия |
Уравнение Гендерсона- |
|
Хассельбальха |
||
|
|
|
|
|
|
|
|
|
буферная |
|
|
|
|
влияние |
|
емкость |
|
|
|
|
концентраци |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА
Гидрокарбонатная |
|
Фосфатная |
|
Белковая |
|
Гемоглобиновая |
|
|
|
|
|
|
|
ацидоз
Кислотно-основное |
|
|
|
алкалоз |
|
состояние крови |
|
|
|
|
|
|
|
|
резервная
Биологическая роль щелочность буферных систем
64
3. ИСТОЧНИКИ ИНФОРМАЦИИ: Основная литература:
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 161-177.
2.Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 165-179.
Дополнительная литература:
3.Биофизическая химия. Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. – К.: Вища шк. Головное изд-во, 1986. – С. 77-90.
4.Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для ин-тов. – М.: Высш. школа, 1975. – С. 90-100.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к лабораторно-практическому занятию:
Приготовление буферных растворов и определение величин рН.
Принцип метода: метод основан на приготовлении буферных растворов с заданным значением рН.
Материальное обеспечение: пробирки, мерные пробирки, карандаш для стекла; растворы СН3СООН, СН3СООNa, NH4OH, NH4Cl с молярными концентрациями 0,1 моль/л; универсальная индикаторная бумага, стандартная шкала значений рН.
Ход работы:
1.Взять четыре сухие чистые пробирки и поместить их в штатив.
2.Пронумеровать пробирки при помощи карандаша для стекла.
3.При помощи мерной пробирки отмерить раствор уксусной кислоты и поместить в пронумерованные пробирки следующим образом: №1 – 9 мл; №2 – 5мл; №3 – 1 мл.
4.Используя сухую мерную пробирку, отмерить раствор натрия ацетата и добавить к СН3СООН соответственно: №1 – 1 мл; №2 – 5 мл; №3 – 9 мл.
5.В пробирку №4 поместить 5мл раствора аммиака, отмеренного при помощи сухой мерной пробирки.
6.Добавить к раствору NH4OH 5мл раствора хлорида аммония.
7.В каждую пробирку внести небольшой кусочек универсальной индикаторной бумаги.
8.Определить приблизительные значения рН полученных растворов при помощи стандартной шкалы значений рН.
9.Полученные результаты занести в таблицу:
№ |
V(CH3COOH), мл |
V(CH3COONa), мл |
рНэксп. |
рНрасч. |
1. |
9 |
1 |
|
|
2. |
5 |
5 |
|
|
3. |
1 |
9 |
|
|
|
V(NH4OH), мл |
V(NH4Cl), мл |
рНэксп. |
рНрасч. |
4. |
5 |
5 |
|
|
65

10. Привести расчет теоретических значений рН приготовленных буферных растворов и внести в таблицу полученные результаты (




















 ;
;




















 ).
).
11. Проанализировать соответствие экспериментально установленных и теоретических рассчитанных величин рН.
Определение буферной емкости ацетатного буферного раствора.
Принцип метода: метод основан на экспериментальном определении буферной емкости по количеству добавленной щелочи.
Материальное обеспечение: мерные пробирки, коническая колба, бюретка, растворы СН3СООН, СН3СООNa, NaOH с молярными концентрациями 0,1 моль/л, раствор индикатора метилового красного.
Ход работы:
1.Рассчитать объемы растворов уксусной кислоты и натрия ацетата (СМ=0,1М), необходимые для приготовления буферного раствора с рН=4,75.
2.При помощи мерной пробирки отмерить рассчитанный объем раствора СН3СООН и внести его в коническую колбу.
3.Отмерить необходимый объем СН3СООNa, добавить к уксусной кислоте
иперемешать.
4.Поместить в коническую колбу 2 капли индикатора метилового красного.
5.Определить окрашивание раствора.
6.Промыть бюретку раствором натрия гидроксида (3 раза).
7.Заполнить бюретку раствором NaOH с молярной концентрацией 0,1моль/л и довести уровень жидкости до нуля.
8.По каплям, при интенсивном перемешивании, добавлять раствор щелочи к буферному раствору до изменения окраски (ярко-желтой), которое наблюдается при рН=6,3.
9.Определить объем раствора NaOH, который был использован для титрования.
10.Рассчитать буферную емкость ацетатного буферного раствора.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Для проведения биохимических исследований необходимо приготовить буферную систему путем смешивания строго рассчитанных количеств CH3COOH и CH3COONa. Определите тип данного буферного раствора:
A.Кислотный;
B.Основной;
C.Солевой;
D.Амфотерный;
E.Изотонический.
66

Задание 2.
С целью изучения кинетической активности фермента необходимо задать кислотность реакционной среды рН≈8 и поддерживать ее на постоянном уровне. Определите вещества, которые могут быть для этого использованы:
A.NH4OH и HCl;
B.NH4OH и NH4Cl;
C.NH4Cl и HCl;
D.NaOH и NH4Cl;
E.NaOH и HCl.
Задание 3.
Для диагностики заболевания необходимо установить кислотно-основное состояние плазмы крови, которое определяется количественным содержанием компонентов гидрокарбонатно буфера. Укажите уравнения ГендерсонаГассельбаха которое может быть для этого использовано:
A.









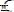



 ;
;
B.



















 ;
;
C.










 ;
;
D.

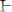








 ;
;
E. |
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Задание 4.
При проведении клинических исследований к образцу мочи больного было добавлено небольшое количество соляной кислоты. Однако, это не привело к изменению рН, а вызвало увеличение концентрации одного из неорганических компонентов. Определите данный ион:
A.PO43-;
B.HPO42-;
C.HPO4-;
D.H2PO42-;
E.H2PO4-.
Задание 5.
Для экспериментального определения содержания ионов Са2+ в образце консервированной крови методом комплексонометрии, необходимо приготовить аммонийный буфер с максимальной буферной емкостью. Определите тип растворов, необходимо использовать:
A.Разбавленные;
B.Минимальной концентрации;
C.Насыщенные;
D.Пресыщенные;
67

E. Ненасыщенные.
Задание 6.
Для определения влияния различных факторов на кинетическую активность фермента карбоангидразы, необходимо приготовить гидрокарбонатный буфер, который моделирует основную буферную систему крови. Определите компоненты данной системы:
A.H2CO3/HCO3-;
B.H2CO3/CO32-;
C.HCO3-/CO32-;
D.H2CO3/CO2;
E.H2O/CO2.
Задание 7.
Для определения содержания фосфат-ионов в образце крови было установлено, что рН=7,4. При условии, что 







 , рассчитайте
, рассчитайте
приблизительное соотношение компонентов фосфатного буфера
[HPO42-]/[H2PO4-]:
A.0,25;
B.1;
C.2;
D.4;
E.8.
Задание 8.
Для подтверждения буферного действия растворов альбуминов крови, к двум образцам были добавлены небольшие количества неорганической кислоты и щелочи. При этом изменение рН не наблюдалось. Определите свойство белков, которое это обусловливает:
A.Растворимость;
B.Наличие небелкового компонента;
C.Амфотерность;
D.Кислотность;
E.Основность.
Задание 9.
При проведении клинического анализа крови пациента после длительного голодания, было определено рН плазмы, которое приблизительно равнялось 7,3. По данному показателю, определите кислотно-основное состояние крови:
A.Норма;
B.Ацидоз;
C.Алкалоз;
D.– ;
E.– .
68
Задание 10.
Человек, отдыхающий второй день в санатории Прикарпатья, обратился к врачу с жалобами: легкая усталость, незначительные головокружение, повышенная сонливость. Врач объяснила, что данные симптомы вызваны гипервентиляцией, которая обусловливает изменение резервной щелочности крови. Укажите примерное содержание СО2 (объем. %) в крови:
A.20;
B.50;
C.60;
D.70;
E.80.
Эталоны ответов: |
|
|
|
||
1 – |
А; |
5 – C; |
9 – В; |
||
2 – |
В; |
6 – А; |
10 – A. |
||
3 |
– |
D; |
7 |
– D; |
|
4 |
– |
E; |
8 |
– С; |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ:
В начале занятия осуществляется определение уровня самостоятельной подготовки студентов к занятию при помощи фронтального опроса.
Следующим этапом является решение обучающих задач по теме «Буферные растворы». Далее выполняется лабораторная работа с использованием приведенной инструкции.
После завершения лабораторной работы, происходит анализ и коррекция знаний студентов путем рассмотрения вопросов относительно классификации буферных систем, механизма их действия, расчета величин рН, влияния процессов растворения и концентрирования на величину рН, определение буферной емкости. Также рассматриваются буферные растворы биологических систем организма, особое внимание уделяется системам крови.
Следующим этапом проводится тестовый контроль знаний студентов по теме «Буферные растворы» с использованием тестов формата А.
После завершения тестового контроля, студенты оформляют протокол лабораторной работы, в который вносят результаты экспериментального определения и расчета величин рН буферных растворов, а так же расчет буферной емкости ацетатного буфера.
Занятие заканчивается подведением итогов работы и оцениванием знаний студентов: объявляются результаты тестового контроля, осуществляется проверка протоколов выполненной лабораторной работы.
69
КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ.
АКТУАЛЬНОСТЬ ТЕМЫ:
К коллигативным свойствам растворов, т.е. свойствам, зависящим от количества частиц, относятся осмотическое давление, диффузия, понижение температуры замерзания и повышение температуры кипения растворов по сравнению с чистым растворителем. Осмотическое давление обеспечивает упругость и эластичность тканей. Коллигативные свойства физиологических, гипертонических и гипотонических растворов связаны с их клиническими свойствами. В медицинской практике используется криометрический метод определения осмотического давления по понижению температуры замерзания раствора называют депрессией. Определение депрессии крови, лимфы, мочи позволяет рассчитывать «осмотическую» концентрацию, которую невозможно определить другими методами.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь интерпретировать коллигативные свойства растворов, которые используются в медицине и биологии.
Достижение данной цели обеспечивается решением конкретных целей.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Идентифицировать явление осмоса и его биологическое значение.
2.Интерпретировать зависимость осмотического давления согласно закона Вант-Гоффа.
3.Интерпретировать явления, которые наблюдаются с живой клеткой, в растворах с различной осмотической концентрацией.
4.Рассчитывать по депрессии точки замерзания растворов осмотическое давление.
5.Рассчитывать моляльную концентрацию и молярную массу растворов.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ:
1.Растворы. Роль растворов в жизнедеятельности организма.
2.Растворимость газов в жидкостях. Закон Генри. Газовая эмболия.
3.Коллигативные свойства растворов. Осмос. Осмотическое давление. Закон Вант-Гоффа.
4.Гемолиз и плазмолиз. Гипо-, гипер-, и изотонические растворы и их применение в медицине.
5.Закон Рауля. Эбулиоскопия и криоскопия.
6.Коллигативные свойства растворов электролитов. Изотонический коэффициент.
7.Биологическое значение коллигативных свойств растворов.
70
