
ХИМИЯ:Metodichka_organika
.pdf4. Прогнозировать свойства белков, исходя из природы и строения аминокислот.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
Содержание обучения должно обеспечивать достижение основных целей обучения.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ: 1. Природные L– α– аминокислоты.
2.Классификация аминокислот - по структуре радикала
- количеству аминных и карбоксильных групп - афинности с водой
3.Амфотерность аминокислот.
4.Биологически важные химические реакции аминокислот.
5.Образование дипептидов, полипептидов. Пептидная связь: -образование -структура пептидной группы
-биуретовая реакция на пептидную группу
6.Уровни структурной организации белковых молекул. Денатурация.
ИСТОЧНИКИ ИНФОРМАЦИИ.
Обязательные:
1. Тюкавкина Н.А., Бауков Ю.И. “ Биоорганическая химия”, М.:Медицина, 1997, с.233, 240, 258, 314-350.
2.Рево А.Ю., Зеленкова В.В. “ Малый практикум по органической химии”, М. :Высшая школа, 1998, оп. 99, 100; инструкция.
3.Лекции по биоорганической химии по теме: «Аминокислоты. Пептиды. Белки».
4.Граф логической структуры
Дополнительные:
1.Органічна хімія. Підручник для вищих фармацевтичних закладів освіти.
У3 кн. / В.П. Черних, Б.С.Зіменковський, І.С.Гріценко,- Харків; Основа, 1997.-
Кн.2,-с.459-467.
2. Черных В.П., Лекции по органической химииХарків; Золоті сторінки, 2005
3.Общий практикум по органической химии / В.П. Черних и др..- Харків: Изд-во НФАУ; Золоті сторінки, 2002.
4.Сборник тестов по органической химии/ Под ред. В.П.Черных. – Харків
2005.
5. Моррисон Р., Бойд Р. Органическая химия. Пер с англ. - М.: Мир, 1974. – 712 с.
61
|
|
|
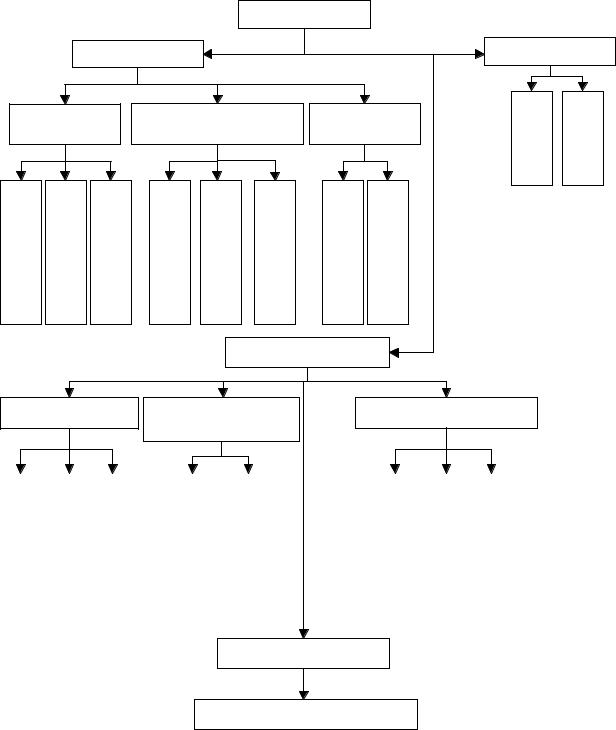
ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ. |
|
|
||||
|
|
|
α – |
аминокислоты. Пептиды. |
|
|
|||
|
|
|
|
|
Аминокислоты |
|
|
|
|
|
|
Классификация |
|
|
|
|
Стереоизомерия |
||
По структуре |
По количеству аминных |
По афинности |
L-изомеры |
D-изомеры |
|||||
|
радикала |
и карбоксильных групп |
к воде |
||||||
|
|
|
|
|
|
|
|
||
Алифатические |
Ароматические |
Гетероциклические |
Моноаминомонокарбоксильные |
Моноаминодикарбоксильные |
Диаминомонокарбоксильные |
Гидроксильные |
Гидрофобные |
|
|
|
|
|
|
Химические свойства |
|
|
|||
Амфотерность |
Реакции |
|
|
Реакции аминной группы |
|
||||
|
|
|
карбоксильнои группы |
|
|
|
|
||
Реакции с |
кислотами |
|
Реакции со |
щелочами |
|
Образование |
цвиттериона |
|
Образование солей, амидов, эфиров |
|
Декарбоксилирование |
|
Ацилирование |
|
Дезаминирование |
|
Образование |
иминов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Образование пептидов
Структура белковых молекул
62

ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ.
Инструкция к лабораторно-практическому занятию.
Образование комплексной соли гликокола.
Принцип метода: метод основан на способности аминокислоты образовывать комплексное хелатное соединение
Материальное обеспечение: пробирки, пипетки, шпатель, оксид меди, 0,2 н раствор гликокола.
Ход работы:
1.В сухую пробирку поместить небольшое количество оксида меди.
2.Добавить 3 капли 0,2 н раствора гликокола.
3.Нагреть над пламенем горелки.
4.Дать отстояться избытку черного порошка оксида меди.
5.Наблюдать образование темно-синего раствора медной соли гликокола.
6.К отстоявшемуся синему раствору медной соли гликокола прибавить 1 каплю 2н NaOH. Образование осадка гидроксида меди, типичное для обычных солей меди, не происходит. При действии гликокола на оксид меди образуется не обычная соль, а внутрикомплексное хелатное соединение, где атом меди связан не только с атомом кислорода гидроксила, но и с атомом азота аминогруппы.
7.Написать уравнение реакции.
Медные соли аминокислот хорошо кристаллизуются, поэтому используются для выделения аминокислот в чистом виде путем перекристаллизации.
Действие формальдегида на аминокислоты
Принцип метода: метод основан на изменении реакции среды нейтральных аминокислот после добавления формалина.
Материальное обеспечение: пробирки, пипетки, 40% раствор формалина, 0,2% раствор индикатора метилового-оранжевого, 2н NaOH, нейтральный раствор гликокола.
Ход работы:
1.В сухую пробирку поместить 3 капли 40% формалина, добавить 1 каплю 0,2% индикатора метилового-оранжевого.
2.Наблюдать красное окрашивание, которое свидетельствует о присутствии кислоты
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
H |
||||||
H |
|
C |
|
H + H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
C |
|
H |
|
H |
|
C |
|
OH + H |
|
C |
|
H |
|||||||||||
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
OH |
|
|
O |
|
|
|
OH |
||||||||||||||
формальдегид |
гидратнаяформа |
муравьиная |
метанол |
|||||||||||||||||||||||
|
|
|
|
|
|
|
формальдегида |
|||||||||||||||||||
|
|
|
|
|
|
|
кислота |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
3. При помощи тонкого капилляра добавить небольшое количество раствора NaOH до появления желтого окрашивания, что свидетельствует о нейтральной среде.
63

4.Полученный нейтрализованный формалин добавить к нейтральному раствору гликокола.
5.Наблюдать мгновенное появление красного цвета, что свидетельствует об образовании кислоты.
6.Записать уравнения реакции аминогруппы гликокола с формальдегидом (образование имина), в которой образуется метиленаминокислота.
Блокирование аминогруппы формальдегидом одновременно освобождает карбоксильную группу, вследствие чего раствор аминокислоты приобретает кислую реакцию, его можно определить при помощи щелочного титрования.
Наличие кислой реакции раствора аспарагиновой кислоты и ее отсутствие у гликокола.
Принцип метода: метод основан на способности аминокислоты к диссоциации.
Материальное обеспечение: пробирки, пипетки, 0,1н раствор гликокола, 0,1н раствор аспарагиновой кислоты.
Ход роботы:
1.Поместить в две пробирки по 3 капли 0,1н раствора гликоколу и аспарагиновой кислоты.
2.Добавить 0,2% раствор индикатора метилового красного.
3.По цвету индикатора определить, какая кислота имеет кислую реакцию, а какая нет.
4.Написать диссоциацию этих кислот и пояснить наличие или отсутствие кислой реакции.
Нингидриновая реакция на аминокислоты
Принцип метода: метод основан на способности α-аминокислот образовывать окрашенные соединения с нингидрином.
Материальное обеспечение: пробирки, пипетки, 0,1н раствор гликокола, 0,1н раствор β-аланина, 0,1% раствор нингидрина.
Ход работы:
1.В сухую пробирку поместить 5 капель гликокола.
2.Добавить 5 капель 0,1% раствора нингидрина.
3.Кипятить в течение 2 минут.
4.Наблюдать розово-фиолетовое окрашивание.
5.Объяснить отсутствие окрашивания с β-аланином.
Ксантопротеиновая реакция
Принцип метода: метод основан на нитровании бензольного кольца ароматической аминокислоты с образованием желтого нитропроизводного.
Материальное обеспечение: пробирки, пипетки, 0,1% раствор тирозина, азотная кислота концентрированная, 0,1н раствор гликокола, 10% раствор
NaOH.
Ход работы:
1.В пробирку поместить 5 капель раствора тирозина.
2.Добавить 3 капли азотной кислоты.
3.Осторожно прокипятить
64
4.Наблюдать появление желтого осадка.
5.Добавить по каплям NaOH до появления оранжевого окрашивания вследствие образования натриевой соли динитротирозина.
6.Выполнить такую же реакцию с гликоколом.
7.Объяснить, почему она отрицательна.
Эта реакция является качественной реакцией на ароматические аминокислоты.
Реакция Фоля
Принцип метода: метод основан на образовании черного осадка сульфида свинца.
Материальное обеспечение: пробирки, пипетки, реактив Фоля, кроличья шерсть, волосы.
Ход работы:
1.В сухую пробирку поместить кроличью шерсть.
2.Добавить 5 капель реактива Фоля.
3.Прокипятить 1-2 минуты.
4.Наблюдать появление черного осадка PbS.
5.Проделать такую же реакцию с прядью волос.
6.Объяснить, почему появляется черный осадок.
Биуретовая реакция
Принцип метода: метод основан на образовании внутрикомплексной соли Материальное обеспечение: пробирки, пипетки, раствор белка, 10% NaOH,
1% СuSO4.
Ход работы:
1.В пробирку поместить 5 капель белка.
2.Добавить 3 капли NaOH
3.Добавить 1 каплю СuSO4.
4.Перемешать.
5.Наблюдать сине-фиолетовое окрашивание содержимого пробирки Это реакция на пептидную связь, ее можно выполнить с биуретом.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Человек способен синтезировать все основные аминокислоты кроме восьми
– незаменимых, которые должны быть включены в рацион питания. Какая из приведенных аминокислот относится к таким?
A.Аланин
B.Глицин
C.Лейцин
D.Серин
E.Глутамин
65
Задание 2.
Более чем 300 аминокислот найдено в природе, но все живые существа, начиная с бактерий и заканчивая человеком, построены в основном из двадцати аминокислот. Они классифицируются по природе радикала. Из приведенных соединений выберите алифатическую аминокислоту.
A.Триптофан
B.Гистидин
C.Тирозин
D.Пролин
E.Серин
Задание 3.
Аминокислоты классифицируются в соответствии с количеством карбоксильных и аминогрупп. Выберите из данных аминокислот положительно заряженную по радикалу.
A.Глутаминовая кислота
B.Аргинин
C.Аланин
D.Серин
E.Фенилаланин
Задание 4.
Аминокислоты в соответствие с наличием или отсутствием полярной группы делятся на гидрофильные и гидрофобные. Какая из приведенных аминокислот будет располагаться на поверхности белковой молекулы?
A.Аланин
B.Изолейцин
C.Лизин
D.Лейцин
E.Фенилаланин
Задание 5.
Глутатион является антиоксидантом, он содержится почти во всех живых клетках, особенно много глутатиона в хрусталике глаза. Его состав: γ-Глу-Цис- Гли. Определите заряд этого трипептида?
A.- 2
B.-1
C.0
D.+1
E.+2
Задание 6.
В соответствие с правилом аминокислоты в пептидах пишутся определенным образом. Укажите С-концевую аминокислоту в данном пентапептиде.
66
Асп-Глн-Гли-Вал-Лиз
A.лизин
B.аспарагин
C.валин
D.аспарагиновая кислота
E.лейцин
Задание 7.
Аминокислоты являются универсальным биологическим материалом, благодаря их способности полимеризоваться. α-аминокислоты – мономеры белков. При помощи какой связи они соединяются в цепь первичной структуры белка?
A.Водородная
B.Электростатическая
C.Пептидная
D.Ионная
E.Дисульфидная
Задание 8.
Белки являются важнейшими буферами в организме человека. Чем обусловлена эта их способность?
A.большим количеством аминокислот
B.аминокислотными компонентами с разными pKa
C.N-конец и C-конец действуют как донор и акцептор протона
D.пептидные связи легко гидролизуются и высвобождают Н и ОН группы
E.большим количеством водородных связей в α-спирали
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач.
1-С; 2-Е, 3-В ; 5-В; 7-С.
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ РАБОТЫ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия проводится проверка подготовки студентов к проведению практического занятия. Студенты решают обучающие задачи, разбирают и закрепляют теоретический материал: интерпретируют структуру, изомерию и свойства аминокислот, записывают реакции, которые иллюстрируют химические свойства аминокислот, а также образование пептидов.
Далее, после решения обучающих задач, студенты начинают выполнять самостоятельную работу. Используя инструкцию к лабораторно-практическому занятию, они проводят опыты и оформляют протокол лабораторной работы. Следующим этапом проводится анализ и коррекция самостоятельной работы студентов. Занятие заканчивается тестовым контролем и подведением итогов работы.
67
СОДЕРЖАНИЕ
№ |
|
|
п/п |
Наименование темы. |
Страницы |
|
|
|
1. |
Строение и химические свойства альдегидов и |
|
кетонов. |
|
|
2. |
Строение и химические свойства моно-и |
|
дикарбоновых кислот. |
|
|
3. |
Строение и химические свойства липидов и |
|
фосфолипидов. |
|
|
4. |
Гетерофункциональные соединения: окси- и |
|
оксокислоты. |
|
|
5. |
Углеводы. Моносахариды. |
|
|
|
|
|
|
|
6. |
Углеводы. Ди- и полисахариды. |
|
|
|
|
|
|
|
7. |
Строение и свойства гетероциклических |
|
соединений. |
|
|
|
|
|
8. |
α-аминокислоты. Пептиды. |
|
|
|
|
|
|
|
68
