
ХИМИЯ:Metodichka_organika
.pdfИСТОЧНИКИ ИНФОРМАЦИИ:
1.Тюкавкина Н.А.,Бауков Ю.И. Биоорганическая химия: Учебник. –
М.:Медицина, 1991. – С.54-82, С.256-267.
2.Рево А.Ю., Зеленкова В.В. Малый практикум по органической химии – М.:Высшая школа, 1980.- С.151-152, 154-156.
3.Лекция по биоорганической химии.
4.Граф логической структуры.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к лабораторно-практическому занятию:
Образование кислой и средней калиевых солей D-винной кислоты.
Принцип метода: метод основан на различной растворимости кислий и средних солей винной кислоты.
Материальное обеспечение: пробирки, пипетки, штатив, шпатель, дистиллированная вода, 2М раствор винной кислоты, 0,5 М раствор КОН.
Ход работы:
1.В пробирку поместить 1 каплю раствора винной кислоты и добавить 2 капли раствора КОН.
2.Смесь хорошо встряхнуть.
3.Наблюдать образование белого кристаллического осадка.
4.Добавить избыток раствора КОН: еще 4-5 капель и перемешать.
5.Наблюдать постепенное растворение осадка.
6.Полученный раствор сохранить для последующего опыта.
7.Записать уравнение реакцій образования кислой и средней солей. Образование двух различных по растворимости солей свидетельствует о
налички двух карбоксильных групп в структуре винной кислоты.
Доказательство наличия гидроксильных групп в структуре винной кислоты.
Принцип метода: метод основан на способности образовывать внутрикомплексные соли с катионами Cu2+.
Материальное обеспечение: пробирки, пипетки, штатив, шпатель, газовая горелка, дистиллированная вода, раствор средней калиевой соли винной кислоты, 0,2 М раствор CuSO4, 2 М раствор NaOH.
Ход работы:
1.Поместить в пробирку 2 капли раствора сульфата меди и 2 капли раствора гидроксида натрия.
2.Наблюдать образование голубого осадка.
3.Добавить к осадку раствор тартрата калия, полученный в предыдушем опыте.
4.Наблюдать растворение осадка с образованием раствора ярко-синенго цвета.
5.Нагреть раствор над пламенем горелки.
6.Наблюдать отсутствие изменений в цвете раствора.
31
7. Записать уравнение образования комплексной соли и сделать вывод об отсутствии изменений при нагревании раствора.
Данная реакция иллюстрирует возможность использования жидкости Фелинга для подтверждения наличия нескольких гидроксильних групп в структуре моносахаридов.
Доказательство наличия фенольного гидроксила в структуре салициловой кислоты.
Принцип метода: метод основан на качественной цветной реакции с ионами
Fe3+.
Материальное обеспечение: пробирки, пипетки, штатив, шпатель, дистиллированная вода, 0,1 М раствор, кристаллическая салициловая кислота.
Ход работы:
1.В пробирку поместить 1-2 кристалла салициловой кислоты и добавить несколько капель дистиллированной воды, встряхнуть.
2.Добавить к полученному рас твору 1 каплю раствора FeCl3.
3.Наблюдать изменение окрашивания.
4.Записать уравнение реакции.
Доказательство отсутствия фенольного гидроксила в структуре ацетилсалициловой кислоты (аспирина) и ее гидролиз.
Принцип метода: метод основан на качественной цветной реакции фенольного гидроксила с ионами Fe3+.
Материальное обеспечение: пробирки, пипетки, штатив, шпатель, газовая горелка, дистиллированная вода, 0,1 М раствор FeCl3, кристаллический аспирин.
Ход работы:
1.В пробирку насыпать несколько кристаллов аспирина, добавить небольшое количество дистиллированной воды и перемешать до полного растворения.
2.Разделить полученный раствор на две части.
3.В первую пробирку добавить раствор FeCl3.
4.Сделать вывод об отсутствии окрашивания.
5.Раствор аспирина во второй пробирке прокипятить над пламенем горелки полторы минуты.
6.Записать уравнение гидролиза аспирина.
7.К охлажденному раствору добавить раствор FeCl3.
8.Наблюдать появление фиолетового окрашивания.
9.Сделать вывод о налички окрашивания и записат уравнение реакции. Различие в способности салициловой и ацетилсалициловой кислот
взаимодействовать с раствором хлорида железа (ІІІ) с образованием окрашенных соединений используется для определения чистоты аспирина, который при длительном хранении разлагается с образованием салициловой кислоты.
32
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНИХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Лимонная кислота принимает участие в цикле трикарбоновых кислот (цикле Кребса). Укажите класс гетерофункциональных соединений, к которому она относится:
A.карбонильные соединения;
B.оксикислоты;
C.оксокислоты;
D.высшие жирне кислоты;
E.аминокислоты.
Задание 2.
Приведенная оксикислота является продуктом метаболизма жирных кислот:
|
|
H |
|
|
|
O |
|
CH3 |
|
C |
|
CH2 |
|
C |
|
|
|
|
|||||
|
|
|
|
|
|
|
OH |
OH
Укажите название данной кислоты:
A.пировиноградная;
B.ацетоуксусная;
C.молочная;
D.щавелевоуксусная;
E.β-гидроксимаслянная.
Задание 3.
Салициловая кислота – основа для синтеза жаропонижающих препаратов. Укажите, какая из приведенных структур, отвечает данной кислоте:
A.
B.
C.
D.
 COOH
COOH
 OH
OH
|
COOH |
COOCH3 |
Е. |
OCH3 |
|
OH |
|

 COOCH3
COOCH3
 OCH3
OCH3

 COOH
COOH
 O C CH3
O C CH3
O
33

Задание 4.
γ-оксимаслянная кислота обладает слабовыраженным наркотическим эффектом, а продукт ее взаимодействия с NaOH используется как анестезиологическое средство. Укажите название класса соединений данного продукта:
A.сложный эфир;
B.соль;
C.простой эфир;
D.амид;
E.кетон.
Задание 5.
Пировиноградная кислота – кетокислота, поэтому она характеризуется реакциями нуклеофильного присоединения, в том числе, реакцией с HCN. Укажите название образующегося продукта:
A.сложный эфир;
B.соль;
C.амид;
D.кетон;
E.оксинитрил.
Задание 6.
Яблочная кислота образуется в цикле Кребса из фумаровой и вступает в далнейшее окисление. Укажите структурную формулу окисленного соединения:
A.
B.
C.
D.
COOH
C O
O
CH3
COOH
COOH
COOH
C O
O
CH2 COOH
O
(пировиноградная кислота);
(щавелевая кислота);
(щавлевоуксусная кислота);
(уксусная кислота);
CH3 C
OH
E. СН3-СН2-ОН (этанол).
Задание 7.
Положение гидроксилной группы в молекуле оксикислоты (α, β, γ) определяет химические превращения, которые происходят с веществом при нагревании. Укажите название оксикислоты, которая в реакции дегидратации образует приведенное соединение:
34
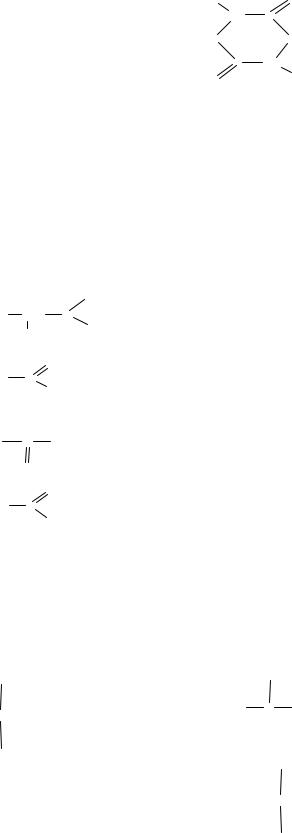
CH3 |
O |
CH |
C |
O |
O |
O
A.β-гидроксимаслянная;
B.молочная;
C.γ-гидроксимаслянная;
D.α- гидроксимаслянная;
E.β-гидроксипропионая.
C CH
CH3
Задание 8.
Пировиноградная кислота образуется в процессе гликолиза, а в дальнейшем происходит ее декарбоксилирование. Укажите продукт данной реакции:
O A. CH3 CH C 
OH OH
O
B. CH3 C
H
C. CH3 C CH3
O
O
D. CH3 C
OH
E. СН3– СН2– ОН
(молочная кислота);
(уксусный альдегид);
(ацетон);
(уксусная кислота);
(этиловый спирт).
Задание 9.
При интенсивной работе, в мышцах накапливается L-(+)-молочная кислота, вследствие чего возникает характерная боль. Укажите структурную формулу данного изомера:
|
|
|
COOH |
|
|
|
COOH |
|||||||||||||
A. |
|
|
|
|
|
|
С. |
H |
C |
H |
||||||||||
H |
|
|
C |
|
|
OH |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|||||||||
|
|
|
CH3 |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
COOH |
|||||||||
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|||||||
B. |
|
|
|
HO |
|
|
|
|
C |
|
|
H |
||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
HO |
|
|
|
|
|
H |
|
D. |
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
CH2-COOH |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
E. H |
|
|
|
|
|
COOH |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2-COOH
35
Задание 10.
Ацетоуксусная кислота образуется в процессе метаболизма липидов. В организмах людей, болеющих сахарным диабетом нарушен липоидный обмен. Укажите причину интоксикации организма таких больных:
A.изменение осмотического давления;
B.изменение буфферной емкости крови;
C.метаболиты накапливаются в мышцах, вызывая характерную боль;
D.образование токсичних «ацетоновых тел» из соответствующих оксокислот;
E.ускоряется механизм реакций цикла Кребса.
Эталоны ответов к заданиям:
1 |
– B; |
6 |
– |
C; |
2 |
– E; |
7 |
– |
B; |
3 |
– A; |
8 |
– |
B; |
4 |
– B; |
9 |
– |
D; |
5 |
– E; |
10 |
– D. |
|
КРАТКИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К РАБОТЕ НА ПРАКТИЧЕСКОМ ЗАНЯТИИ.
В начале занятия осуществляется проверка подготовки студентов к самостоятельной работе. Студенты решают обучающие задания, разбирают и закрепляют теоретический материал: интерпретируют структуру и свойства гетерофункциональных соединений, записывают реакции, иллюстрирующие химические свойства окси- и оксикислот, а также стереоизомерические формулы D- и L- оксикислот.
Далее, после решения обучающих заданий, студенты выполняют самостоятельную работу. Используя инструкцию к лабораторно-практическому занятию, они выполняют опыты и оформляют протокол лабораторной работы.
Следующим етапом проводится анализ и коррекция самостоятельной работы студентов.
Занятие заканчивается тестовым контролем и подведением итогов работы.
УГЛЕВОДЫ. СТРОЕНИЕ И СВОЙСТВА МОНОСАХАРИДОВ.
АКТУАЛЬНОСТЬ ТЕМЫ.
Углеводы – важнейший класс органических соединений, один из главных компонентов пищи. Углеводы выполняют очень важные функции: они являются источниками энергии в организме, входят в состав жизненно важных веществ (нуклеиновых кислот, кофементов, других биополимеров).
Известный моносахарид глюкоза поступает в организм с растительной пищей в виде фруктов, соков, а также образуется в результате ферментативного распада сложных углеводов. Глюкоза входит в состав всех известных сложных
36
углеводов, она является обязательным компонентом крови и тканей и непосредственным источником энергии для биохимических реакций.
В зависимости от строения углеводы имеют различные химические свойства. Знание этих свойств поможет студентам изучить те биохимические преобразования, которые происходят с углеводами в организме человека. Тема имеет большое значение для изучения курса биохимии и следующих дисциплин: терапии, эндокринологии, фармакологии.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь прогнозировать способность моносахаридов вступать в реакции, различать их важнейшие свойства для понимания их метаболических превращений в организме.
Достижение данной цели обеспечивается решением конкретных целей. КОНКРЕТНЫЕ ЦЕЛИ:
УМЕТЬ:
1.Интерпретировать классификацию и строение моносахаридов в зависимости от числа атомов углерода и наличии различных функциональных групп.
2.Прогнозировать явление стереоизомерии, образование различных таутомерных форм, α- и β- аномеров, явление мутаротации.
3.Определять химические свойства моносахаридов.
4.Проводить реакции идентификации моносахаридов.
5.Трактовать медико-биологическое значение углеводов и их производных как участников метаболических процессов в организме человека.
СОДЕРЖАНИЕ ОБУЧЕНИЯ.
Содержание обучения должено обеспечивать достижение целей обучения.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ: |
|
|
|
||
1. |
Классификация |
моносахаридов. |
Пентозы |
(рибоза, 2– дезоксирибоза). |
|
Гексозы (глюкоза, галактоза, фруктоза). |
|
|
|
||
2. |
Стереоизомерия |
моносахаридов |
(D и L |
– формы) открытые |
и |
циклические формы |
моносахаридов; |
цикло– оксо-таутомерия (формулы |
|||
Фишера, Колли-Толленса, Хеуорса). Фуранозные и пиранозные циклы; α– |
и |
||||
β– аномеры. |
|
|
|
|
|
3. |
Химические свойства моносахаридов: |
|
|
||
3.1.Восстановление моносахаридов; образование сорбита. Окисление моносахаридов, образование альдоновых и уроновых кислот.
3.2.Гликозидный гидроксил и его свойства; гликозиды, простые эфиры, сложные эфиры.
3.3.Аминопроизводные моносахаридов: глюкозамин, галактозамин.
4.Качественные реакции на моносахариды взаимодействие с реактивами Толленса, Фелинга и Троммера, реакция Селиванова на кетозы.
5.Медико-биологическое значение моносахаридов и их функциональных производных как участников метаболичных процессов в организме.
37
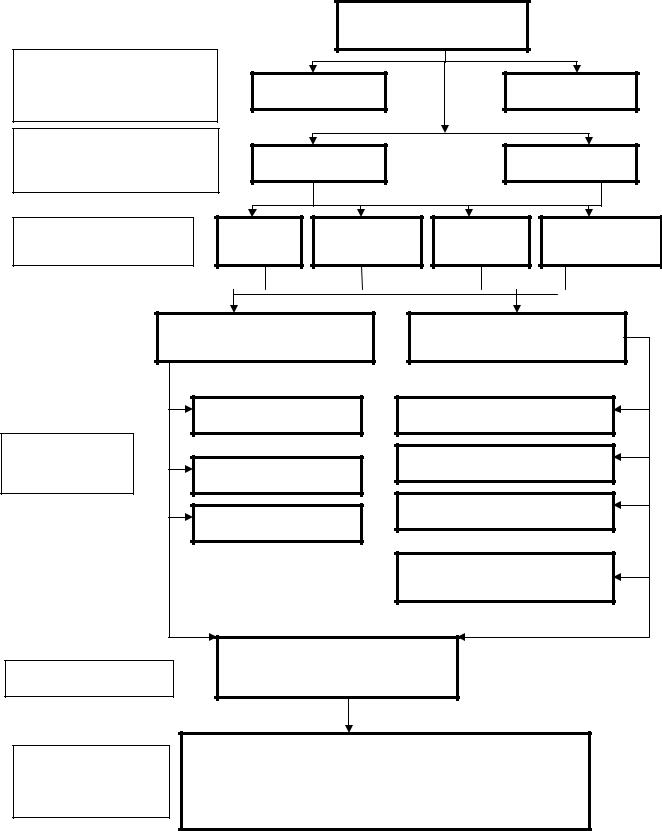
ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ: |
|
||||
“ УГЛЕВОДЫ. СТРОЕНИЕ И СВОЙСТВА МОНОСАХАРИДОВ” |
|||||
|
|
МОНОСАХАРИДЫ |
|
||
Классификация по |
|
|
|
|
|
наличию функциональных |
Альдозы |
|
Кетозы |
||
групп |
|
|
|||
|
|
|
|
||
Классификация по |
|
|
|
|
|
количеству атомов |
|
Пентозы |
|
Гексозы |
|
углерода |
|
|
|
|
|
Стереоизомерия |
D и L- |
Таутомерия |
α и β- |
Мутаротация |
|
|
формы |
|
аномеры |
|
|
|
Реакции с участием |
Реакции с участием |
|||
|
открытых форм |
циклических форм |
|||
|
Восстановление |
Образование гликозидов |
|||
Химические |
|
|
Алкилирование |
||
свойства |
Окисление |
||||
|
|
||||
|
|
|
|||
|
Эпимеризация |
Ацилирование |
|||
|
|
|
|||
|
|
|
Образование эфиров |
||
|
|
|
фосфорной кислоты |
||
|
Проба Троммера, |
|
|
||
Идентификация |
реакция Селиванова |
|
|||
Медико- |
D-глюкоза, |
D-галактоза, D-фруктоза D-ксилоза, D- |
|||
рибоза, 2-дезокси-D-рибоза, сорбит, ксилит, |
|||||
биологическое |
|||||
аскорбиновая, нейраминовая кислоты, |
|
||||
значение |
|
||||
|
аминосахара, |
фосфаты. |
|
||
|
|
|
|||
|
|
38 |
|
|
|

ИСТОЧНИКИ ИНФОРМАЦИИ:
1. Тюкавкина Н.А., Бауков Ю.И. “ Биоорганичееская химия”, М.:Медицина, 1991, с.377-407.
2.Пособие к лабораторным занятиям по биоорганической химии, под руководством Н.А. Тюкавкиной. – М.:Медицина, 1979, с.201-215.
3.Рево А.Я., Зеленкова В.В. Малый практикум по органической химии. – 1980, опыт: 70, 71, 72, 74.
4.Конспект лекций.
5.Граф логической структуры.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
Инструкция к лабораторно-практическому занятию:
Доказательство наличия гидроксильных групп в глюкозе.
Принцип метода: метод основан на способности моносахаридов
образовывать внутрикомплексные соли с катионами Си 2+ .
Материальное обеспечение: пробирки, 2н. NaOH, 0,2н. Cu(OH)2, 0,2н.раствор CuSO4.
Ход работы:
1.Поместить в пробирку 1к. 0,5 % раствора глюкозы и 6к. 2н. NaOH.
2.Добавить к полученной смеси 1к. . 0.2н. CuSO4.
3.Наблюдать растворение гидроксида меди и получения прозрачного раствора сахарата меди слабо голубого окрашивания.
4.Полученный раствор оставить до следующего опыта.
5.Записать схему реакции.
Данная реакция свидетельствует о наличии нескольких гидроксильных групп в молекуле глюкозы.
Восстановление гидроксида меди глюкозой в присуствии щелочи (проба Троммера).
Принцип метода: метод основан на способности глюкозы восстанавливать металлы.
Материальное обеспечение: пробирки, вода, горелка, 0,2н раствор Cu(OH)2, раствор сахарата меди, полученный в предыдущем опыте.
Ход работы:
1.К раствору сахарата меди добавить несколько капель воды.
2.Нагреть пробирку так, чтобы грелась только верхняя часть раствора, не доводя до кипения.
3.Записать схему реакции.
Данная реакция применяется для открытия глюкозы в моче.
Открытие глюкозы щелочным раствором глицерата меди (реактив Гайнеса).
Принцип метода: метод основан на способности моносахаридов образовывать внутрикомплексные соли с катионами Си 2+ .
39

Материальное обеспечение: пробирки, 2н. NaOH, 0,2н. Cu(OH)2, глицерин,0,5% раствор глюзозы, вода.
Ход работы:
1.Поместить в пробирку 1к. 0,2н. Cu(OH)2 и 2к. 2н. NaOH.
2.Добавить к полученной осадку гидроксида меди 1к. глицерина, перемешать.
3.К полученному раствору прибавить 1к. 0,5% раствора глюкозы и не колько капель воды, чтобы высота слоя жидкости составляла 18-20 мм.
4.Смешать раствор.
5.Нагреть до кипения только верхнюю часть раствора.
6.Записать схему реакции.
Щелочной раствор глицерата меди применяется для клинического определения глюкозы в моче.
Реакция Селиванова на фруктозу.
Принцип метода: метод основан на способности кетогексоз довольно легко образовывать оксиметилфурфурол.
Материальное обеспечение: пробирки, 0,5% раствор фруктозы, горелка,сухой резорцин.
Ход работы:
1.Поместить в пробирку крупинки сухого резорцина и 2к. конц. НСІ.
2.Прибавить 2к. 0,5% раствора фруктозы.
4.Нагреть пробирку до начала кипения.
5.Записать схему реакции и определить цвет полученного соединения.
6.Данная реакция применяется для открытия фруктозы.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТРЫХ ЦЕЛЕЙ ОБУЧЕНИЯ.
Задание 1.
В состав сложной молекулы ДНК – одной из нуклеиновых кислот, входит углеводный компонент – дезоксирибоза в форме β, D – дезоксирибозы.Среди перечисленных ниже структур найдите ее формулу:
40
