
- •Розділ 5. Розчини
- •5.1. Загальні поняття про розчини
- •249,7Г(CuSo4· 5h2o) містять 159,6 г/CuSo4 )
- •100 Г розчину містять 15г h2so4
- •100 Г розчину містять 9 г нCl
- •5.2. Розчини неелектролітів
- •5.3. Розчини електролітів
- •Константа дисоціації при 2025 с
- •5.4. Гідроліз солей
- •5. Добуток розчинності
- •Питання і задачі
5. Добуток розчинності
До рівноважних належать також система “ важкорозчинний електроліт – його насичений розчин ”, наприклад
BaSO4 ↔ Ba2+ + SO42−.
Константа рівноваги у цьому випадку має вигляд:
К =
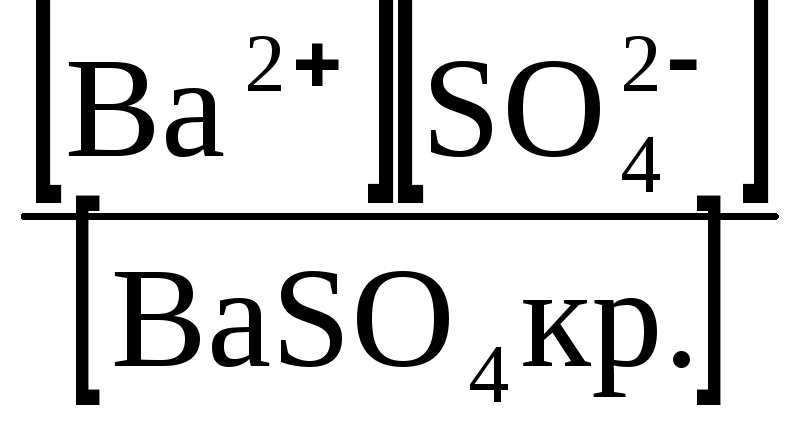 = const,
= const,
тоді К·[BaSO4 кр.] = const = [Ba2+ ][SO42−] = ДP(BaSO4).
У насиченому розчині важкорозчинного електроліту добуток концентрацій його іонів у ступенях стереометричних коефіцієнтів при даній температурі є величина стала, яку називають добутком розчинності (ДP).
Приклад 5. Добуток розчинності йодиду свинцю при 20 ˚С дорівнює 8·10−9. Визначити розчинність солі (у моль/л, та у г/л) при вказаній температурі.
Розвязання:
Нехай розчинність РbІ2 − x моль/л. Враховуючи рівняння РbІ2 Pb2+ + 2I−
[Pb2+] = х моль/л;
[I−] = 2х моль/л; тоді добуток розчинності ДPРbІ2 = [Pb2+][I−]2 = x(2x)2 = 4x3.
Розчинність РbІ2 дорівнює:
х
=
![]()
![]() 1,3·10−3
моль/л.
1,3·10−3
моль/л.
Оскільки М(РbІ2) = 461 г/моль, то розчинність у г/л складає 1,3·10−3·461 =
= 0,6 г/л.
Відповідь: розчинність РbІ2 у воді дорівнює 1,3·10−3 моль/л або 0,6 г/л.
Питання і задачі
Що називається розчином? Назвати iснуючi методи вираження їх концентрацiї.
Якi методи вираження концентрацiї слід вибирати, щоб вона не змiнювалась iз змiною температури?
Які розчини називаються iдеальними? Сформулюйте закони iдеальних розчинiв.
Який фiзичний змiст ебулiоскопiчної i крiоскопiчної констант?
Визначити процентний склад 2 н. розчину Сa(OH)2 (r = 1,09 г/мл).
До 345 мл 17 %-го розчину NaOH (r = 1,1 г/мл) додали 500 мл води. Одержали розчин густиною 1,04 г/мл. Визначити його молярнiсть, нормальнiсть, титр i процентний склад.
Скiльки мiлiлiтрiв 0,2 М розчину Н2SO4 необхiдно для нейтралiзацiї 800 мл 0,1М розчину NaOH?
Тиск пари води при 50 °С дорівнює 12334 Па. Визначити тиск пари води над розчином, який містить 50 г етиленгліколю С2Н4(ОН)2 у 900 г води.
При якій температурі буде замерзати водний розчин етилового спирту, якщо масова доля його у розчині складає 25 %?
Розчин 1,05 г неелектроліту у 30 г води замерзає при температурі ‑0,7 °С. Визначити молярну масу неелектроліту.
Що таке ступінь і константа дисоціації? Напишіть рівняння дисоціації таких сполук: H2SO3, Al(OH)3, K2SO4, Na3PO4, NH4H2PO4, Al(OH)2Cl.
Які електроліти належать до слабких і які до сильних?
Сформулюйте закон розбавлення Оствальда.
Що таке позирний ступінь дисоціації?
Запишіть рівняння, яке пов’язує ступінь дисоціації, та ізотонічний коефіцієнт.
Визначити осмотичний тиск 0,01 н. розчину MgCl2 при 18 °С, якщо позирний ступінь дисоціації цього електроліту дорівнює 66 %.
Що таке іонний добуток води і pH? Вирахувати pH 0,15 н. розчину ацетатної кислоти (Kд = 1,0.10-5), 0,15 н. розчину HСl.
Визначити молярну концентрацію KOH, якщо pH розчину дорівнює 10.
Константа дисоціації HNO2 дорівнює 5,1.106. Визначити ступінь дисоціації її у 0,01М розчині і концентрацію іонів водню.
Визначити a і концентрацію іонів ОН- у 0,1 н. розчині NH4OH, якщо Кд = 1,77.10-5.
Ізотонічний коефіцієнт розчину 178,5 г KВr в 900 г H2O дорівнює 1,7. Визначити тиск водяної пари над цим розчином при 50 °С , якщо тиск пари води при 50 °С дорівнює 12334 Па.
Що називається гідролізом солей?
Чим кількісно характеризується гідроліз?
Написати реакції гідролізу Al2(SO4 )3; Na2SO 4; NH4Cl; Fe2S 3. Визначити pH розчинів.
Чому не існують розчини солей СuCO3, Al2(SO3)3, (NH4)2S ?
Розрахувати константу і ступінь гідролізу 0,1 н. розчину NH4Cl (Kд(NH4OH) = 1,8.10 –5).
Що називається добутком розчинності?
Розчинність AgCl у воді дорівнює 10-5 моль/л. Обчислити ДР(AgCl) . Як змінюється розчинність AgCl при додаванні 0,1 моля NaCl на 1 л розчину?
