
- •Нервные болезни
- •Авторский коллектив
- •Условные сокращения
- •Русскоязычные сокращения
- •Латинские сокращения
- •Предисловие
- •Глава 1. Основные этапы становления и развития отечественной неврологии
- •Вопросы для контроля
- •2.1. Развитие нервной системы эмбриона человека
- •2.2. Структурные элементы нервной системы, их морфологические и физиологические свойства
- •Вопросы для контроля
- •Глава 3. Чувствительность и ее нарушения
- •3.1. Виды чувствительности
- •3.2. Проводники чувствительности
- •3.3. Исследование чувствительности
- •3.4. Виды нарушений чувствительности
- •3.5. Варианты и типы нарушений чувствительности
- •Вопросы для контроля
- •Глава 4. Движения, рефлексы и их расстройства
- •4.1. Клиническая симптоматика и диагностика двигательных расстройств
- •4.2. Симптомы поражения корково-мышечного пути на разных уровнях
- •Вопросы для контроля
- •Глава 5. Спинной мозг и симптомы его поражения
- •5.1. Строение спинного мозга
- •5.2. Симптомокомплексы поражения сегментарного и проводникового аппаратов спинного мозга
- •5.3. Симптомокомплексы поражения спинного мозга на разных уровнях
- •Вопросы для контроля
- •Глава 6. Топическая диагностика поражений черепных нервов
- •6.1. I пара: обонятельный нерв (n. olfactorius)
- •6.2. II пара: зрительный нерв (n. opticus)
- •6.3. III пара: глазодвигательный нерв (n. oculomotorius)
- •6.4. IV пара: блоковый нерв (n. trochlearis)
- •6.5. VI пара: отводящий нерв (n. abducens)
- •6.6. Иннервация взора
- •6.7. V пара: тройничный нерв (n. trigeminus)
- •6.9. VIII пара: преддверно-улитковый нерв (n. vestibulocochlearis)
- •6.11. XI пара: добавочный нерв (n. accessorius)
- •6.12. XII пара: подъязычный нерв (n. hypoglossus)
- •6.13. Бульбарный и псевдобульбарный параличи
- •6.14. Альтернирующие синдромы поражения ствола головного мозга
- •Вопросы для контроля
- •Глава 7. Топическая диагностика поражений мозжечка, экстрапирамидной системы и подкорковых ганглиев
- •7.1. Мозжечок и симптомы его поражения
- •7.2. Экстрапирамидная (стриопаллидарная) система и симптомы ее поражения
- •7.3. Таламус
- •7.4. Внутренняя капсула
- •Вопросы для контроля
- •Глава 8. Кора больших полушарий головного мозга и симптомы ее поражения
- •8.1. Строение коры головного мозга
- •8.2. Локализация функций в коре полушарий. Понятие об анализаторах
- •8.3. Симптомокомплексы поражения долей головного мозга
- •8.4. Симптомы раздражения коры головного мозга
- •Вопросы для контроля
- •Глава 9. Топическая диагностика поражений периферической нервной системы
- •9.1. Строение и симптомокомплексы поражения разных отделов периферической нервной системы
- •9.2. Общие симптомы поражения периферической нервной системы
- •Вопросы для контроля
- •Глава 10. Вегетативная нервная система и симптомы ее поражения
- •10.1. Центральный отдел вегетативной нервной системы
- •10.2. Периферический отдел вегетативной нервной системы
- •10.3. Особенности вегетативной иннервации и симптомы ее нарушения на примере некоторых внутренних органов
- •Вопросы для контроля
- •Глава 11. Оболочки мозга и спинномозговая жидкость
- •11.1. Оболочки головного и спинного мозга
- •11.2. Желудочки головного мозга и спинномозговая жидкость
- •11.3. Исследование спинномозговой жидкости
- •Вопросы для контроля
- •Глава 12. Кровоснабжение головного и спинного мозга, симптомы его нарушения
- •12.1. Кровоснабжение головного мозга
- •12.2. Кровоснабжение спинного мозга
- •Вопросы для контроля
- •Глава 13. Методика краткого исследования в клинической неврологии
- •Вопросы для контроля
- •Глава 14. Дополнительные методы исследования в клинической неврологии
- •14.1. Клиническая электроэнцефалография
- •14.2. Магнитная диагностика
- •14.3. Электронейромиография
- •14.4. Эхоэнцефалоскопия
- •14.5. Ультразвуковая доплерография сосудов головы и шеи
- •14.6. Дуплексное сканирование сосудов шеи
- •14.7. Краниография
- •14.8. Спондилография
- •14.9. Компьютерная томография
- •14.10. Магнитно-резонансная томография
- •14.11. Магнитно-резонансная спектроскопия
- •14.12. Позитронно-эмиссионная томография
- •14.13. Методы исследования вегетативной нервной системы
- •Вопросы для контроля
- •Глава 15. Закрытая черепно-мозговая травма
- •15.1. Патогенез черепно-мозговой травмы
- •15.2. Классификация черепно-мозговых травм
- •15.3. Диагностика черепно-мозговых травм
- •15.4. Лечение черепно-мозговых травм
- •Вопросы для контроля
- •16.1. Патоморфология
- •16.3. Классификация последствий черепно-мозговой травмы
- •16.4. Клиническая картина
- •16.5. Диагностика
- •16.6. Лечение
- •Вопросы для контроля
- •Глава 17. Закрытые травмы спинного мозга
- •17.1. Классификация
- •17.2. Этиология и патогенез
- •17.3. Патоморфология
- •17.4. Клиническая картина
- •17.5. Диагностика
- •17.6. Лечение
- •Вопросы для контроля
- •Глава 18. Травматические поражения периферической нервной системы
- •18.1. Классификация
- •18.2. Клиническая картина
- •18.3. Диагностика
- •18.4. Лечение
- •18.5. Компрессионно-ишемические невропатии
- •Вопросы для контроля
- •Глава 19. Болезни периферической нервной системы
- •19.1. Радикулопатии
- •19.2. Полиневриты (полирадикулоневриты, полиневропатии)
- •19.3. Невропатия лицевого нерва
- •Вопросы для контроля
- •Глава 20. Инфекционные и паразитарные заболевания нервной системы
- •20.1. Менингиты
- •20.2. Энцефалиты
- •20.3. Нейросифилис
- •20.4. Герпетические поражения нервной системы
- •20.5. НейроСПИД
- •20.6. Паразитарные заболевания головного мозга
- •Вопросы для контроля
- •Глава 21. Демиелинизирующие заболевания
- •21.1. Рассеянный (множественный) склероз
- •21.2. Острый рассеянный энцефаломиелит
- •21.3. Другие демиелинизирующие заболевания
- •Вопросы для контроля
- •Глава 22. Сосудистые заболевания головного мозга
- •22.1. Факторы риска мозгового инсульта
- •22.2. Классификация сосудистых заболеваний головного мозга
- •22.3. Физиологические особенности мозгового кровообращения
- •22.4. Патофизиология ишемического повреждения головного мозга
- •22.5. Этиология и патогенез ишемических нарушений мозгового кровообращения
- •22.6. Острые нарушения мозгового кровообращения
- •22.7. Диагностика острых нарушений мозгового кровообращения
- •22.8. Лечение острых нарушений мозгового кровообращения
- •22.9. Профилактика острых нарушений мозгового кровообращения
- •22.10. Хронические нарушения мозгового кровообращения
- •Вопросы для контроля
- •Глава 23. Сосудистые заболевания спинного мозга
- •23.1. Этиология и патогенез нарушений спинального кровообращения
- •23.2. Преходящие нарушения спинального кровообращения
- •23.3. Ишемический спинальный инсульт
- •23.4. Геморрагический спинальный инсульт
- •23.5. Лечение спинальных инсультов
- •Вопросы для контроля
- •Глава 24. Эпилепсия и пароксизмальные расстройства сознания неэпилептической природы
- •24.1. Эпилепсия. Этиология и патогенез
- •24.2. Международная классификация эпилептических приступов (Киото, 1981) и их клиническая картина
- •24.3. Международная классификация (Нью-Дели, 1989) и клинические проявления основных форм эпилепсии
- •24.4. Диагностика эпилепсии
- •24.5. Лечение эпилепсии
- •24.6. Синкопальные состояния
- •24.7. Нарушения сознания, обусловленные недостаточностью мозгового кровообращения в вертебрально-базилярном бассейне
- •24.8. Дисметаболические состояния
- •24.9. Гипервентиляционный синдром
- •24.10. Псевдоэпилептические приступы
- •24.11. Лечение синкопальных состояний
- •Вопросы для контроля
- •Глава 25. Неврозы, астенические состояния и инсомнии
- •25.1. Неврозы
- •25.2. Неврастения
- •25.3. Истерия
- •25.4. Невроз навязчивых состояний
- •25.5. Астенические состояния
- •25.6. Инсомнии
- •Вопросы для контроля
- •Глава 26. Опухоли центральной нервной системы и сирингомиелия
- •26.1. Опухоли головного мозга
- •26.2. Опухоли спинного мозга
- •26.3. Диагностика и лечение опухолей центральной нервной системы
- •26.4. Сирингомиелия
- •Вопросы для контроля
- •Глава 27. Нейродегенеративные и наследственные заболевания с преимущественным поражением экстрапирамидной системы
- •27.1. Гепатолентикулярная дегенерация
- •27.2. Торсионная дистония
- •27.3. Хорея Гентингтона
- •27.4. Болезнь Галлервордена – Шпатца
- •27.5. Паркинсонизм
- •27.6. Множественные (системные) дегенерации
- •27.7. Миоклонус-эпилепсия
- •27.8. Генерализованный тик Туретта
- •27.9. Наследственное дрожание
- •27.10. Синдром беспокойных ног
- •Вопросы для контроля
- •Глава 28. Нарушение когнитивных функций
- •28.1. Болезнь Альцгеймера
- •28.2. Фронтотемпоральная деменция
- •28.3. Деменция с тельцами Леви
- •28.4. Сосудистые когнитивные нарушения
- •Вопросы для контроля
- •Глава 29. Нервно-мышечные заболевания
- •29.1. Миопатии
- •29.2. Миотонии
- •29.3. Миастения
- •Вопросы для контроля
- •Глава 30. Вегетативные расстройства
- •30.1. Синдромы вегетативных нарушений
- •30.2. Синдромы вегетативной гиперактивности
- •30.3. Синдромы нарушения терморегуляции
- •30.4. Синдром нарушения потоотделения
- •30.5. Гипоталамический синдром
- •30.6. Нейроэндокринные расстройства
- •30.7. Расстройства мотивации и влечения (булимия, жажда, изменение либидо и др.), сна и бодрствования
- •30.8. Периферические вегетативные синдромы
- •30.9. Болезни вегетативной нервной системы
- •Вопросы для контроля
- •Глава 31. Токсические поражения нервной системы
- •31.1. Поражения веществами нервно-паралитического действия
- •31.2. Поражения веществами общеядовитого действия
- •31.3. Отравления веществами удушающего действия
- •31.4. Отравления техническими и бытовыми жидкостями
- •31.5. Отравления этиловым спиртом
- •31.6. Отравления мышьяком, марганцем, соединениями тяжелых металлов
- •31.7. Поражения нервной системы при различных формах наркоманий (токсикоманий)
- •31.8. Синдром последствий наркомании (токсикомании)
- •31.9. Принципы терапии наркомании (токсикомании)
- •31.10. Отравления лекарственными препаратами различных групп
- •Вопросы для контроля
- •Глава 32. Радиационные поражения нервной системы
- •32.1. Этиология, патогенез и патоморфология
- •32.2. Клиническая картина
- •32.3. Лечение
- •Вопросы для контроля
- •Глава 33. Поражение нервной системы при воздействии экстремальных факторов
- •33.1. Гипоксия
- •33.2. Декомпрессия (кессонная болезнь)
- •33.3. Гипокинезия
- •33.4. Общее охлаждение
- •33.5. Перегревание
- •33.6. Вибрация
- •33.7. Шум, инфразвук и ультразвук
- •33.8. Ускорения
- •33.9. Электромагнитное излучение
- •Вопросы для контроля
- •Глава 34. Соматоневрология (неврологические расстройства при заболеваниях внутренних органов)
- •34.1. Неврологические синдромы при раке внутренних органов
- •34.2. Расстройства нервной системы при заболеваниях сердца
- •34.3. Поражения нервной системы при заболеваниях легких
- •34.4. Поражения нервной системы при заболеваниях почек
- •34.5. Поражения нервной системы при заболеваниях печени
- •34.6. Поражения нервной системы при ревматизме
- •34.7. Поражения нервной системы при сахарном диабете
- •Вопросы для контроля
- •Глава 35. Неотложные состояния в неврологии
- •35.1. Основные неврологические синдромы, требующие неотложной терапии
- •35.2. Неотложная терапия при травмах нервной системы
- •Вопросы для контроля
- •Глава 36. Нарушения сознания
- •36.1. Кома. Патогенез и классификация
- •36.2. Диагностика комы
- •36.3. Особые формы угнетения сознания
- •Вопросы для контроля
- •Глава 37. Медицинская реабилитация при заболеваниях и травмах нервной системы
- •37.1. Основные направления, принципы и формы реабилитации больных с поражениями нервной системы
- •37.2. Принципы и методология организации реабилитационного процесса
- •37.3. Медикаментозная терапия и средства реабилитации
- •37.4. Эффективность и преемственность реабилитации. Исходы
- •Вопросы для контроля
- •Литература

22.3. Физиологические особенности мозгового кровообращения
Масса головного мозга равна примерно 2 % от массы тела, а объем мозгового кровотока здорового человека составляет около 15 % циркулирующего объема крови. На удовлетворение энергетических потребностей мозга затрачивается до 20 % кислорода и до 50 % глюкозы, имеющихся в организме. Поэтому исключительно важно поддержание кровоснабжения головного мозга на постоянном уровне: в норме его параметры составляют свыше 55 мл/100 г (вещества мозга)/мин.
Регуляция кровообращения головного мозга в ответ на изменения в кровеносной системе или окружающей сосуды среде основана на трех физиологических механизмах: нейрогенном, гуморально-метаболическом и миогенном.
Нейрогенный механизм активно участвует в регуляции мозгового кровообращения, о чем свидетельствует эфферентная иннервация стенок сосудов головного мозга разного калибра – от магистральных артерий до микрососудов.
Гуморально-метаболический механизм подразделяется на два вида: один связан с регуляторной реакцией на вазоактивные вещества, которые выбрасываются в кровь различными органами и тканями, в первую очередь эндокринными железами; другой включается при изменении кислотно-основного состояния крови за счет продуктов метаболизма мозговой ткани.
Миогенный механизм базируется на особенностях сократительных свойств гладкомышечных элементов сосудистой стенки, определяющих ее способность активно отвечать на растягивающее усилие (закон Остроумова – Бейлиса). Гладкие мышцы сосудов обладают спонтанной активностью и могут действовать как механорецепторы, т. е. их растяжение приводит к возрастанию частоты генерации потенциалов действия, которые распространяются на соседние клетки, в результате чего возрастает тонус сосудов и уменьшается просвет артерии.

22.4. Патофизиология ишемического повреждения головного мозга
Церебральная ишемия развивается в результате несоответствия между имеющимся кровоснабжением и потребностями мозговой ткани в режиме форсированных нагрузок или, в последующем, фонового функционирования. Ткань головного мозга наиболее чувствительна к гипоксии и нарушению обмена глюкозы. Головной мозг получает в шесть раз больше кислорода, чем необходимо нейронам для окислительного метаболизма, однако ишемия в течение 5—10 мин приводит к некрозу ткани мозга.
Различают несколько порогов снижения кровоснабжения, после достижения которых наступают изменения в структуре и функциональной активности нервной ткани (критические уровни кровотока):
–менее 55 мл/100 г/мин – ингибирование синтеза белков;
–менее 35 мл/100 г/мин – стимуляция анаэробного гликолиза, лактатацидоз, цитотоксический отек;
–менее 25 мл/100 г/мин – выброс нейротрансмиттеров, нарушение ионного обмена, деполяризация мембран, нарушение энергетического метаболизма;
–менее 15 мл/100 г/мин – декомпенсация анаэробного гликолиза, активация каспаз и лизосомальных ферментов.
Продолжительность ишемии также определяет тяжесть и обратимость повреждения. При длительном снижении церебральной перфузии ниже 15 мл/100 г/ мин развивается необратимое повреждение – некроз ткани головного мозга. Область мозга с наиболее выраженным снижением кровотока (менее 10 мл/100 г/ мин) оказывается необратимо поврежденной в течение 5 мин (зона ядра инфаркта мозга). В течение нескольких часов зону ядра инфаркта мозга окружает ишемизированная (15–55 мл/100 г/мин), но живая ткань – зона «ишемической полутени» (зона пенамбры, периинфарктная зона), в которой еще сохранен энергетический метаболизм, выявляются лишь функциональные изменения нейронов с нарастающим снижением электрической активности. При своевременном возобновлении перфузии (до 4,5–6 ч после дебюта инсульта) функция нервных клеток в зоне «ишемической полутени» может восстановиться, при слишком длительном невозобновлении перфузии клетки в зоне «ишемической полутени» погибают.
Гибель нервных клеток в момент острой ишемии сопровождается яркой клинической картиной – нарушаются движения, чувствительность, часто изменяется уровень сознания, страдают жизненно важные функции. Важно понимать, что острую церебральную ишемию (мозговой инсульт) нельзя считать событием, прекратившим воздействие факторов риска, этиологических и патогенетических факторов острого нарушения мозгового кровообращения.
В острейшем периоде мозгового инсульта (2–3 сут после дебюта инсульта) воздействие этиологических факторов не только не прекращается, но и усиливается
дополнительными повреждающими процессами – гипоксией, гипогликемией, накоплением недоокисленных продуктов (метаболическим ацидозом), синтезом большого количества провоспалительных факторов, перифокальным или диффузным отеком мозгового вещества, вторичной гипоперфузией, связанной с механическим влиянием отека мозгового вещества на микроциркуляторное русло и расширением зоны критической ишемии, и др.
22.5. Этиология и патогенез ишемических нарушений мозгового кровообращения
Ишемическое поражение головного мозга является, как правило, вторичным. Примерно у 90 % больных оно возникает в результате изменений сердца и магистральных артерий шеи и головы на фоне атеросклероза, артериальной гипертензии, сахарного диабета, нарушения сердечного ритма и их сочетания.
В патогенезе ишемического инсульта значительная роль принадлежит фокальной ишемии, возникающей в результате снижения локального кровотока ниже критического уровня при нарушении проходимости артерии органического или функционального характера. Окклюзия артерии может развиваться внезапно или постепенно, быть полной или частичной, носить стойкий или обратимый характер. Сочетание этих факторов и каждый из них в отдельности определяют особенности развития ишемии.
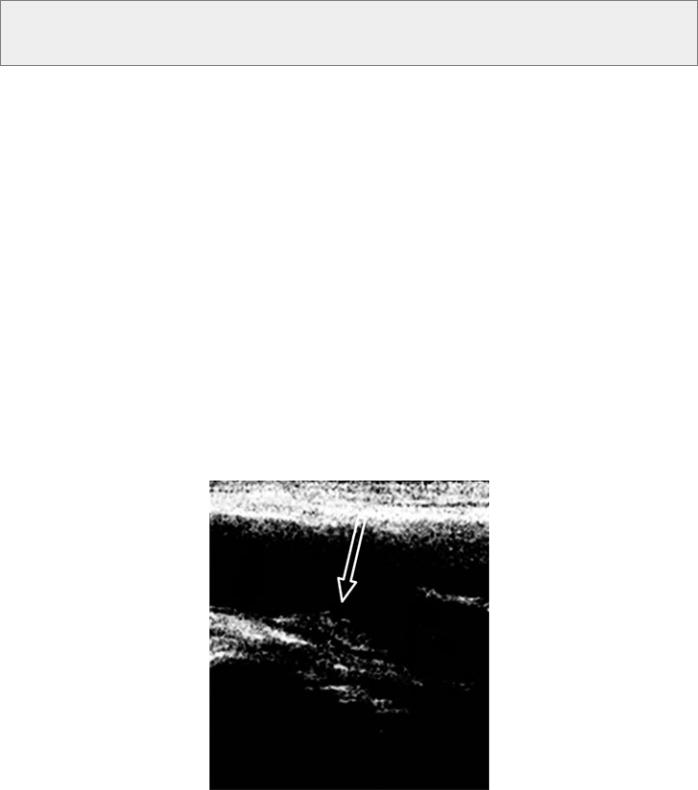
Атеротромботический инсульт развивается вследствие атеросклероза экстракраниальных и крупных интракраниальных артерий, нарушения целостности атеросклеротической бляшки и образования тромба, что приводит к полному закрытию просвета сосуда или его критическому сужению (рис. 81, 82).
Рис. 81. Дуплексное сканирование брахиоцефальных артерий. Гетерогенная атеросклеротическая бляшка в области каротидной бифуркации, стенозирующая просвет внутренней сонной артерии на 50 %
При кардиоэмболическом инсульте источником эмболии являются патологические изменения в полостях или на клапанном аппарате сердца (кардиоцеребральная эмболия). В качестве эмболов могут выступать также фрагменты тромба. Кардио-эмболический инсульт часто развивается на фоне фибрилляции предсердий, при наличии зоны акинезии или гипокинезии после
инфаркта миокарда.
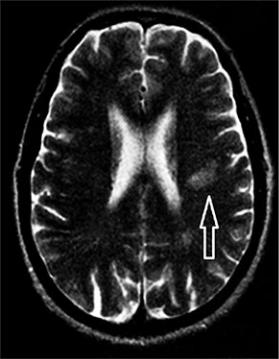
Лакунарный инсульт развивается чаще всего в результате поражения мелких внутримозговых артерий на фоне декомпенсированной артериальной гипертензии, сахарного диабета 2-го типа. Особенностью лакунарных инсультов является небольшой размер ишемического очага (менее 1,5 см) и преимущественно малый неврологический дефицит (рис. 83).
В развитии гемодинамического инсульта важную роль играет сочетание изменений (стенозов, окклюзий) магистральных артерий головы, интракраниальных сосудов и факторов, вызывающих нестабильность системной гемодинамики (гипертензия или гипотензия) с последующим нарушением церебральной перфузии.
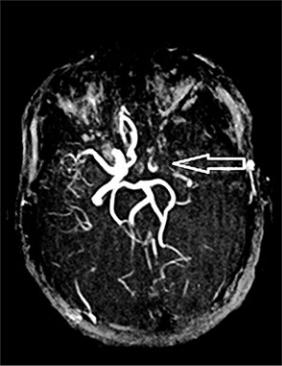
Рис. 82. Бесконтрастная трехмерная время-пролетная магнитно-резонансная ангиография сосудов головного мозга. Отсутствие MP-сигнала от тока крови дистальнее устья левой внутренней сонной артерии вследствие ее атеротромботического поражения
Иногда в развитии ишемического инсульта приобретают самостоятельное значение изменения реологических свойств крови и системы гемостаза, приводящие к окклюзии микроциркуляторного русла, – развивается инсульт по типу гемореологической микроокклюзии.
Инсульт неустановленной этиологии констатируют у пациентов с неустановленной причиной ишемического инсульта, а также у пациентов с двумя и более потенциальными причинами инсульта. Примером двух потенциальных причин инсульта может служить сочетание фибрилляции предсердий (предположительно кардиоэмболический инсульт) и стеноза сонной артерии более 50 % на стороне инсульта (предположительно атеротромботический инсульт).
Развитие инфаркта мозга условно можно разделить на три стадии.
Рис. 83. Магнитно-резонансная томография головного мозга, Т2-взвешенное изображение. Лакунарный инфаркт в глубинных отделах левой теменной доли
На первой стадии в результате гипоксии нарушается проницаемость клеточных мембран эндотелия капилляров и венул, что ведет к выходу жидкости и белковых молекул из плазмы в ткань мозга, развивается вазогенный отек.
Вторая стадия характеризуется нарастающим снижением перфузионного давления на уровне капилляров. Это приводит к нарушению функций клеточной мембраны, рецепторов и ионных каналов. Возникающая на этой стадии неврологическая симптоматика носит еще обратимый характер.
Для третьей стадии характерно появление лактацидоза, свидетельствующего о выраженных нарушениях клеточного метаболизма, который из аэробного превращается в анаэробный. Развиваются структурные повреждения. Астроциты и нейроны набухают вследствие нарушения функций клеточных мембран и повышения осмотического давления в клетке, развивается тканевый отек (отекнабухание). Для этой стадии характерно развитие очаговой неврологической симптоматики.
Из повседневной клинической практики известно, что неврологическая симптоматика, возникшая вскоре после дебюта ишемического инсульта, может значительно уменьшиться и даже полностью регрессировать. Это имеет место в том случае, когда нейроны в зоне «ишемической полутени» сохраняют структурную целостность, находясь в состоянии функционального паралича – парабиоза.
Необратимо измененная ткань (зона ядра инфаркта мозга) не может быть излечена; «мишенью» для лечения служит жизнеспособная и потенциально
восстановимая область мозга (зона «ишемической полутени»). Существование такой зоны позволяет надеяться на восстановление нарушенных функций в результате лечения. Оптимальные сроки, в которые можно добиться наибольшего терапевтического эффекта, – первые 6 ч после начала инсульта. Этот период времени называют еще «терапевтическим окном».
