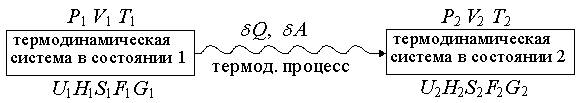- •6. Внутренняя энергия и энтальпия си, их взаимосвязь. Зависимость внутренней энергии и энтальпии вещества от температуры. Интегрирование соответствующих уравнений.
- •Следствия из закона Гесса
- •Следствия из закона Гесса
- •5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты
- •5.2.4. Математическое выражение 2 –го закона тд
- •Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Смещение химического равновесия
5.2.4. Математическое выражение 2 –го закона тд
Для каждой фазы , содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
S =
S(U,
V,
n1,
n2 ,
..nk); ![]() ,S =
,S = ![]() , S
= S2 –
S1
, S
= S2 –
S1
изменение которой следующим образом связано с теплотой и температурой процесса р
dS = ![]()
![]() для
обратимых процессов; (5.1)
для
обратимых процессов; (5.1)
dS > ![]() для
необратимых процессов.
(5.2)
для
необратимых процессов.
(5.2)
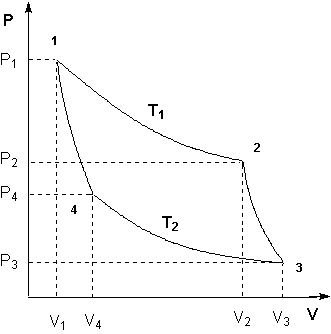
Рис. 5.1. К понятию энтропии. (цикл Карно)
Температура – интегрирующий делитель, который превратил функцию процесса в изменение функции состояния, а энтропия – тепловая координата.
Работу всегда можно выразить как произведение интенсивного параметра на изменение экстенсивного
W=
- ![]() , (5.3),
, (5.3),
а теплоту – аналогично Q = TdS – для обратимых процессов, (5.4)
где Т – интенсивный параметр, а dS изменение экстенсивного свойства.
Объединяя 1 и 2 законы термодинамики (уравнения 2.2 и 5.1), получаем
d
U
= TdS
– pdV + ![]() . (5.5)
. (5.5)
. Анализ уравнений типа (5.5) привел Каратеодори к новой формулировке 2-го закона термодинамики, не связанной с тепловыми машинами:
вблизи любого состояния термически однородной и адиабатически изолированной системы есть бесконечное множество других состояний, не достижимых адиабатическим путем. В этом случае Т становится интегрирующим делителем, а S – функцией состояния.
На
основе анализа работы идеальной тепловой
машины Карно можно сделать следующий
вывод, являющийся также одной из
формулировок второго начала
термодинамики:
^ Любая
форма энергии может полностью перейти
в теплоту, но теплота преобразуется в
другие формы энергии лишь
частично.
самопроизвольно
в изолированной системе протекают те
процессы, которые приводят к возрастанию
энтропии системы. Таким образом, второй
закон термодинамики гласит: «Если
в изолированной системе протекают
самопроизвольные процессы, то ее энтропия
возрастает» (закон
возрастания энтропии).
Если
энтропия системы в исходном состоянии
может быть выражена как: S1 =
RlnV1,
а в конечном состоянии S2lnV=R2S
= S,
то изменение энтропии в результате
протекания обратимого процесса 2 –
S1 = ![]() или
S/обратимого
процесса/ =
или
S/обратимого
процесса/ = ![]() Соответственно
для необратимого процесса
S/необратимого
процесса/
>
Соответственно
для необратимого процесса
S/необратимого
процесса/
> ![]()
Термодинамически обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Формулировки и математическое выражение второго начала термодинамики.
Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.
Процессы бывают самопроизвольные, несамопроизвольные, равновесные, неравновесные.Самопроизвольные процессы делятся на обратимые и необратимые. Второй закон термодинамики называют законом направленности процесса в изолированной системе (закон роста S). Обратимые и необратимые процессы
Необратимые процессы идут без затраты работы, протекают самопроизвольно лишь в одном направлении, это такие изменения состояния в изолированной системе, когда при обращении процессов свойства всей системы меняются. К ним относятся:
1) теплопроводность при конечной разности температур;
2) расширение газа при конечной разности давлений;
3) диффузия при конечной разности концентраций.
Обратимыми процессами в изолированной системе называются такие процессы, которые можно обратить без каких-либо изменений в свойствах этой системы.
Обратимые: механические процессы в системе, где отсутствует трение (идеальная жидкость, ее движение, незатухающие колебания маятника в вакууме, незатухающие электромагнитные колебания и распространение электромагнитных волн там, где нет поглощения), которые могут возвратиться в начальное состояние.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, Na с большой скоростью движется по поверхности, так как идет выделение водорода проверить.).
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
= (Q1 – Q2 )/Q1 = (T1 –T2)/T1 = 1 – Т2/Т1 . (5.1)
Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому.Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.
при обратимом процессе имеет место равенство Клаузиуса:
|
|
|
|
(6.5.1) |
при необратимом процессе имеет место неравенство Клаузиуса:
|
|
|
|
(6.5.2) |
Тогда для произвольного процесса,
|
|
|
|
(6.5.3) |
где знак равенства – для обратимого процесса; знак больше - для необратимого.
Значит для замкнутой системы
|
|
|
|
(6.5.4) |
Это выражение – математическая запись второго начала термодинамики.
Выражения (6.5.1) и (6.5.2) можно объединить:
|
|
|
|
(6.5.5) |
Энтропия замкнутой системы при любых происходивших в ней процессах не может убывать (или увеличивается, или остается неизменной)Как следует из соотношения (4.42), для обратимого цикла Карно справедливо равенство
|
|
(4.43) |
из которого следует:
|
|
(4.44) |
|
|
Напомним, что тепло, отданное системой, мы условились считать отрицательным. С учетом этого равенство (4.44) можно представить в виде:
![]() (4.45)
(4.45)
|
. |
|
Из соотношения (4.45) следует, что сумма приведенных теплот системы, совершившей круговой равновесный процесс, равна нулю.
|
|
Проведем ряд бесконечно близких адиабат, пересекающих линии прямого а и обратного b переходов (рис. 4.18). Эти линии разобьются на ряд бесконечно малых отрезков. Через середину каждого отрезка проведем изотермы. Тогда каждую из линий а и b можно считать состоящей из ряда бесконечно близких изотерм. Таким образом, рассматриваемый произвольный цикл представляется совокупностью циклов Карно с переменными температурами нагревателей и холодильников для каждого элементарного цикла.
Обозначим
температуры, соответствующие изотермам
расширения Т1, Т2,
… Тn,
а температуры изотерм на стадии сжатия
– ![]() .
Количества теплоты, получаемые системой
в процессе расширения на соответствующих
участках элементарных циклов Карно,
обозначим
.
Количества теплоты, получаемые системой
в процессе расширения на соответствующих
участках элементарных циклов Карно,
обозначим![]() ,
а количества теплоты, отдаваемые системой
на стадии сжатия –
,
а количества теплоты, отдаваемые системой
на стадии сжатия –![]() .
.
Количества теплоты ΔQi и ΔQ'i (i = 1, 2, … n) система получала соответственно при температурах Ti и отдавала при температурах T'i. Это, следовательно, теплоты изотермических процессов.
На основании равенства (4.45) для каждого элементарного цикла Карно справедливо
|
|
(4.46) |
Суммирование правых и левых частей полученного равенства (4.46) приводит к результату:
|
|
(4.47) |
Полученное соотношение означает, что суммы приведенных теплот перехода системы из состояния 1 в состояние 2 по пути а и по пути b равны друг другу. Следовательно, сумма приведенных теплот не зависит от пути перехода системы из одного состояния в другое, поэтому она представляет собой изменение функции состояния, которая и была названа Клаузиусом энтропией. Эту функцию обозначают буквой S, а ее изменение – ΔS. Таким образом,
|
|
(4.48) |
Следовательно, на основании проведенного обобщения для любого кругового равновесного процесса на основании (4.45) можно записать:
|
|
(4.49) |
|
|
(4.50) |
Уравнение (4.50) является математической формулой записи второго начала термодинамики для обратимых процессов.
Рассмотрим теперь необратимый процесс. Согласно (4.42) имеем:
|
|
(4.51) |
Отсюда
|
|
(4.52) |
Это означает, что энтропия системы, совершающей необратимый процесс, возрастает.
|
|
|
Возрастание энтропии может служить мерой необратимости процессов.
Второе начало термодинамики, математическое выражение для обратимых и необратимых (самопроизвольных) процессов. Энтропия как критерий равновесия и направления самопроизвольного протекания процесса в изолированной системе.
|
|
| |||||||||
|
|
|
| ||||||||
|
|
|
Второй закон термодинамики является постулатом, сформулированным на основе накопленного человечеством опыта; доказательством его справедливости служит то, что все выводы, вытекающие из него, находят экспериментальное подтверждение, и до сих пор не произошло ничего, что «запрещает» второй закон термодинамики. Из второго закона термодинамики путем несложных математических преобразований можно получить ряд следствий, которыми удобно пользоваться для определения направления процесса и условий, при которых в системе наступает равновесие. | ||||||||
|
| ||||||||||
|
| ||||||||||
Второе начало термодинамики. Самопроизвольные и несамопроизвольные процессы. Энтропия и энергия Гиббса как критерии равновесия и направления самопроизвольного процесса.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
1.Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
2.Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
3.Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
Самопроизвольные процессы – это неравновесные процессы, которые протекают без воздействия внешней силы в направлении достижения равновесия. Для проведения самопроизвольных процессов не только не затрачивается работа, но при соответствующих условиях эта система сама может произвести работу в количестве, пропорциональном происходящему изменению. Примерами самопроизвольных процессов могут служить переход тепла от более нагретого тела к менее нагретому, смешение газов, расширение газов в вакуум, превращение кинетической энергии движущегося тела в тепло и т.д. Все перечисленные процессы протекают в направлении, приближающем систему к равновесию. Обратные по направлению процессы: переход тепла от холодного тела к горячему, разделение газовой смеси, сжатие газа и т.д. удаляют соответствующие системы от равновесия и без внешнего воздействия происходить не могут, т.е. для проведения таких процессов необходимо затратить работу в количестве, пропорциональном происходящим изменениям. Такие процессы называются несамопроизвольные. Рассмотренные ранее равновесные процессы, при которых системы, бесконечно медленно изменяясь, проходят непрерывный ряд равновесных состояний, можно рассматривать в качестве промежуточных между процессами самопроизвольными и несамопроизвольными.
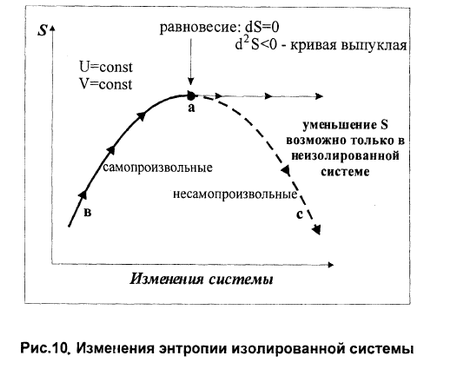
Термодинамическая система называется изолированной, если ее объем постоянен и она не обменивается с окружающей средой энергией и веществом. Если обратиться к схеме, приведенной на рис. 1.15 (см. стр. 30), то для изолированной системы: V1 = V2 = V = const U1 = U2 = U = const Критерием самопроизвольного протекания процесса в изолированной системе является энтропия. ^ В изолированной системе могут самопроизвольно протекать только те процессы, которые приводят к возрастанию энтропии в системе. Когда энтропия достигнет максимального при данных U и V значения, все процессы прекратятся, и система достигнет равновесного состояния.
|
Итак, | ||
|
если U = const и V = const, то при самопроизвольном процессе, протекающем неравновесным путем S2 – S1 > 0 dS > 0 S > 0 |
|
если U = const и V = const, то при равновесии S2 – S1 = 0 dS = 0 S = 0 |
|
В системе, не совершающей никакой работы, кроме работы расширения, и находящейся при постоянных температуре и давлении (Р = const, Т = const), самопроизвольно могут протекать только те процессы, которые приводят к уменьшению изобарно-изотермического потенциала системы (G). Когда G достигнет минимального значения при данных Р и Т, система приходит в равновесие и процесс прекращается. | ||||||
| ||||||
Объединенное уравнение I и II законов термодинамики. Энергия Гиббса и энергия Гельмгольца как критерии состояния равновесия и направления химического процесса.

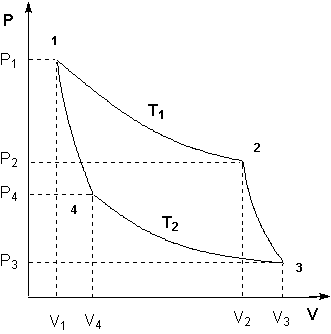 Рис.
4.17
Рис.
4.17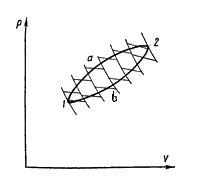 Рис.
4.18
Рис.
4.18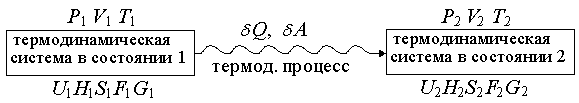 Рис.
1.15. Схема термодинамического
превращения
Если термодинамическая
система переходит из состояния 1,
характеризующегося параметрамиP1, V1, T1 и
функциями состояния U1,H1, S1, F1, G1 в
состояние 2, характеризующееся
параметрами P2, V2, T2 и
функциями
состояния U2, H2, S2, F2, G2,
самопроизвольно
Рис.
1.15. Схема термодинамического
превращения
Если термодинамическая
система переходит из состояния 1,
характеризующегося параметрамиP1, V1, T1 и
функциями состояния U1,H1, S1, F1, G1 в
состояние 2, характеризующееся
параметрами P2, V2, T2 и
функциями
состояния U2, H2, S2, F2, G2,
самопроизвольно