
- •6. Внутренняя энергия и энтальпия си, их взаимосвязь. Зависимость внутренней энергии и энтальпии вещества от температуры. Интегрирование соответствующих уравнений.
- •Следствия из закона Гесса
- •Следствия из закона Гесса
- •5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты
- •5.2.4. Математическое выражение 2 –го закона тд
- •Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Основное уравнение термодинамики. Это уравнение объединяет формулы первого и второго начала термодинамики:
- •Смещение химического равновесия
Следствия из закона Гесса
Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты химических процессов. В термохимических расчетах обычно используют ряд следствий из закона Гесса:
1. Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье – Лапласа).
2. Для двух реакций, имеющих одинаковые исходные, но разные конечные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного конечного состояния в другое.
С + О2 ––> СО + 1/2 О2 ΔН1
С + О2 ––> СО2 ΔН2
СО + 1/2 О2 ––> СО2 ΔН3
3. Для двух реакций, имеющих одинаковые конечные, но разные исходные состояния, разность тепловых эффектов представляет собой тепловой эффект перехода из одного исходного состояния в другое.
С(алмаз) + О2 ––> СО2 ΔН1
С(графит) + О2 ––> СО2 ΔН2
С(алмаз) ––> С(графит) ΔН3
4. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты.
5. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты
Стандартные теплоты образования и сгорания химических соединений. Их использование для расчета тепловых эффектов химических процессов. Как на основании экспериментальной величины стандартной теплоты сгорания какого-либо вещества рассчитать стандартную теплоту его образования? Какие дополнительные сведения необходимы для этого?
Под стандартной теплотой образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, стандартная энтальпия образования 1 моль метана из углерода и водорода равна тепловому эффекту реакции:
С(тв) + 2H2(г) = CH4(г) + 76 кДж/моль.
В литературе часто встречается другое обозначение стандартной энтальпии — ΔH298,150, где 0 указывает на равенство давления одной атмосфере (или, несколько более точно, на стандартные условия), а 298,15 — температура. Иногда индекс 0 используют для величин, относящихся к чистому веществу, оговаривая, что обозначать им стандартные термодинамические величины можно только тогда, когда в качестве стандартного состояния выбрано именно чистое вещество. Стандартным также может быть принято, например, состояние вещества в предельно разбавленном растворе.
Энтальпия образования простых веществ принимается равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при T = 298 K. Например, для йода в кристаллическом состоянии ΔHI2(тв)0 = 0 кДж/моль, а для жидкого йода ΔHI2(ж)0 = 22 кДж/моль. Энтальпии образования простых веществ при стандартных условиях являются их основными энергетическими характеристиками.
Тепловой эффект любой реакции находится как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции (следствие закона Гесса):
ΔHреакцииO = ΣΔHfO (продукты) — ΣΔHfO (реагенты)
Термохимические эффекты можно включать в химические реакции. Химические уравнения в которых указано количество выделившейся или поглощенной теплоты, называются термохимическими уравнениями. Реакции, сопровождающиеcя выделением тепла в окружающую среду имеют отрицательный тепловой эффект и называются экзотермическими. Реакции, сопровождающиеся поглощением тепла имеют положительный тепловой эффект и называются эндотермическими. Тепловой эффект обычно относится к одному молю прореагировавшего исходного вещества, стехиометрический коэффициент которого максимален.
Стандартная энтальпия сгорания — ΔHгоро, тепловой эффект реакции сгорания одного моля вещества в кислороде до образования оксидов в высшей степени окисления. Теплота сгорания негорючих веществ принимается равной нулю.
Известны теплоты образования самых разнообразных веществ из составляющих их элементов. Например:
CO2(г): 393,5 кДж/моль (из C и O2, энергия выделяется);
SiO2(тв): 859 кДж/моль (из Si и O2, энергия выделяется);
NaCl (тв): 411 кДж/моль (из моля Na и 0,5 моль Cl2, энергия выделяется) и т.д.
Опубликованы обширные таблицы теплот образования веществ. В чем же полезность этих величин? Дело в том, что теплоты образования веществ из элементов чрезвычайно удобны для расчета тепловых эффектов любых реакций, в которых эти вещества могли бы участвовать. Теплота любой реакции (даже пока не осуществленной на практике) может быть вычислена как разность между суммой теплот образования всех продуктов и суммой теплот образования всех реагентов в данной реакции.
Однако здесь необходимо строго соблюдать "правила игры", принятые в термохимии. Например, мы пишем: "C(тв)", но "твердый" углерод может быть как графитом, так и алмазом! В термохимических измерениях стандартным состоянием углерода считается графит, а не алмаз. Во-вторых, нужно договориться о температуре и давлении, при которых находятся вещества, поскольку эти параметры могут заметно влиять на величину теплового эффекта. Принято использовать теплоты образования соединений из чистых элементов в стандартных условиях. Такие стандартные условия чаще называют стандартным состоянием веществ:
1. Для твердых, жидких и газообразных веществ стандартное состояние определяется как наиболее распространенная форма элемента при 25 оС (298 К) и давлении 1 атмосфера (1 атм).
2. Теплота образования чистых элементов по определению равна нулю.
Тепловой эффект реакции не обязательно находить экспериментально, его можно рассчитать, используя стандартные теплоты образования и сгорания веществ, следуя закону Гесса.
Закон Г.И.Гесса (1840г.) заключается в следующем:
Тепловой эффект химической реакции не зависит от пути процесса, а только от вида (например, аллотропной модификации) и агрегатного состояния исходных веществ и конечных продуктов реакции.
^ Стандартная теплота сгорания показывает, сколько кДж энергии выделилось при сгорании 1 моль вещества до высших оксидов.
Теплоты сгорания негорючих веществ равна 0.
Стандартные теплоты сгорания и образования можно найти в справочных таблицах.
Расчёты теплового эффекта реакции проводятся согласно следствию из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ.
Q = ΣQ0обр (продуктов) – ΣQ0обр (исходных веществ)
Если даны стандартные теплоты сгорания, то можно использовать следующую формулу для вычисления теплового эффекта реакции:
Q = ΣQ0сгор (исходных веществ) – ΣQ0сгор (продуктов).
Тепловой эффект химической реакции как функция температуры, уравнение Кирхгофа. Характер кривых
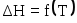 в зависимости от вида кривых
в зависимости от вида кривых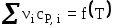 для исходных и конечных веществ.
для исходных и конечных веществ.


Вывод и анализ уравнения Кирхгофа. Использование интегральных форм уравнения для вычисления тепловых эффектов химических процессов при заданной температуре (в том числе стандартной теплоты образования при
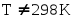 )
)
rСр = 0 rНT1= rНT2 . Теплота реакции не зависит от температуры
Ср>0, T rН Для эндотермической реакции rН2 > rН1.
Для экзотермической реакции rН2 <rН1.
Ср < 0, T rН Для эндотермической реакции rН2 < rН1.
Для экзотермической реакции rН2 >rН1.
|
| |
|
Ср rН
реагенты продукты | |
|
|
|
Т
Т
а) б)
Рис. 4.3. Зависимость теплоемкости (а) и теплоты реакции (б) от температуры
Интегрирование уравнения Кирхгоффа
Для пересчета теплоты реакции с одной температуры на другую нужно использовать определенный интеграл
![]() (4.14)
(4.14)
НТ = Н298 + ![]() = Н298 + rСр (T-298)
= Н298 + rСр (T-298)
В небольшом интервале температур rСр= const. В противном случае нужно представить rСр в виде температурного ряда и только после этого интегрировать уравнение (4.17)
![]() =
= ![]() dT
dT
rН2 = rН1 +ra(T2-T1) + rb/2 (T22 –T12) + rc/3( T23- T13) - rc'(1/T2 –1/T1).
(4.15)
4.8.6.2. Для вывода общего уравнения зависимости Н = f (T), нужно брать неопределенный интеграл
rН = rН0 + raT + rb/2 T2 + rc/3 T3 - rc'1/T. (4.16)
Постоянная интегрирования rН0 имеет смысл теплоты реакции при температуре 0 К и может быть найдена по известному значению теплоты реакции при определенной температуре, например, при 298 К
rН0 = Н298 –(ra∙298 + rb/2∙ 2982 + rc/3 ∙2983 - rc'∙1/298). (4.17)
Температурные ряды теплоемкостей могут быть оборваны на любом члене в зависимости от выбранного интервала температур: чем больше разность температур, темболшее число членов температурных полиномов следует учитывать.
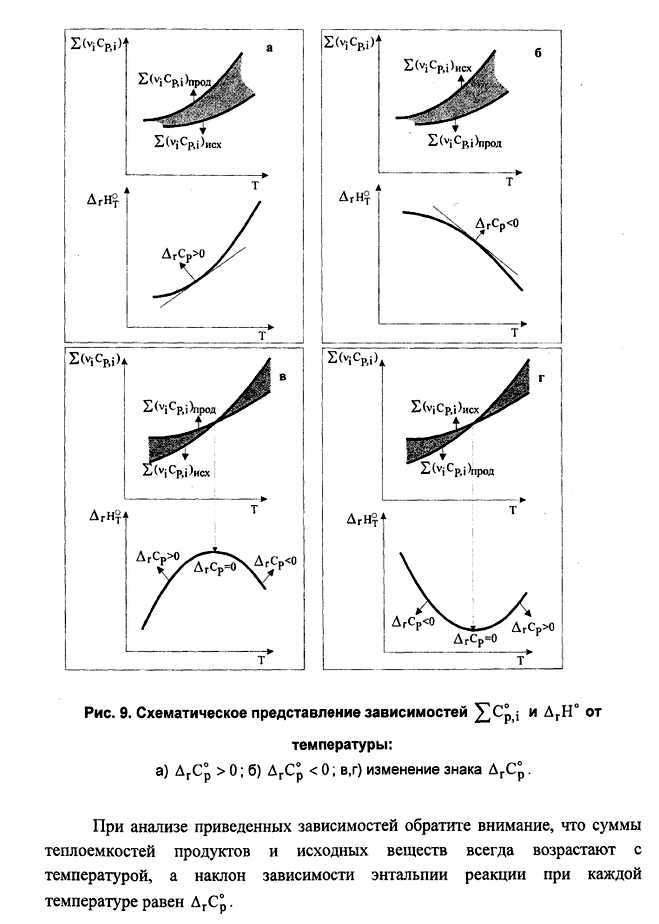
Зависимость теплового эффекта химической реакции от температуры проходит через максимум (вариант: «минимум») при Т=….К. Представьте график температурной зависимости этой функции и график зависимостей сумм теплоемкостей продуктов и исходных веществ (∑νicP,i) от температуры. Дайте необходимые пояснения.
|
| |||
|
Из
дифференциальной формы уравнения
Кирхгоффа (1.23) видно что,
влияние
температуры на тепловой эффект
обусловлено знаком величины ΔСP:
1)
если ΔСP
0, то первая производная | |||
|
|
2)
если ΔСP >
0, то первая производная | ||
|
Рис.
1.9. Зависимость ∆H
от T,
если
ΔСP
0:
а) тепловой эффект эндотермической
реакции убывает с ростом T (при
высоких T поглощается
меньше тепла);
б) тепловой эффект
экзотермической реакции с
ростом ^ T становится
более отрицательным (при высоких Tвыделяется
больше тепла) |
|
| |
|
3) если ΔСP = 0, то и тепловой эффект не зависит от температуры (рис. 1.11);
Рис. 1.11. Зависимость ∆H отT, если ΔСP =0
|
4) если величина ΔСP при высоких и низких температурах имеет разный знак, то зависимость ∆^ H от температуры имеет более сложную зависимость: кривая ∆H = f(T) проходит через максимум или минимум (рис. 1.12).
|
| |
Для расчета тепловых эффектов реакций при температурах отличных от стандартной, пользуются интегральной формой уравнений Кирхгоффа (1.25) и (1.26).
В нешироком температурном интервале (десятки градусов) можно пренебречь зависимостью теплоемкостей реагентов от температуры и считать ΔСP постоянной величиной, не зависящей от T, тогда для теплового эффекта при температуре T получаем:
![]()
где ^ T – не слишком отлична от 298 К.
При интегрировании уравнения Кирхгоффа в широком интервале температур (298 – T) пользуются температурной зависимостью теплоемкости веществ в виде степенных рядов (1.21) и (1.22), справедливых в данном температурном интервале.
В общем случае, если в реакции участвуют и органические и неорганические вещества для разности теплоемкостей конечных и начальных веществ получится выражение вида:
ΔCP = Δa + ΔвT + ΔcT2 + Δc’/T2
Тогда
для теплового эффекта при высокой
температуре T имеем:
![]()
Для некоторой реакции сумма теплоемкостей исходных веществ меньше суммы теплоемкостей продуктов. Причем при повышении температуры ΔrСр увеличивается. Изобразите схематически графики зависимости
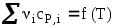 для исходных веществ и продуктов реакции
и теплового эффекта реакции от
температуры. Приведите краткое
теоретическое обоснование ответа и
соответствующие математические
выражения.
для исходных веществ и продуктов реакции
и теплового эффекта реакции от
температуры. Приведите краткое
теоретическое обоснование ответа и
соответствующие математические
выражения.Второе начало термодинамики. Энтропия, изменение энтропии в термодинамических процессах с участием идеального газа при
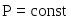 и
и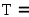
 .
.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В
состоянии с максимальной энтропией
макроскопические необратимые процессы
(а процесс передачи тепла всегда является
необратимым из-за постулата Клаузиуса)
невозможны.


Второе начало термодинамики. Энтропия. Зависимость энтропии от температуры и давления. Изменение энтропии в процессах с участием идеального газа.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии).
Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано.
В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
|
|
|
|
(6.2.1) |
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий. Исходя из этого, найдем изменения энтропии в процессах идеального газа. Так как при Т = const,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(6.2.2) |
Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2. Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
изохорический:
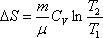 ,
т.к.
,
т.к.  ;
;изобарический:
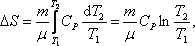 т.к. Р1 =
Р2;
т.к. Р1 =
Р2;изотермический:
 т.к.
т.к. 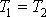 ;
;адиабатический:
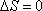 ,
т.к.
,
т.к. 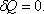
Отметим,
что в последнем случае адиабатический
процесс называют изоэнтропийным
процессом,
т.к. ![]() .
.
Второе начало термодинамики. Энтропия. Изменение энтропии в процессе смешения идеальных газов.
|
Существуют несколько эквивалентных формулировок второго начала термодинамики: Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса). Постулат Томсона: «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона). Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины забрав тепло у нагревателя, отдав холодильнику и совершив при этом работу . После этого воспользуемся процессом Клаузиуса и вернем тепло от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен. С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны.
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
«Энтропия изолированной системы не может уменьшаться» (закон неубывания энтропии). Такая формулировка основывается на представлении об энтропии как о функции состояния системы, что также должно быть постулировано. В состоянии с максимальной энтропией макроскопические необратимые процессы (а процесс передачи тепла всегда является необратимым из-за постулата Клаузиуса) невозможны Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной. Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
|


Самопроизвольные и несамопроизвольные процессы. Второе начало термодинамики. Математическое выражение 2-го закона термодинамики. Изменение энтропии в самопроизвольном процессе, протекающем в изолированной системе.
Второе начало термодинамики, которое, как и первое постулируется на основании многовекового человеческого опыта, дает возможность предсказать направление процессов. Именно второе начало позволяет разделить все процессы, которые возможны с точки зрения первого закона термодинамики, на две различные группы: самопроизвольные и несамопроизвольные. Самопроизвольные процессы – это неравновесные процессы, которые протекают без воздействия внешней силы в направлении достижения равновесия. Для проведения самопроизвольных процессов не только не затрачивается работа, но при соответствующих условиях эта система сама может произвести работу в количестве, пропорциональном происходящему изменению. Примерами самопроизвольных процессов могут служить переход тепла от более нагретого тела к менее нагретому, смешение газов, расширение газов в вакуум, превращение кинетической энергии движущегося тела в тепло и т.д. Все перечисленные процессы протекают в направлении, приближающем систему к равновесию. Обратные по направлению процессы: переход тепла от холодного тела к горячему, разделение газовой смеси, сжатие газа и т.д. удаляют соответствующие системы от равновесия и без внешнего воздействия происходить не могут, т.е. для проведения таких процессов необходимо затратить работу в количестве, пропорциональном происходящим изменениям. Такие процессы называются несамопроизвольные. Рассмотренные ранее равновесные процессы, при которых системы, бесконечно медленно изменяясь, проходят непрерывный ряд равновесных состояний, можно рассматривать в качестве промежуточных между процессами самопроизвольными и несамопроизвольными. Самопроизвольные процессы Равновесные процессы Несамопроизвольные процессы
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2). Формулировки второго закона термодинамики. Закон прошел длительный путь эволюции и сначала был сформулирован как основной закон действия тепловых машин
5.2.1. Теорема Карно (1824) “Размышление о движущей силе огня” – коэффициент полезного действия обратимого цикла, состоящего из 2 изотерм и 2 адиабат, зависит только от разности температур тепловых резервуаров и не зависит от природы рабочего тела
= (Q1 – Q2 )/Q1 = (T1 –T2)/T1 = 1 – Т2/Т1 . (5.1)
5.2.2. Томсон (лорд Кельвин) (1848) ввел понятие абсолютной температуры и (1851) сформулировал 2 закон ТД – невозможно построить периодически действующую тепловую машину, которая только бы черпала тепло из одного резервуара и производила механическую работу, т.е. невозможен вечный двигатель 2-го рода
5.2.3. Клаузиус (1850) дал первую формулировку 2 закона ТД – невозможен самопроизвольный переход теплоты от тела менее нагретого к телу более нагретому.Обе формулировки эквивалентны, одна невозможна без другой. (1854) Ввел понятие энтропии.




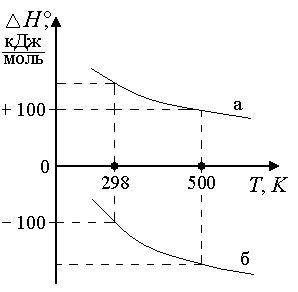
 Рис.
1.10. Зависимость ∆H
от T,
если
ΔСP >
0:
а) тепловой эффект эндотермической
реакции растет с ростом T (при
высоких Tпоглощается
больше тепла);
б) тепловой эффект
экзотермической реакции с
ростом ^ T становится
менее отрицательным (при высоких Tвыделяется
меньше тепла)
Рис.
1.10. Зависимость ∆H
от T,
если
ΔСP >
0:
а) тепловой эффект эндотермической
реакции растет с ростом T (при
высоких Tпоглощается
больше тепла);
б) тепловой эффект
экзотермической реакции с
ростом ^ T становится
менее отрицательным (при высоких Tвыделяется
меньше тепла)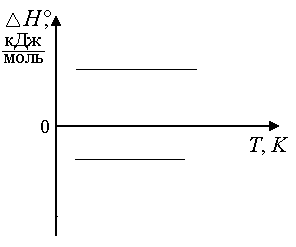
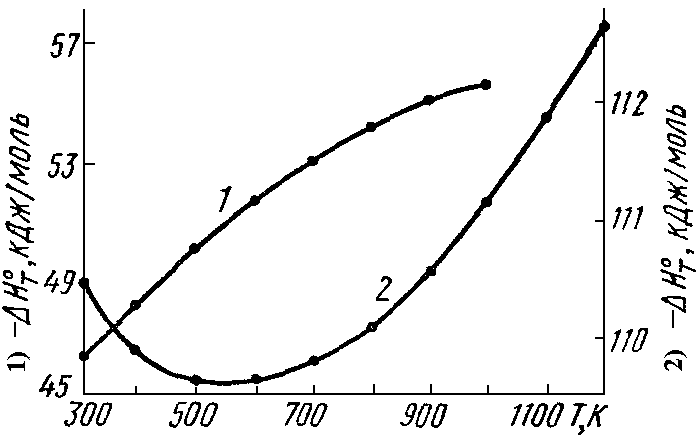 Рис.
1.12. Зависимость теплового эффекта от
температуры:
1) 3/2H2 + N2 NH3;
2) C +
1/2O2 CO
Рис.
1.12. Зависимость теплового эффекта от
температуры:
1) 3/2H2 + N2 NH3;
2) C +
1/2O2 CO