
Кардиология / нестабільна стенокардія
..pdf
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ВІННИЦЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ Ім.. М.І. ПИРОГОВА
«ЗАТВЕРДЖЕНО» на методичній нараді кафедри внутрішньої медицини № 3 Завідувач кафедри
професор, доктор медичних наук Денисюк В.І. «______»____________ 2011 р.
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДЛЯ СТУДЕНТІІВ
Навчальна дисципліна |
Внутрішня медицина |
|
Модуль № |
3 |
|
Змістовний модуль № |
1 |
(Ведення хворого з безбольовою ішемією |
Тема заняття |
6 |
|
|
міокарда. Ведення хворого з нестабільною |
|
Курс |
стенокардією). |
|
6 |
|
|
Факультет |
Медичний №1 |
|
2
Вінниця – 2011
І. Актуальність проблеми: Згідно з існуючою класифікацією до клінічних форм ішемічної хвороби серця (ІХС) належать стабільна стенокардія, безбольова ішемія міокарда, нестабільна стенокардія, інфаркт міокарда, кардіосклероз і раптова коронарна смерть. Протягом багатьох років нестабільну стенокардію розглядали як проміжний «синдром» між стабільною стенокардією і гострим інфарктом міокарда. Останнім часом з'ясували його патофізіологію і зробили значний крок уперед у веденні хворих. Зараз очевидно, що гострі коронарні синдроми (ГКС), нестабільна стенокардія та інфаркт міокарда мають спільний анатомічний субстрат – розрив атеросклеротичної бляшки або її ерозію – і відрізняються ступенем тромбозу та дистальною емболізацією.
Ці рекомендації стосуються ведення пацієнтів з підозрою на ГКС без стійкої елевації сегмента ST. Ведення пацієнтів із стійкою елевацією сегмента ST розглядається у рекомендаціях Асоціації кардіологів України з лікування гострого інфаркту міокарда.
Представлені рекомендації розроблено на базі рекомендацій Європейського товариства кардіологів, але з урахуванням реальної клінічної практики в Україні.
Рекомендації засновані на доказах, отриманих у багатьох клінічних дослідженнях, і враховують сучасні знання про ГКС. Ці дослідження проводили у відібраних популяціях пацієнтів з певними клінічними характеристиками, які не завжди відображають реальну клінічну практику лікаря.
ГКС – важлива проблема охорони здоров'я. Летальність протягом 6 міс унаслідок ГКС без елевації сегмента ST за даними Euro Heart Survey та реєстру GRACE становить 12 %. Проте результати останніх досліджень свідчать про можливість поліпшення короткострокового та тривалого прогнозу при застосуванні клінічної стратегії, яка включає ретельну стратифікацію ризику в поєднанні з використанням сучасних терапевтичних засобів та процедур реваскуляризації у відібраної групи хворих.
ІІ. Учбові цілі:
А) Студент повинен знати:
∙сучасну класифікацію ішемічної хороби серця, її основні рубрикації;
∙патофізіологічні механізми та найбільш часті етіологічні чинники ІХС;
∙діагностику різних варіантів стенокардії;
∙види нестабільної стенокардії, їх діагностику;
∙методи лабораторного та інструментального обстеження пацієнта з гострим коронарним синдромом;
∙клінічні прояви гострого коронарного синдрому;
∙інструментальні методи діагностики, діагностичні можливості та покази до проведення ЕКГ, ХМ ЕКГ, ЕхоКГ, стрес-ЕхоКС, коронарографії при безбольовій ішемії міокарду та гострому коронарному синдромі;
∙класифікацію і клінічну фармакологію антиангінальних препаратів, антиагрегантів, антикоагулянтів;
∙сучасні стандарти лікування та рекомендації щодо ведення пацієнта з гострим коронарним синдромом та безбольовою ішемією міокарда;
∙первинну та вторинну профілактику гострого коронарного синдрому;
∙хірургічні методи лікування, покази до їх застосування;
∙прогноз при різних видах ішемічної хвороби серця
А) Студент повинен вміти:
∙провести ЕКГ-діагностику стенокардії; диференціальну діагностику між різними варіантами стенокардії;
∙визначити прогностичне значення стенокардії в кожному конкретному випадку;
∙скласти схему обстеження і лікування хворого з безбольовою ішемією міокарду та нестабільною стенокардією та підібрати ефективний спосіб лікування;
∙провести диференціальну діагностику при болі в ділянці серця (різні варіанти стенокардії);
∙трактувати дані ХМ ЕКГ, ВЕМ та ЕхоКГ;
∙надати невідкладну допомогу при приступі стенокардії і визначити тактику подальшого лікування;
∙призначити обстеження і лікування різним категоріям хворих з безбольовою ішемією міокарда та нестабільною стенокардією;
∙визначити покази до хірургічного лікування при нестабільній стенокардії;
∙провести ЕКГ-діагностику різних варіантів ішемічної хвороби серця;
ІІІ.Зміст теми
КЛАСИФІКАЦІЯ ІШЕМІЧНОЇ ХВОРОБИ СЕРЦЯ
1. Раптова коронарна смерть
3
1.1.Раптова клінічна коронарна смерть з успішною реанімацією.
1.2.Раптова коронарна смерть (летальний кінець). У разі розвитку на фоні гострої коронарної недостатності або гострого інфаркту міокарда (відповідає коду I24.8 або I22 за МКХ-10).
2. Стенокардія (Відповідає коду І20 за МКХ-10)
2.1.1.Стабільна стенокардія напруження (із зазначенням I-IV ФК за класифікацією Канадської асоціації кардіологів), у пацієнтів із IV ФК стенокардія малих напружень може клінічно проявлятися як стенокардія спокою (відповідає коду I20.8 за МХК-10).
2.1.2.Стабільна стенокардія напруження при ангіографічно інтактних судинах (кардіальний синдром Х) (відповідає коду I20.8 за МХК-10).
2.2.Вазоспастична стенокардія (ангіоспастична, спонтанна, варіантна, Принцметала) (відповідає коду І20.1 за МКХ-10). 3. Нестабільна стенокардія (Відповідає коду І20.0 за МКХ-10)
3.1.Стенокардія, яка виникла вперше. Діагноз виставляється протягом 28 діб від появи першого ангінозного нападу.
3.2.Прогресуюча стенокардія (поява стенокардії спокою, нічних ангінозних нападів у хворого зі стенокардією напруження, підвищення ФК стенокардії, прогресуюче зниження толерантності до фізичного навантаження, транзиторні зміни на ЕКГ у стані спокою).
3.3.Рання постінфарктна стенокардія (від 72 годин до 28 діб). 4. Гострий інфаркт міокарда (Відповідає коду І21 за МКХ-10)
Діагноз установлюють із зазначенням дати виникнення (до 28 діб): локалізації (передня стінка, передньоверхівковий, передньобоковий, передньосептальний, діафрагмальний, нижньобоковий, нижньозадній, нижньобазальний, верхівковобоковий, базальнолатеральний, верхньобоковий, боковий, задній, задньобазаль ний, задньобоковий, задньосептальний, септальний, правого шлуночка); первинний, рецидивуючий (від 3 до 28 діб), повторний (зазначати розміри і локалізацію не обов'язково, якщо виникають труднощі в ЕКГдіагностиці).
4.1.Гострий ІМ з наявністю патологічного зубця Q (відповідає коду І21.0 І21.3 за МКХ-10).
4.2.Гострий ІМ без патологічного зубця Q (відповідає коду I21.4 за МКХ-10).
4.3.Гострий субендокардіальний ІМ (відповідає коду І21.4 за МКХ-10).
4.4.Гострий ІМ (невизначений) (відповідає коду І21.9 за МКХ-10).
4.5.Рецидивуючий ІМ (від 3 до 28 діб) (відповідає коду I22 за МКХ-10).
4.6.Повторний ІМ (після 28 діб) (відповідає коду І22 за МКХ-10).
4.7.Гостра коронарна недостатність. Діагноз попередній – елевація або депресія сегмента ST, відображає ішемію до розвитку некрозу міокарда або раптової коронарної смерті (термін до 3 діб) (відповідає коду І24.8 за МКХ-10).
4.8.Ускладнення гострого ІМ зазначаються за часом їх виникнення (відповідає коду І23 за МКХ-10): ● гостра серцева недостатність (I-IV класи за Кілліпом) (відповідає коду I50.1 за МКХ-10);
● порушення серцевого ритму та провідності (відповідає кодам I44, 145,146,147,148, I49 за МКХ-10);
● розрив серця зовнішній (з гемоперикардом – відповідає коду І23.0 за МКХ-10; без гемоперикарда – відповідає коду І23.3 за МКХ10) і внутрішній(дефект міжпередсердної перетинки – відповідає коду І23.1 за МКХ-10; дефект міжшлуночкової перетинки – відповідає коду І23.2 за МКХ-10; розрив сухожильної хорди
– відповідає коду І23.4 за МКХ-10; розрив папілярного м'яза – відповідає коду І23.5 за МКХ-10); ● тромбоемболії різної локалізації (відповідає коду I23.8 за МКХ-10);
● тромбоутворення в порожнинах серця (відповідає коду І23.6 за МКХ-10); ● гостра аневризма серця (відповідає коду I23.8 за МКХ-10);
● синдром Дресслера (відповідає коду І24.1 за МКХ-10); ● епістенокардитичний перикардит;
● постінфарктна стенокардія (від 72 годин до 28 діб) (відповідає коду I20.0 за МКХ-10). 5. Кардіосклероз
5.1.Вогнищевий кардіосклероз.
5.1.1.Постінфарктний кардіосклероз із зазначенням форми та стадії СН, характеру порушення ритму і провідності, кількості перенесених інфарктів, їх локалізації та часу виникнення (відповідає коду I25.2 за МКХ-10).
5.1.2.Аневризма серця хронічна (відповідає коду І25.3 за МКХ-10).
5.2.Дифузний кардіосклероз із зазначенням форми і стадії ХСН, порушення ритму та провідності (відповідає коду І25.1 за МКХ-10).
6. Безбольова форма ішемічної хвороби серця (відповідає коду I25.6 за МКХ-10)
Діагноз установлюють хворим з верифікованим діагнозом ІХС (за даними коронаровентрикулографії, сцинтіграфії міокарда з технецієм, стресехокардіографії з добутаміном) на підставі виявлення ознак ішемії міокарда за допомогою тесту з фізичним навантаженням або холтерівського моніторування ЕКГ.
4
Примітки
●Синдром стенокардії може супроводжувати інші захворювання, які призводять до відносної коронарної недостатності, і тоді термін «вторинна стенокардія» можна включати в діагноз після зазначення основної патології (аортальний стеноз та інші вади серця, гіпертрофічна кардіоміопатія, пролапс мітрального клапана та ін.).
●Під терміном «ішемічна кардіоміопатія» слід розуміти ІХС із встановленими за допомогою методів коронаро- і вентрикулографії дифузним ураженням коронарних артерій, вираженою дилатацією ЛШ, тотальним зниженням скоротливості міокарда, які супроводжуються клінічними ознаками СН. Термін по суті відповідає стану, який був описаний в україною та російськомовній спеціальній літературі як «ІХС з наявністю диффузного кардіосклерозу та серцевої недостатності», який звичайно спостерігається у осіб похилого віку. Проте діагноз «ішемічна кардіоміопатія» (відповідає коду 125.5 за МКХ-10) не слід використовувати без підтвердження ІХС спеціальними методами дослідження.
●За наявності різних ускладнень – як у разі гострих, так і хронічних форм ІХС (розрив серця, тромбоемболії, аритмії та ін.) – вони мають бути зазначені в діагнозі, але окремо не шифруються.
●У діагнозі зазначають лікарські втручання та час їх проведення: аортокоронарне шунтування із зазначенням числа шунтів; транслюмінальна ангіопластика та стентування із зазначенням судин, в яких проводилось втручання; балонна контрапульсація; електрофізіологічні втручання (тимчасова або постійна електрокардіостимуляція, абляція), дефібриляція.
●Розміщувати діагнози слід у такій послідовності: раптова коронарна смерть з оживленням, ІМ, ускладнення ІМ, стенокардія, різні форми кардіосклерозу, хронічна аневризма серця, порушення ритму серця і провідності, СН.
Приклади формулювання діагнозів
●ІХС: стабільна стенокардія напруження, II ФК. Стенозуючий атеросклероз ПМША та ПКА (коронарографія – 10.03.1999). Стентування ПМША (12.03.99). СН І стадії зі збереженою систолічною функцією ЛШ.
●ІХС. Стабільна стенокардія напруження, IV ФК. Стенокардія спокою. Постінфарктний кардіосклероз (Q- ІМ передньої стінки ЛШ – 23.05.1999). Хронічна аневризма ЛШ. Повна блокада лівої ніжки пучка Гіса. СН IIБ стадії із систолічною дисфункцією ЛШ.
●ІХС. Нестабільна стенокардія (прогресуюча 20.12.06) III ФК. Постінфарктний кардіосклероз (02.06.1998). Аортокоронарне шунтування (2 шунти – 12.02.1998). СН I стадії зі збереженою систолічною функцією ЛШ.
●ІХС. Безбольова форма. Шлуночкова екстрасистолічна аритмія (I клас за Лауном). Стенозуючий атеросклероз ПМША (коронарографія – 10.03.1999). СН 0.
●ІХС: Гострий ІМ з зубцем Q (трансмуральний) передньоверхівкового відділу ЛШ (05.07.2006). Гостра лівошлуночкова недостатність (клас III за Killip, 05.07.2006 – 07.07.2006; клас II за Killip, 08.07.2006 – 09.07.2006). Гостра аневризма серця. Повна блокада лівої ніжки пучка Гіса (05.07.2006). СН I стадії зі збереженою систолічною функцією ЛШ.
●ІХС: Гострий повторний ІМ (13.02.2006). Постінфарктний кардіосклероз (ІМ з зубцем Q передньої стінки ЛШ – 23.03.2002). Пароксизмальна форма фібриляції передсердь (пароксизм 13.02.2006, тахісистолічна форма). Гіпертонічна хвороба ІІІ стадії. СН ІІ А стадії зі збереженою систолічною функцією ЛШ.
●ІХС: Гострий ІМ з зубцем Q задньобазального та діафрагмального відділів ЛШ (18.05.2006). Гостра AVDблокада (ІІ ступеня 18.05.2006 – 20.05.2006; ІІІ ступеня 06.06.2006D09.06.2006). Синдром Дресслера (30.05.2006). Рецидивуючий ІМ (у зоні ураження, 05.06.2006). Тимчасова ЕКС (06.06.2006-09.06.2006). СН І стадії зі збереженою систолічною функцією ЛШ.
●ІХС: Гострий ІМ з зубцем Q передньобокового відділу ЛШ (11.01. 2007). Первинна транслюмінальна ангіопластика та стентування (11.01.2007, ПМШГ ЛКА – 2 стенти, ОГЛКА – 1 стент). Гостра лівошлуночкова недостатність (клас IV за Killip, 11.01.2007; клас II за Killip, 12.01. 2007D15.01.2007). Стійка мономорфна шлуночкова тахікардія (11.01. 2007). ЕІТ (11.01.2007). СН ІI A стадії зі збереженою систолічною функцією ЛШ.
Включення в сучасну класифікацію безбольової форми ІХС стало можливим завдяки діагностичним можливостям неінвазивних методів обстеження хворих, насамперед, навантажувальних тестів, добового моніторування ЕКГ і стрес-ЕхоКС.
Рутинним методом обстеження хворих є зареєстрована у спокої ЕКГ у 12 відведеннях, яка не завжди дозволяє виявити патологю. Значно більше діагностично вагомої інформації забезпечує ЕКГ, зареєстрована під час навантаження.
Патогномонічним для діагностики ІХС є три «кити»:
∙типовий ангінозний синдром
∙позитивна навантажувальна проба
∙стенозуючий атеросклероз коронарних артерій за даними ангіографії
Обов»язковим методом обстеження хворих є ЕхоКС і доплерографія, яка дозволяє оцінити структуру та функціональний стан міокарда. За неможливості виконання навантажувальних проб, корисну діагностичну інформацію забезпечує холтерівське моніторування ЕКГ. Для оцінки життєздатності міокарда

5
перед проведенням його ревасуляризації можуть бути застосовані стрес-ЕхоКС з добутаміном або
сцинтіграфія міокарді з технецієм.
Еталонним методом підтвердження діагнозу ІХС є ангіографія коронарних артерій із вентрикулографією.
Показання до проведення навантажувальних проб (ВЕМ, тредміл-тест):
∙діагностика хронічної форми ІХС
∙оцінка функціонального стану хворих на ІХС,пацієнтів з екстракардіальною патологією та здорових осіб, у тому числі спортсменів з больовим синдромом в ділянці серця
∙оцінка ефективності анти ішемічної терапії та реваскуляризаційних втручань у пацієнтів з ІХС
∙стратифікація ризику в пацієнтів з різними формами ІХС
Які існують протипоказання до навантажувальних проб:
Групи протипоказань |
|
Протипоказання |
Абсолютні |
∙ |
Гострий інфаркт міокарду |
|
∙ |
Нестабільна стенокардія |
|
∙ Неконтрольовані серцеві аритмії, які викликають симптоми |
|
|
|
або порушення гемодинаміки |
|
∙ Гострий ендокардит, гострий міокардит або перикардит |
|
|
∙ |
Розшаровуючи аневризма аорти |
|
∙ |
Симптомний аортальний стеноз |
|
∙ |
Некомпенсована серцева недостатність |
|
∙ Гостра емболія легень або інфаркт легень |
|
|
∙ Інфекція, ниркова недостатність, тиреотоксикоз |
|
відносні |
∙ |
Відсутність згоди пацієнта |
∙ |
Стеноз стовбура лівої коронарної артерії або еквівалентне |
|
|
|
ураження |
|
∙ Некритичний стеноз клапанів серця |
|
|
∙ |
Електролітні порушення |
|
∙ |
Тахі-або брадикаритмії |
|
∙ Фібриляція передсердь з неконтрольованою ЧСС |
|
|
∙ |
Гіпертрофічна кардіоміопатія |
|
∙ Порушення функції мозку, які роблять співпрацю з хворих |
|
|
|
неможливою |
|
∙ АВ-блокада 2 ступеня 2 типу і вище |
|
Еритерії припинення навантажувальних проб:
1.Досягнення розрахункової субмаксимальної чи максимальної ЧСС ьез клінічних ознак і ЕКГ критеріїв припинення проби
2.Депресія сегмента ST (горизонтальна або косонисхідна! 1мм)
3.Елевація ST! 1 мм у відведеннях без зубців Q (крім V1 і aVR)
4.Помірна або важка стенокардія
5.Відчуття нестачі повітря, значна задишка, ядуха
6.Відсутність підвищення систолічного АТ або його зниження > 10 мм.рт.ст. при збільшенні потужності навантаження, що супроводжується ознаками ішемії міокарда
7.Шлуночкові тахікардія, часта шлуночкові екстрасистолія, суправентрикулярна тахікардія, АВблокада 2-3 ступеня, брадиаритмія, поява блокади ніжки пучка Гіса
8.Підвищення систолічного АТ понад 230 мм.рт.ст. і/або діастолічного понад 115 мм.рт.ст.
9.Симптоми з боку ЦНС (атаксія, запаморочення, передсинкопе)
10.Ознаки недостатності периферичної перфузії (ціаноз, блідість, судоми в нижніх кінцівках, минуча кульгавість)
11.Значна слабкість, втома
12.Технічні труднощі контролю ЕКГ чи АТ
Критерії несприятливого прогнозу і/або важкості ІХс за даними навантажувальних проб
∙Тривалість НП: неможливість виконати другу сходинку навантаження на тредмілі за протоколом Bruce або менще 100 Вт при ВЕМ-пробі
∙Низька порогова частота пульсу: неможливість досягнути при максимальному навантаженні ЧСС 120 на 1 хв. (до 45 років) і 110 на 1 хв. (після 45 років)
6
∙Час появи, амплітуда та тривалість депресії ST : поява при ЧСС менше 120 за 1 хв., амплітуда більше 2 мм, наявність у кількох відведеннях ЕКГ, тривалість більше 6 хвилин
∙Реакція систолічного АТ: зменшення більше ніж на 20 мм.рт.ст. або відсутність приросту у відповідь на навантаження (не вище 150 мм.рт.ст.)
∙Інші несприятливі ознаки: підйом сегмента ST , напад стенокарді, індуковані навантаженням брадикардії або шлуночкові аритмії високих градацій
Можливості холтерівського моні торування ЕКГ в діагностиці ІХС:
∙Оцінка добової динаміки порогу у виникненні ішемії
∙Оцінка циркадних змін частоти та тривалості ішемічних епізодів
∙Оцінка сумарного тягара ішемії – загальної тривалості ішемічного епізоду
∙Показане для діагностики ІХС у таких ситуаціях (діагностика стенокардії Принцметала, діагностика ішемії міокарда при протипоказаннях чи неможливості проведення навантажувальних проб, діагностика ІХС у пацієнтів з аритміями серця, діагностика ішемії міокарді у пацієнтів, у яких ознаки ішемії з»являються в особливих ситуаціях (наприклад, статевий акт) і не відтворюються при навантажувальних пробах).
За даними холтерівського моні торування ЕКГ було встановлено, що німа ішемія може зберігатися, незважаючи на контроль стенокарді, бета-блокатори більш ефективні, ніж антагоністи кальцію для корекції німої ішемії (дослідження TIBBS, CASIS), реваскуляризація міокарда більш ефективна, ніж медикаментозна терапія,для контролю німої ішемії (дослідження АСІР).
Коронарна ангіографія – це один з ключових методів стратифікації ризику великих серцево-судинних подій у хворих на ІХС. У рекомендаціях АСС/АНА (2002) визначено такий перелік обов»язкових показань для проведення коронарографії з метою стратифікації ризику і визначення подальшої тактики лікування хворих із стенокардією:
∙Пацієнти з інвалідизуючою стабільною стенокардією (ІІІ-ІV ФК), що зберігається, незважаючи на медикаментозну терапію
∙Пацієнти з високим ступенем ризику за неінвазивними дослідженнями (ФВ менше 35%, низька толерантність до фізичного навантаження, реґіонарні порушення скоротливості міокарда при введенні малих доз добутаміну) незалежно від важкості стенокардії
∙Пацієнти із стенокардією, реанімовано після епізоду раптової серцевої смерті або які перенесли життєво небезпечні шлуночкові аритмії
∙Стенокардія з ознаками серцевої недостатності
∙Клінічні риси, що вказують на високу ймовірність важкого стенотичного враження Гострий коронарний синдром (ГКС) – це група симптомів і ознак, які дозволяють
підозрювати гострий інфаркт міокарда (ГІМ) чи нестабільну стенокардію (НС). Термін ГКС використовують при першому контакті з хворим як попередній діагноз, він включає ГКС із стійкою елевацією сегмента ST на ЕКГ і без неї. Перший у більшості випадків передує ГІМ із зубцем Q , другий – ГІМ без Q і НС (заключні клінічні діагнози).
Патофізіологія ГКС зумовлені гострим або підгострим первинним зменшенням постачання міокарда киснем, яке спричиняється розривом або ерозією атеросклеротичної бляшки, асоційованими із запаленням, стійким або нестійким тромбозом вінцевої артерії, вазоконстрикцією та мікроемболізацією.
Розрив атеросклеротичної бляшки та її ерозія Доведено, що атеросклероз – це не поступовий, лінійний процес, а скоріше захворювання з фазами стабільності та нестабільності. Раптові та непередбачувані зміни симптомів, очевидно, пов'язані з розривом атеросклеротичної бляшки. Бляшки, схильні до розриву, мають велике ліпідне ядро, низьку щільність гладком'язових клітин, високу щільність макрофагів, тонку фіброзну покришку з дезорганізованого колагену, а також високу концентрацію тканинного фактора. Ліпідне ядро формує клітинну масу всередині колагенового матриксу бляшки.
Розрив атеросклеротичної бляшки є наслідком поєднання різних факторів. Активний розрив атеросклеротичної бляшки, ймовірно, пов'язаний із секрецією протеолітичних ензимів макрофагами, які можуть послабити фіброзну покришку. Пасивний розрив бляшки зумовлено фізичними силами, які діють у місці сполучення бляшки і прилеглої «нормальної» стінки. Крім розриву бляшки, одним із основних механізмів патогенезу ГКС є ерозія бляшки, яку частіше спостерігають у жінок, пацієнтів з цукровим діабетом і артеріальною гіпертензією. Ерозія більш поширена на фоні стенозу високого ступеня, а також при локалізації стенозу в правій вінцевій артерії. Коли виникає ерозія, тромб утворюється на поверхні бляшки, а коли бляшка розривається, тромб залучає глибші її шари, аж до ліпідного ядра. Якщо цей процес не скоригувати, він може сприяти росту та швидкому прогресуванню атеросклеротичної бляшки.
7
Запалення Фіброзна покришка, як правило, має високий вміст колагену типу І, що дозволяє їй витримувати значне розтягнення стінки судини. Втім, це динамічна структура, у якій постійно підтримується рівновага між синтезом колагену, модульованого факторами росту, та його розпадом під впливом металопротеаз, які утворюються активованими макрофагами. Крім того, послабленню фіброзної покришки та розриву бляшки може сприяти апоптоз гладком'язових клітин. У патологоанатомічних дослідженнях постійно виявляють інфільтрацію бляшки макрофагами, частка яких у 6–9 разів більша у розірваних, ніж у стабільних бляшках. Присутність макрофагів свідчить про запальний процес, який також характеризується наявністю активованих Т-лімфоцитів у місці розриву бляшки. Т-лімфоцити можуть виділяти різні цитокіни, які активують макрофаги та сприяють проліферації гладком'язових клітин.
Тромбоз Тромб утворюється в місці розриву або ерозії атеросклеротичної бляшки. Він може спричиняти швидкі зміни ступеня стенозу, а також призвести до субтотальної або тотальної оклюзії судини. Тромб, який з'являється при ГКС, переважно багатий на тромбоцити. Транзиторні епізоди оклюзії або субтотальної оклюзії судин і пов'язані з цим симптоми та зміни ЕКГ можна пояснити спонтанним тромболізисом.
Тромб, який формується у місці розриву атеросклеротичної бляшки, може поділятися на невеликі фрагменти, що мігрують разом з плином крові, викликаючи оклюзію артеріол і капілярів. Ці тромбоцитарні емболи здатні спричиняти невеликі ділянки некрозу (мінімальне пошкодження міокарда, малі інфаркти) за відсутності оклюзії епікардіальної вінцевої артерії.
Вазоконстрикція Багатий на тромбоцити тромб може виділяти вазоконстрикторні субстанції, такі як серотонін і тромбоксан А2. Це зумовлює вазоконстрикцію у місці розриву атеросклеротичної бляшки або в мікроциркуляторному руслі. Описаний ефект є домінуючим у розвитку варіантної стенокардії Принцметала, що характеризується минущим, раптовим звуженням сегмента вінцевої артерії, якому не передує підвищення потреби міокарда в кисні. Ці епізоди гострої трансмуральної ішемії провокуються локалізованим коронарним вазоспазмом, який призводить до сильного звуження або оклюзії однієї чи більше великих епікардіальних вінцевих судин.
Міокард Патологоанатомічні дослідження у пацієнтів з ГКС без стійкої елевації сегмента ST дозволили виявити широкий спектр змін у міокарді, який кровопостачається ураженою судиною. Міокард може залишатися незміненим при нестабільній стенокардії або мати різний ступінь вираженості некрозу – інфаркт міокарда, що пов'язано з повторними епізодами тромботичної емболізації. Визначення рівнів серцевих тропонінів Т і І – найбільш чутливих та специфічних маркерів некрозу міокарда – є методом вибору в обстеженні пацієнтів з підозрою на ГКС. Обмежені ділянки некрозу часто не вдається виявити рутинним вимірюванням рівня креатинфосфокінази (КФК) або її ізоферменту МВ-КФК. Вміст цих ферментів може залишатися в межах норми або бути лише дещо вищим за верхню межу норми. Впровадження цих методів має велике практичне значення для виявлення хворих з підвищеним ризиком розвитку ускладнень та вибору режиму терапії.
Діагноз
Скарги Розрізняють кілька варіантів клінічного перебігу ГКС: тривалий (понад 20 хв) ангінозний біль у спокої, виникнення вперше у житті тяжкої стенокардії (ІІІ функціонального класу за класифікацією Канадського товариства із серцево-судинних захворювань) або нещодавня дестабілізація попередньо стабільної стенокардії і підвищення функціонального класу принаймні до ІІІ (прогресуюча стенокардія).
Утім, досить поширеними є атипові варіанти перебігу ГКС. Вони частіше спостерігаються у молодих (25–40 років) і літніх (понад 75 років) – пацієнтів, пацієнтів із цукровим діабетом та жінок.
Фізикальне обстеження При фізикальному обстеженні, яке включає огляд грудної клітки, аускультацію, вимірювання частоти скорочень серця і артеріального тиску, нерідко не виявляють патологічних змін. Мета обстеження – виключити наявність некардіальних причин болю в грудній клітці та неішемічних серцевих розладів (перикардит, розшаровуюча аневризма аорти, захворювання клапанного апарату, тромбоемболія легеневої артерії, пневмоторакс), а також ознак гемодинамічної нестабільності і дисфункції лівого шлуночка.
Електрокардіограма Реєстрація ЕКГ у спокої – ключовий елемент обстеження пацієнтів з підозрою на ГКС. Бажано здійснити запис ЕКГ у момент виникнення симптомів і у момент, коли симптоми зникнуть. Цінну інформацію дає порівняння з попередніми ЕКГ, особливо у пацієнтів із супутніми серцевими захворюваннями, такими як гіпертрофія лівого шлуночка або перенесений раніше інфаркт міокарда. Патологічні зубці Q, які можуть свідчити про попередній інфаркт міокарда, дозволяють зробити припущення щодо вираженого атеросклерозу вінцевих артерій, але не свідчать про нестабільність стану на момент обстеження.
Зміщення сегмента ST і зміни зубця Т є найбільш надійними електрокардіографічними індикаторами. Депресія сегмента ST більш ніж на 1 мм у двох або більше відведеннях ЕКГ, яка виникає на фоні відповідної клінічної картини, з високою імовірністю свідчить про ГКС, так само як інверсія зубців Т
8
(більш ніж на 1 мм) у відведеннях з домінуючим зубцем R, хоча і є менш специфічною. Глибока симетрична інверсія зубців Т у передніх грудних відведеннях часто пов'язана з тяжким стенозом проксимального відділу лівої передньої низхідної вінцевої артерії. Неспецифічні зміни сегмента ST і зубця Т (менш ніж на 1 мм) менш характерні для ГКС. Їх нерідко виявляють у пацієнтів, у яких іншими методами вдалося виключити нестабільну стенокардію. Інколи під час ішемічних нападів виникають епізоди блокади ніжки пучка Гіса. Слід визнати, що повністю нормальна картина ЕКГ у пацієнтів з типовими ангінозними симптомами не виключає наявності ГКС. Крім того, реєстрація нормальної ЕКГ у пацієнта з вираженим болем у грудній клітці свідчить про необхідність розгляду інших можливих причин больового синдрому.
Елевація сегмента ST свідчить про наявність трансмуральної ішемії, спричиненої оклюзією вінцевих судин. Персистуюча елевація сегмента ST характерна для формування інфаркту міокарда.
Біохімічні маркери пошкодження міокарда Для визначення некрозу міокарда зараз перевагу надають серцевим тропонінам Т або І, які є більш специфічними та надійними, ніж традиційні серцеві ферменти, такі як КФК або МВ-КФК. Будь-яке підвищення вмісту тропонінів Т або І відображає некроз клітин міокарда, а за наявності ознак ішемії міокарда (біль у грудях, зміни сегмента ST) – розвиток інфаркту міокарда.
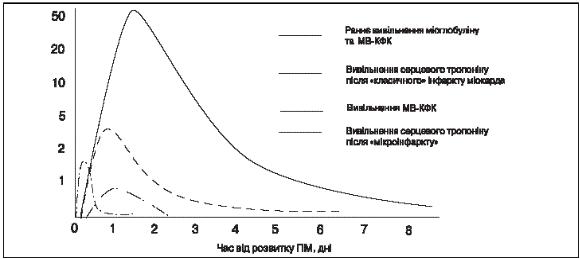
У пацієнтів з інфарктом міокарда початкове зростання концентрації тропонінів у периферійній крові спостерігається через 3–4 год та утримується впродовж 2 тиж (рис. 1). Визначення підвищеного рівня тропонінів дозволяє виявляти інфаркт міокарда приблизно у третини пацієнтів, які госпіталізуються з діагнозом нестабільної стенокардії без елевації МВ-КФК. Підвищення вмісту тропоніну може спостерігатися також при інших станах, які проявляються болем у грудній клітці, таких як розшаровуюча аневризма аорти, емболія легень, міокардит.
Рис. 1. Динаміка рівня маркерів некрозу міокарда у хворих з інфарктом міокарда
Одноразового визначення рівня тропоніну при госпіталізації пацієнта недостатньо, оскільки у 10–15 % пацієнтів зміни цього показника виявляються у подальші години. Для того щоб довести або виключити наявність пошкодження міокарда, протягом перших 6–12 год після госпіталізації або після будь-яких наступних епізодів сильного болю в грудній клітці, необхідно повторювати аналіз крові. Якщо останній епізод болю в грудній клітці стався більш ніж за 12 год до першого визначення вмісту тропоніну, друге визначення можна пропустити, за відсутності інших підстав підозрювати інфаркт.
Рекомендації У пацієнтів з підозрою на гострі форми ІХС необхідно:
1.Провести реєстрацію ЕКГ у спокої та почати тривале моніторування сегмента ST (або часто здійснювати повторні записи ЕКГ, якщо немає обладнання для моніторування).
2.Вимірювати рівень тропоніну Т або І при госпіталізації і, за наявності нормальних показників, повторити дослідження через 6–12 год.
3.Оцінювати вміст МВ-КФК потрібно у пацієнтів із повторною ішемією після нещодавно перенесеного (менш як за 2 тиж) інфаркту міокарда для виявлення рецидивів інфаркту.
Оцінка ризику Вибір стратегії ведення пацієнтів із встановленим діагнозом ГКС визначається ризиком прогресування захворювання до гострого інфаркту міокарда і смерті. Ключовими елементами оцінки ризику, окрім віку та попереднього анамнезу ІХС, є клінічне обстеження, оцінка ЕКГ, біохімічних параметрів та функціонального стану лівого шлуночка.
9
Клінічна картина Важливою інформацією для оцінки прогнозу є дані клінічної картини захворювання
– час після останнього епізоду ішемії, наявність стенокардії у спокої і реакція на медикаментозне лікування. Але для вибору оптимального лікування потрібно також брати до уваги інші індикатори ризику.
Електрокардіограма Електрокардіографія – найважливіший метод не лише для встановлення діагнозу, а й для прогностичної оцінки. У пацієнтів з депресією сегмента ST ризик подальших серцевих подій вищий, ніж у таких з ізольованою інверсією зубця Т, в яких, у свою чергу, ризик більший, ніж у випадку нормальної картини ЕКГ при госпіталізації (за винятком хворих, які раніше перенесли інфаркт міокарда із зубцем Q). Стандартна ЕКГ у спокої адекватно не відображає динамічну природу коронарного тромбозу та ішемії міокарда. Майже дві третіх епізодів ішемії при дестабілізації ІХС безсимптомні, і тому з малою ймовірністю можуть бути виявлені при звичайній реєстрації ЕКГ. Корисну інформацію може дати холтерівське моніторування ЕКГ, але його результати отримують лише через кілька годин або днів після запису. У 15–30 % пацієнтів з дестабілізацією ІХС виявляють коливання сегмента ST (переважно депресію ST). У цих пацієнтів ризик подальших серцевих подій зростає. Крім реєстрації ЕКГ у спокої та інших клінічних параметрів, незалежну прогностичну інформацію забезпечує моніторування ЕКГ. У пацієнтів з кількістю ішемічних епізодів до 2 на добу частота смерті або інфаркту міокарда через 30 діб становить 9,5 %, у пацієнтів з кількістю епізодів від 3 до 5 – 12,7 % та у пацієнтів з кількістю ішемічних епізодів понад 5 – 19,7 %.
Біохімічні маркери Пацієнти з дестабілізацією клінічного стану, в яких виявлено підвищення вмісту тропоніну, характеризуються більш несприятливим короткота довгостроковим прогнозом порівняно з хворими без елевації рівня тропоніну. Ризик нових подій корелює із ступенем підвищення цього показника. Виявлення у пацієнтів з дестабілізацією ІХС підвищення рівня тропоніну є важливим для вибору відповідного лікування. В останніх дослідженнях показано, що при його підвищенні особливо ефективними засобами є низькомолекулярні гепарини (НМГ) та інгібітори глікопротеїнових рецепторів (GP) IIb/IIIa.
Підвищення рівнів фібриногену та С-реактивного протеїну (СРП) є фактором ризику в пацієнтів з ГКС. Прогностичне значення СРП найбільше у пацієнтів з пошкодженням міокарда. Концентрації тропоніну Т і СРП є незалежними маркерами серцевої смерті при тривалому спостереженні, але їх прогностична значущість зростає при поєднаному їх визначенні, а також разом з клінічними маркерами.
Ехокардіографія Систолічна функція лівого шлуночка – важливий для оцінки прогнозу параметр, який можна легко і точно оцінити методом ехокардіографії. Під час ішемії виявляють ділянки минущої гіпокінезії або акінезії сегментів стінки лівого шлуночка, функція яких відновлюється після нормалізації кровотоку. Фонова дисфункція лівого шлуночка, а також інші стани, такі як аортальний стеноз або гіпертрофічна кардіоміопатія, мають велике значення для оцінки прогнозу та ведення хворих.
Навантажувальний тест перед випискою Після стабілізації стану перед випискою хворого верифікацію діагнозу ІХС та оцінку середньота довгострокового ризику розвитку коронарних подій необхідно здійснити за допомогою стрес-тесту.
Проба з фізичним навантаженням має високу негативну передбачувальну цінність та забезпечує додаткову інформацію для оцінки прогнозу. Чимало пацієнтів не можуть виконати пробу з фізичним навантаженням, і це само по собі свідчить про поганий прогноз. Для оцінки прогнозу в цих випадках, особливо у жінок, використовують такі методи візуалізації серця в умовах навантажувальних тестів, як перфузійна сцинтиграфія міокарда с Tl201 і ехокардіографія.
Коронарна ангіографія Це дослідження забезпечує унікальну інформацію про наявність та тяжкість ІХС. У пацієнтів з множинним ураженням коронарних судин, а також із стенозом стовбура лівої вінцевої артерії ризик тяжких серцевих подій вищий. Ангіографічна оцінка характеристики та локалізації пошкодження судин здійснюється у випадках, коли розглядають питання про необхідність реваскуляризації. Індикаторами ризику є складні, довгі пошкодження з вираженою кальцифікацією, а також підвищена звивистість судин. Але найбільшим є ризик при наявності дефектів наповнення, які вказують на внутрішньокоронарний тромбоз.
Рекомендації зі стратифікації ризику Оцінка ризику повинна бути точною, надійною і, бажано, нескладною та доступною, пов'язаною з найменшими витратами. Рекомендують такі методи:
А. Маркери ризику тромбозу, тобто короткострокового ризику:
а) рецидивування болю в грудній клітці; б) депресія сегмента ST; в) зміни в динаміці сегмента ST; г) підвищення рівня серцевих тропонінів; д) виявлення тромбу при ангіографії, ексцентричність, нечіткі контури, виразкування, нерізкість зображення та дефекти наповнення; Б. Маркери фонового захворювання, тобто довгострокового ризику:
Б1. Клінічні маркери:
а) вік; б) перенесені раніше інфаркт міокарда, шунтування вінцевих артерій, цукровий діабет, застійна серцева недостатність, гіпертензія; Б2. Біологічні маркери:
10
а) дисфункція нирок (підвищений рівень креатиніну або знижений кліренс креатиніну); б) запальні маркери (підвищення рівня СРП, фібриногену); Б3. Ангіографічні маркери:
а) дисфункція лівого шлуночка; б) ступінь ураження вінцевих артерій.
Лікування На основі результатів багатьох клінічних досліджень та метааналізів визначена ефективність різних шляхів лікування ГКС, зокрема застосування антиішемічних, антитромбінових і антитромбоцитарних засобів, фібринолітиків і коронарної реваскуляризації.
Антитромбоцитарні засоби Аспірин Ацетилсаліцилова кислота пригнічує циклооксигеназу-1 і блокує формування тромбоксану А2. Таким чином, блокується агрегація тромбоцитів, індукована через цей шлях. У рандомізованих дослідженнях аспірин зменшував ризик смерті або інфаркту міокарда у пацієнтів з нестабільною стенокардією. Дані метааналізу свідчили про те, що дози аспірину 75–150 мг були не менш ефективними, ніж більші дози. При гострому інфаркті міокарда антитромбоцитарна терапія (майже виключно аспірин) здатна зменшувати кількість судинних подій. Крім короткотривалого ефекту, аспірин забезпечує також поліпшення прогнозу при продовженні лікування. Побічні ефекти з боку шлунковокишкового тракту при застосуванні аспірину в таких низьких дозах зустрічаються відносно нечасто. До протипоказань відносять активну пептичну виразку, кровотечі, геморагічний діатез, аспіринову бронхіальну астму. З огляду на це, аспірин рекомендують призначати всім пацієнтам з підозрою на ГКС, за відсутності протипоказань і в подальшому для тривалого лікування.
Антагоністи рецепторів аденозиндифосфату: тієнопіридини Тиклопідин та його дериват клопідогрель – інгібітори аденозиндифосфату, який забезпечує агрегацію тромбоцитів. На фоні застосування тиклопідину можуть спостерігатися шлунково-кишкові розлади, алергійні реакції, нейтропенія або тромбоцитопенія. Застосування клопідогрелю супроводжується значно меншою частотою розвитку ускладнень. Ефективність клопідогрелю досліджували на фоні застосування аспірину (в дозі 75–325 мг) у пацієнтів із ГКС у великому клінічному дослідженні CURE (2001) за участю 12 562 пацієнтів. За результатами цього дослідження клопідогрель рекомендують застосовувати, починаючи з навантажувальної дози (300 мг) одноразово та у подальшому – 75 мг один раз на добу в поєднанні з підтримувальними дозами аспірину 100 мг або менше та відміняти препарат за 5 діб до проведення аортокоронарного шунтування. Цей препарат призначають як у період дестабілізації клінічного стану, так і для тривалої терапії принаймні протягом 12 міс. Клопідогрель потрібно призначати пацієнтам з ГКС, яким планують проведення ангіографії, за винятком випадків, коли ймовірне ургентне хірургічне втручання (протягом 5 днів). Клопідогрель можна також рекомендувати для невідкладної та тривалої терапії у пацієнтів, які не переносять аспірин (CAPRIE, 1996), і пацієнтів, яким встановили стент.
Блокатори глікопротеїнових рецепторів IIb/IIIa Активовані глікопротеїнові рецептори GP IIb/IIIa пов'язуються з фібриногеном, що призводить до формування містків між активованими тромбоцитами і утворення тромбоцитарних тромбів. Розроблені прямі інгібітори глікопротеїнових рецепторів IIb/IIIa. Їх ефективність оцінювали у клінічних ситуаціях, при яких велике значення надається активації тромбоцитів, зокрема під час перкутанних коронарних втручань, при ГКС. З огляду на результати рандомізованих досліджень, можливість призначення блокаторів рецепторів GP IIb/IIIa додатково до аспірину і низької дози гепарину, яку коригували залежно від маси тіла, потрібно розглядати у всіх пацієнтів з ГКС без елевації сегмента ST та з підвищеним рівнем тропоніну Т або тропоніну І, яким планують проводити ранню реваскуляризацію. Інфузія повинна тривати протягом 12 год (абсиксимаб) або 24 год (ептифібатид, тирофібан) після процедури.
Таким чином, аспірин рекомендований усім хворим з ГКС без елевації сегмента ST (при відсутності протипоказань) у початковій дозі 160–325 мг з переходом на підтримувальну дозу 75–100 мг на добу. Всім хворим показано негайне призначення навантажувальної дози клопідогрелю у дозі 300 мг та у подальшому – 75 мг один раз на добу протягом якнайменше 12 міс. При проведенні інвазивної процедури/ПТКА навантажувальна доза клопідогрелю може бути збільшена до 600 мг. Не рекомендовано застосування нестероїдних протизапальних препаратів (як селективних інгібіторів циклооксигенази-2, так і неселективних) у комбінації з клопідогрелем або аспірином. Потрійну комбінацію аспірину, клопідогрелю та антагоністів вітаміну К слід призначати тільки у випадку беззаперечних показань після оцінки розвитку кровотеч. Тривалість потрійної терапії треба скоротити до мінімального рекомендованого терміну та МНО підтримувати на мінімальному ефективному рівні.
Антитромбінові препарати Гепарин, низькомолекулярні гепарини та пентасахарид Застосування нефракціонованого гепарину (НФГ) асоціюється з нижчою частотою виникнення рефрактерної стенокардії, інфаркту міокарда і смерті порівняно з плацебо (зменшення ризику на 29 %). Великих за обсягом досліджень щодо доцільності призначення гепарину додатково до аспірину до цього часу не проведено. Незважаючи на це, у клінічних настановах рекомендують застосовувати стратегію поєднаного призначення НФГ разом з аспірином, що можна розцінювати як прагматичну екстраполяцію існуючих доказів.
