
МОЛБИОЛ 2014-лекции / ОГК / Л7-Транспорт белков-I
.pdf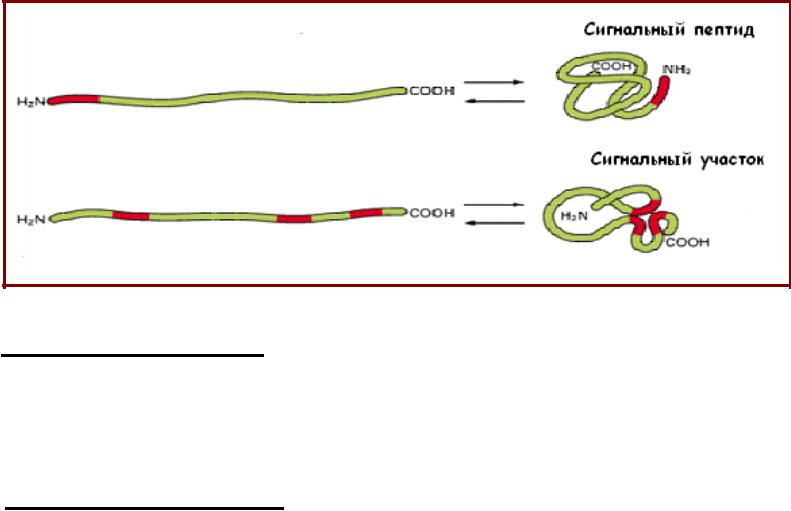
Сигнальные пептиды и сигнальные участки
•Существует два варианта транспортных сигналов:
– сигнальный пептид (signal peptide) - протяженный линейный участок ак последовательности (чаще всего длиной 15-60 остатков);
• Сигнальные пептиды направляют белки из цитозоля в ЭР,
митохондрии, хлоропласты и ядро; отвечают за то, чтобы некоторые белки остались в ЭР; чаще всего вырезаются после доставки белка в органеллу;
- сигнальный участок (signal patch) - пространственная структура, сформированная ак остатками расположенными далеко друг от друга в линейной последовательности белка;
•Сигнальные участки участвуют в ядерном транспорте белков; транспорте белков в лизосомы из аппарата Гольджи.
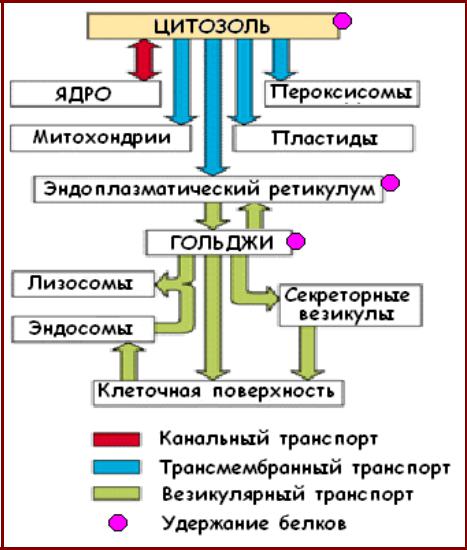
Способы и пути транспортировки белков между компартментами в клетке
Транспорт белков между компартментами:
• Транслокация через
мембраны (трансмембранный транспорт),
•Транспорт через поры
(канальный транспорт);
•С помощью транспортных
пузырьков (везикулярный транспорт)
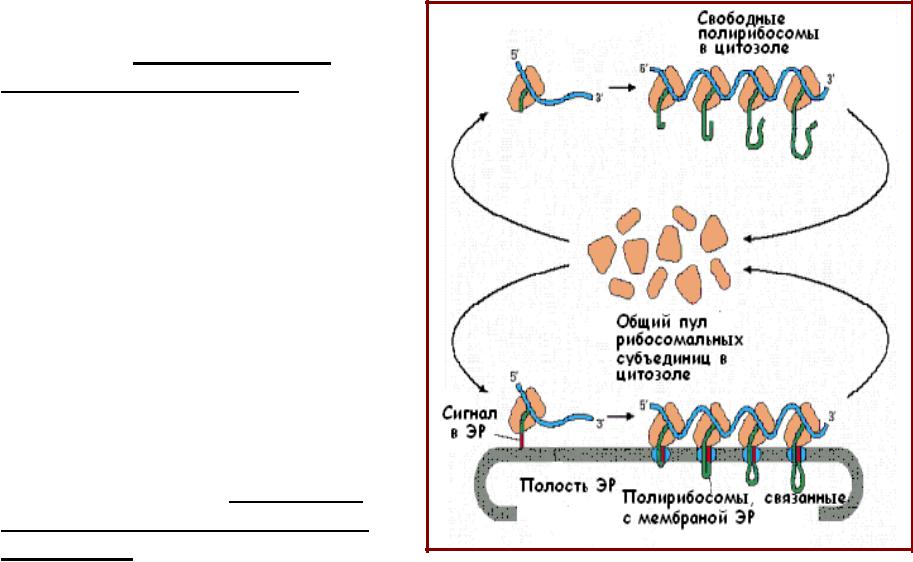
Транспорт в эндоплазматический ретикулум
•Связанные с ЭР и свободные рибосомы идентичны по строению и функциям; они различаются только по белкам, которые синтезируют в данный момент;
•Все вновь синтезированные белки, идущие по секреторному пути транспорта, независимо от их места назначения (полость ЭР, аппарат Гольджи, лизосомы, внеклеточное пространство, плазматическая мембрана) синтезируются рибосомами, расположенными на шероховатом ЭР и сначала поступают в полость ЭР из цитозоля.
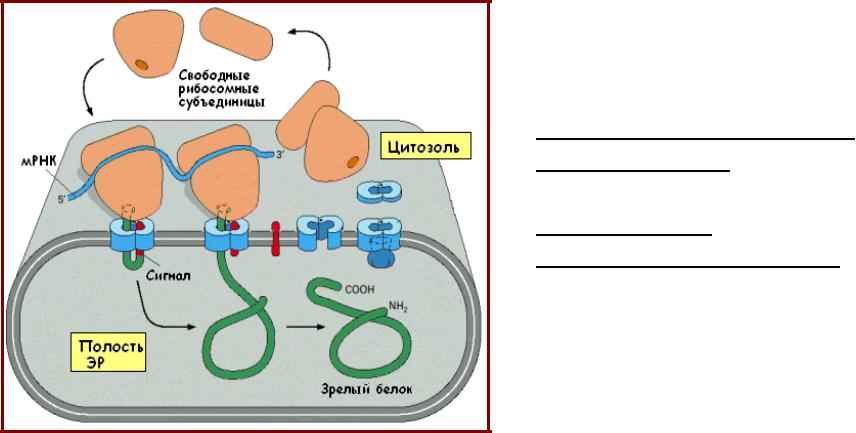
Сигнальный транспорт в ЭР
• Хотя свободные
(цитозольные) рибосомы функционально эквивалентны мембранносвязанным рибосомам, эти два типа рибосом синтезируют различные классы белков, что определяется сигнальными последовательностями, имеющимися в белке;
• В клетках эукариот
импорт белков в ЭР происходит одновременно с трансляцией (котрансляционно).
Сигнальные последовательности,
направляющие белки в ЭР
Preproalbumin Met-Lys-Trp-Val-Thr-Phe-Leu-Leu-Leu-Leu-Phe- Ile-Ser-Gly-Ser-Ala-Phe-Ser Arg . . .
Pre-IgG |
Met-Asp-Met-Arg-Ala-Pro-Ala-Gln-Ile-Phe-Gly- |
light chain |
Phe-Leu-Leu-Leu-Leu-Phe-Pro-Gly-Thr-Arg-Cys Asp . . |
Prelysozyme |
Met-Arg-Ser-Leu-Leu-Ile-Leu-Val-Leu-Cys-Phe- |
|
Leu-Pro-Leu-Ala-Ala-Leu-Gly Lys . . . |
•Белки, которые должны попасть в ЭР, несут N-концевой сигнальный пептид, состоящий из 15-30 ак остатков;
•Сигнальные пептиды отличаются по первичной ак последовательности, но всегда их центральная часть образована 8-15 гидрофобными ак остатками;
•N-концевой участок содержит полярные и иногда заряженные ак остатки;
•1-2 заряженных ак остатка находятся сразу после сигнальной последовательности;
•Предполагается, что гидрофобный участок сигнальной последовательности формирует альфа-спираль.
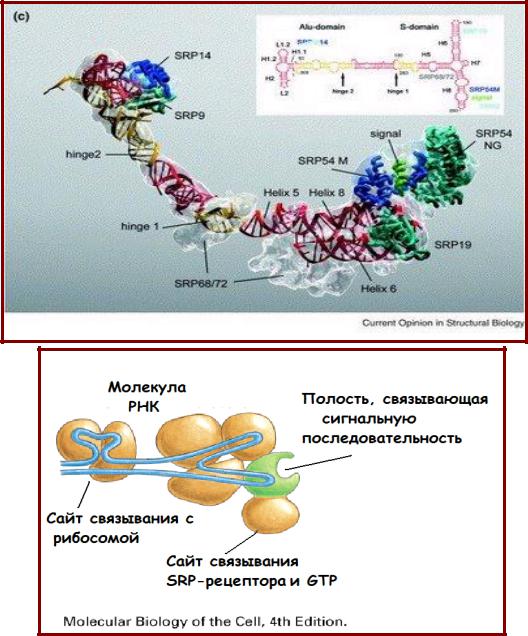
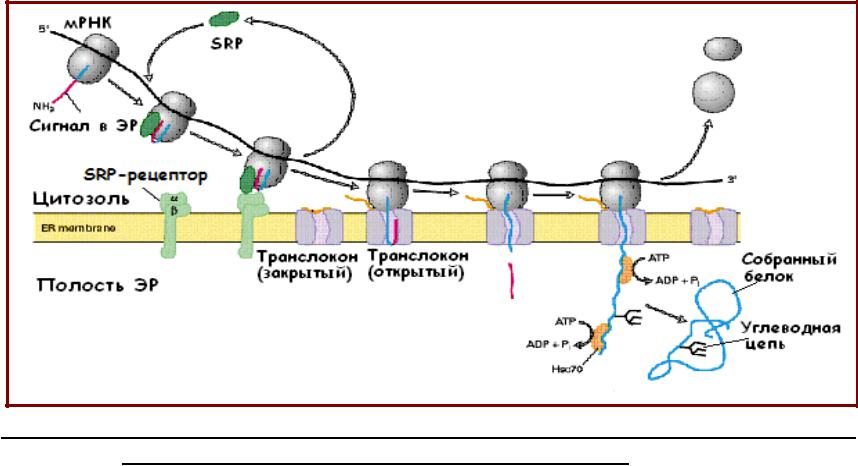
SRP (signal-recognition particle)
•Частица, распознающая сигнал (signal-recognition particle, SRP) распознает сигнальную последовательность растущего белка;
•SRP состоит из РНК
(300 н.о.) и шести белков;
•Сигнал-связывающий домен имеет полость, выложенную гидрофобными ак, среди них много Met;
•SRP связывается с
сигнальным пептидом,
рибосомой и
SRP-рецептором, расположенным на внешней поверхности шероховатого ЭР;
•Связывание инициирует процесс транслокации белка в полость ЭР.
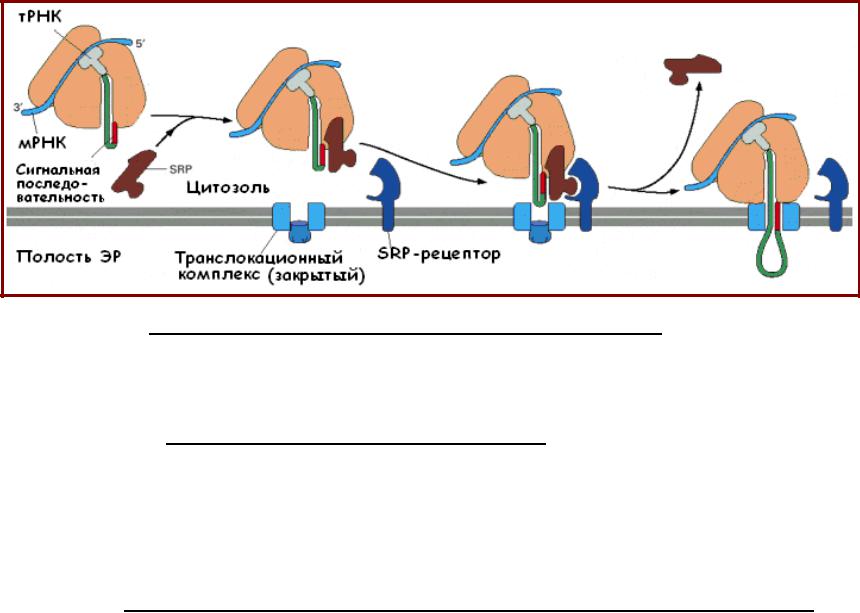
Транслокация белков в ЭР
•Связывание SRP с сигнальным пептидом и рибосомой вызывает остановку в синтезе белка после полимеризации примерно 70 ак остатков;
•Комплекс рибосома-SRP связывается с SRP-рецептором на мембране ЭР, и затем с транслокационным комплексом на поверхности ЭР;
•SRP и SRP-рецептор освобождаются из комплекса; транслокационный комплекс открывается, идет транслокация белка в полость ЭР;
•SRP и обе цепи SRP-рецептора несут GTP-связывающие домены; конформационные изменения, происходящие во время цикла связывания и гидролиза GTP, обеспечивают освобождение SRP и SRPрецептора только после связывания рибосомы с транслокационным комплексом.
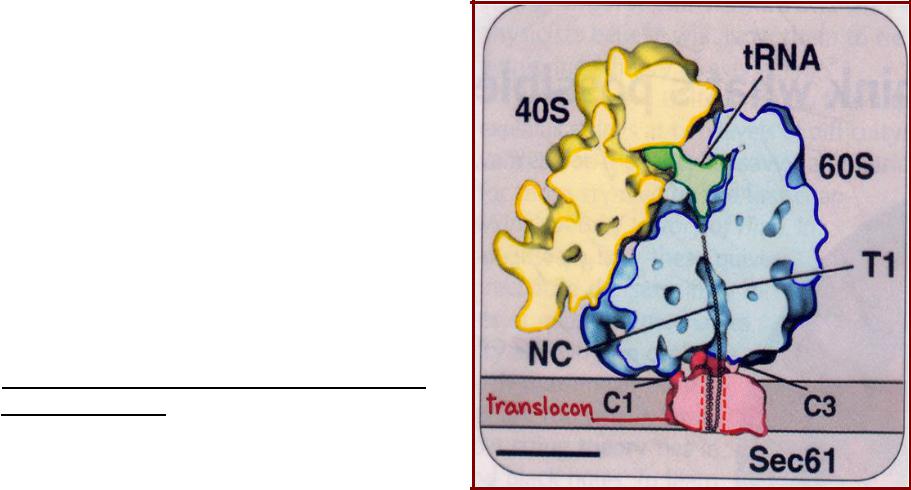
•В формировании транслокона основную роль играет комплекс белков Sec61
-у млекопитающих этот комплекс состоит из трансмембранных белков
Sec61α, Sec61β, Sec61γ
формирующих канал в виде тора;
•Для транспорта большинства белков в ЭР необходим трансмембранный белок TRAM
(translocating chain associated membrane protein);
•При связывании с рибосомой, несущей полипептид, «открывается» канал и формируется тесный контакт между рибосомой и транслоконом;
•Сигнальный пептид связывается с транслоконом, растущий полипептид транслоцируется через канал в ЭР;
•Требуется гидролиз GTP.
Транспорт белка в ЭР через транслокационный комплекс (транслокон)
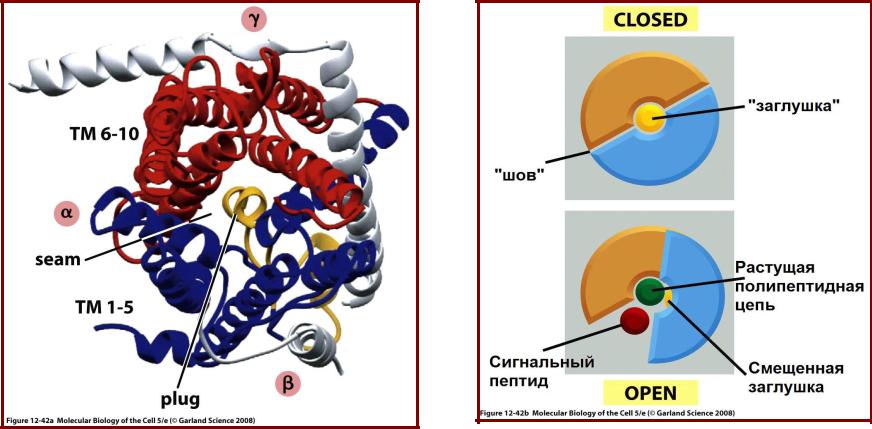
Структура комплекса Sec61
Структура комплекса Sec61
архебактерии Methanococcus (вид
на мембрану со стороны цитозоля)
Sec61α – показан синим и красным;
Sec61β и Sec61γ – серым.
Модель работы транслокона
Маленький спиральный участок (показано желтым) работает как заглушка. При открывании транслокона этот участок сдвигается в сторону.
Транспорт белков в полость ЭР
•Сигнальная последовательность узнается и специфически связывается дважды – с SRP и с транслокационным комплексом;
•Большинство сигнальных пептидов удаляется сигнальной пептидазой, связанной с внутренней мембраной ЭР;
•Присутствия сигнального пептида недостаточно для работы пептидазы – нужен рядом сайт разрезания;
•Параллельно с транслокацией белка происходит его модификация и фолдинг.
