
Volume1
.pdf
118 Часть 1. Введение в мир клетки
сколь быстро они объединились, что и предотвращает образование неправильных и нежелательных комплексов между несоответствующими друг другу молекулами, как например, между ферментом и молекулой, не являющейся его субстратом.
2.2.8. Возможность протекания реакции определяется сопряженным с ней изменением свободной энергии
Теперь мы ненадолго отступим от основной темы, дабы напомнить читателю некоторые начала химии. Клетки суть химические системы, которые должны подчиняться всем химическим и физическим законам. Хотя ферменты и ускоряют реакции, они не могут сами по себе (своими силами, без посторонней помощи) сделать так, чтобы энергетически неблагоприятные реакции произошли. Прибегнув к аналогии с водой, можно сказать, что ферменты не могут заставить воду течь вверх по руслу. Клетки, однако, чтобы расти и делиться, должны делать именно это: строить высокоупорядоченные и богатые энергией молекулы из мелких и простых молекул. Мы увидим, что все это происходит благодаря ферментам, которые непосредственно сопрягают энергетически благоприятные реакции, в ходе которых высвобождается энергия и выделяется теплота, с энергетически неблагоприятными реакциями, в ходе которых создается биологический порядок.
Прежде чем мы изучим, за счет чего достигается такое сопряжение, нам следует более тщательно рассмотреть термин «энергетически благоприятный» («energetically favorable»). Согласно второму закону термодинамики, химическая реакция может самопроизвольно протекать лишь в том случае, если она ведет в итоге к возрастанию беспорядка во Вселенной (см. рис. 2.38). Критерий возрастания беспорядка во Вселенной наиболее удобно выразить в единицах величины, называемой свободная энергия, G, системы. Значение G представляет интерес только тогда, когда система претерпевает изменение, и изменение G, обозначаемое G (дельта G), является определяюще важ-
ным. Предположим, что рассматриваемая нами система представляет собой сообщество молекул.
Как следует из приложения 2.7
(стр. 184–185), свободная энер-
гия была определена таким обра-
зом, что G – прямая мера количества беспорядка, создаваемого во Вселенной, когда имеет место реакция, в которой участвуют данные молекулы. Энергетиче-
ски благоприятными реакциями,
по определению, считаются те, что уменьшают свободную энергию; иначе говоря, они имеют отри-
цательную G и дезорганизуют Вселенную (рис. 2.50).
Рис. 2.50. Различие между энергетически благоприятной и энергетически неблагоприятнойреакциями.

Глава 2. Химия клетки и биосинтез 119
Рис. 2.51. Принцип использования сопряженных реакций для осуществления энергетически неблагоприятных реакций.
Примером энергетически благоприятной реакции в макроскопическом масштабе служит «реакция», в ходе которой сжа-
тая пружина возвращается в растянутое состояние, высвобождая
в окружающую среду запасенную в ней энергию упругости в виде теплоты; в качестве примера в микроскопическом масштабе
приведем процесс растворения соли в воде. Наоборот, энергети-
чески неблагоприятные реакции
с положительным G — такие как соединение двух аминокислот с образованием пептидной связи — без привлечения сил извне порождают порядок во Вселенной. Поэтому такие реакции возможны только в том случае,
если будут сопряжены с какой-либо реакцией, характеризующейся столь большим отрицательным значением G, что значение G для всего процесса в целом будет отрицательным (рис. 2.51).
2.2.9. Концентрация реагентов влияет на изменение свободной энергии и на направление протекания реакции
Как только что было описано, реакция Y ↔ X протекает в направлении Y → X, когда этот процесс сопряжен с отрицательным значением изменения свободной энергии G, — так же как и сжатая пружина, будучи предоставлена сама себе, разожмется и потеряет запасенную в ней энергию во внешней среде в виде выделившейся теплоты. В случае химической реакции, однако, G зависит не только от энергии, запасенной в каждой отдельной молекуле, но также и от концентрации молекул в реакционной смеси. Вспомним, что G отражает степень, с которой реакция создает более неупорядоченное — другими словами, более вероятное — состояние Вселенной. Если вспомнить приводимую нами ранее аналогию с монетами, то становится весьма вероятным такое событие, когда некоторая монета изменит свою ориентацию с орла на решку, если во встряхиваемом ящике находится 90 орлов и 10 решек; однако это событие станет менее вероятным, если ящик будет содержать 10 орлов и 90 решек.
То же самое верно и для химической реакции. В случае обратимой реакции Y ↔ X при большом избытке Y над X реакция будет преимущественно проходить в направлении Y → X; то есть система будет стремиться к такому состоянию, чтобы в ней было

120 Часть 1. Введение в мир клетки
больше молекул, осуществляющих переход Y →X, чем молекул, совершающих переход X → Y. Если отношение Y к X увеличивается, то G становится более отрицательным для перехода Y → X (и более положительным для перехода X → Y).
Какая разность концентраций необходима, чтобы компенсировать данное уменьшение энергии химических связей (и сопутствующее высвобождение теплоты)? Ответ интуитивно не очевиден, но эта разность может быть определена из термодинамического анализа, который позволяет разделить зависимые от концентрации и независимые от концентрации части уравнения изменения свободной энергии. Выражение G для данной реакции можно, таким образом, записать в виде суммы двух частей: первая, называемая изменением стандартной свободной энергии G°,
зависит от индивидуальных характеристик реагирующих молекул; вторая зависит от их концентраций. Для простой реакции Y → X при 37 °C







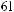










 ,
,
где G выражено в килокалориях на моль, [Y] и [X] обозначают концентрации веществ Y и X, ln — натуральный логарифм, а постоянный коэффициент 0,616 равен RT: произведению универсальной газовой постоянной R и абсолютной температуры T.
Обратите внимание, что в том случае, когда молярные концентрации Y и X равны (lg 1 = 0), G равно величине G°. Как и следовало ожидать, по мере уменьшения величины отношения X к Y G становится более отрицательным (десятичный логарифм любого числа < 1 отрицателен).
Из вышеприведенного уравнения видно, что G равно величине G°, когда концентрации Y и X равны. Но по мере протекания благоприятной реакции Y → X концентрация продукта X возрастает, а концентрация субстрата Y снижается. В результате такого изменения относительных концентраций отношение [X]/[Y] становится все больше и больше, а изначально благоприятное G — все менее и менее отрицательным. В конечном счете, когда G = 0, будет достигнуто химическое равновесие; здесь концентрационный эффект в точности уравновешивает тот импульс, которым «обеспечила» реакцию величина G°, и соотношение концентраций субстрата и продукта достигает постоянного значения (рис. 2.52).
Как долго будет протекать реакция, прежде чем она остановится, достигнув равновесия? Прежде чем обращаться к этому вопросу, нам следует ввести понятие константы равновесия, K. Для различных реакций значение K разное, и оно отражает величину отношения концентраций продукта к субстрату в точке равновесия. Для реакции Y → X
.
Уравнение, которое связывает G с отношением концентраций [X]/[Y], позволяет нам напрямую связать G° с K. Поскольку в состоянии равновесия G = 0, постольку концентрации Y и X в этой точке таковы, что








 или
или 






 .
.
Из последнего уравнения мы можем проследить зависимость равновесного соотношения X к Y (выраженного в виде константы равновесия K) от природы

Глава 2. Химия клетки и биосинтез 121
Рис. 2.52. Химическое равновесие. Когда реакция достигает равновесия, прямой и обратный потоки реагирующихмолекулравныивзаимнопротивоположны.
молекул, которая выражается величиной G° (таблица 2.4). Обратите внимание, что на каждые 1,4 ккал/моль (5,9 кДж/моль) разности свободной энергии при 37° C, константа равновесия изменяется в 10 раз.
Когда тот или иной фермент (или вообще любой катализатор) понижает энергию активации реакции Y → X, он понижает также и энергию активации реакции X → Y, причем в такой же степени (см. рис. 2.44). Протекающие в прямом и обратном направлениях реакции будут поэтому ускоряться ферментом в одно и то же количество раз, и точка равновесия для реакции (и G°) останется неизменной
(рис. 2.53).
2.2.10. В случае последовательных реакций значения G° попросту складываются
Мы можем количественно предсказать направление протекания большинства реакций. Собрано огромное количество термодинамических данных, на основании

122 Часть 1. Введение в мир клетки
Таблица 2.4. Соотношение между изменением стандартной свободной энергии ΔG°и константой равновесия
КОНСТАНТА РАВНОВЕСИЯ |
СВОБОДНАЯ ЭНЕРГИЯ X |
||
|
|
|
МИНУС СВОБОДНАЯ ЭНЕРГИЯ Y, |
|
|
|
ккал/моль (кДж/моль) |
105 |
|
–7,1 (–29,7) |
|
104 |
|
–5,7 (–23,8) |
|
103 |
|
–4,3 (–18,0) |
|
102 |
|
–2,8 (–11,7) |
|
101 |
|
–1,4 (–5,9) |
|
1 |
|
0 (0) |
|
10–1 |
1,4 (5,9) |
||
10–2 |
2,8 (11,7) |
||
10–3 |
4,3 (18,0) |
||
10–4 |
5,7 (23,8) |
||
10–5 |
7,1 (29,7) |
||
Примечания:
1.Значения константы равновесия вычислены для простой химической реакции Y ↔ X по уравнению, приведенному в тексте.
2.Указанная здесь величина G° выражена в килокалориях на моль при 37° C, а в круглых
скобках — в килоджоулях на моль (1 ккал = 4,184 кДж). Как объясняется в тексте, G° представляет разность свободной энергии при нормальных условиях (где все компоненты присутствуют в концентрации 1,0 моль/литр).
3. Из этой таблицы мы видим, что при благоприятном стандартном изменении свободной энергии ( G°), равном –4,3 ккал/моль (–18,0 кДж/моль), для перехода Y → X в точке равновесия (K = 1 000) молекул в состоянии X будет в 1 000 раз больше, чем в состоянии Y.
которых можно вычислить стандартное изменение свободной энергии G° для большинства важных метаболических реакций, происходящих в клетке. Полное изменение свободной энергии в метаболическом пути в таком случае есть не что иное, как попросту сумма изменений свободной энергии на каждом из составляющих его
Рис.2.53.Ферментынемогутизменитьточкуравновесияреакций.Ферменты,подобновсемкатализа-
торам,вравнойстепениувеличиваютскоростьпрямойиобратнойреакций.Поэтомукакдлякатализируемой,такидлянекатализируемойреакций,показанныхнарисунке,числомолекул,претерпевающих
переходX→Y,равночислумолекул,участвующихвпереходеY→X,когдаотношениечисламолекулY кчислумолекулXсоставляет3,5к1.Другимисловами,этидвереакциидостигаютравновесияводной итойжеточке.

Глава 2. Химия клетки и биосинтез 123
шагов. Рассмотрим, например, две последовательные реакции: X → Y и Y → Z,
значения G° которых равны соответственно +5 и –13 ккал/моль. (Вспомним, что один моль любого вещества содержит 6·1023 молекул этого вещества.) Если обе эти реакции происходят последовательно, то G° сопряженной реакции будет составлять –8 ккал/моль. Таким образом, неблагоприятная реакция X → Y, которая не произошла бы самопроизвольно, может протекать за счет благоприятной реакции Y → Z при условии, что эта вторая реакция сопровождает первую.
Поэтому в клетке энергетически неблагоприятное превращение X → Y может произойти, если фермент, катализирующий реакцию X → Y, дополняется вторым ферментом, который катализирует энергетически благоприятную реакцию Y → Z. По сути, реакция Y → Z будет в данном случае действовать как «сифон», чтобы обеспечить превращение всех молекул X в молекулы Y и далее — в молекулы Z (рис. 2.54). Например, некоторые реакции на длинном пути превращения сахаров в CO2 и H2O были бы энергетически неблагоприятны, будь они взяты сами по себе. Но тем не менее этот путь претворяется в жизнь, потому что значение общего G° для цепочки последовательных реакций имеет большую отрицательную величину.
Рис.2.54.Энергетическинеблагоприятнаяреакцияможетосуществлятьсязасчетвторой,сопутствую-
щей,реакции.а)ВсостоянииравновесиявсистеменаходитсявдвоебольшемолекулX,чеммолекулY, потому что соединение X имеет более низкую энергию, чем соединение Y. б) В состоянии равновесия всистемеимеетсяв25разбольшемолекулZ,чеммолекулY,потомучтоZимеетнамногоболеенизкую энергию, чем Y. в) Если реакции а и б сопряжены, то почти все молекулы X будут превращены в молекулыZ,какпоказанонарисунке.

124 Часть 1. Введение в мир клетки
Но формирование последовательного пути целесообразно далеко не во всех случаях. Зачастую желательный путь — просто X → Y, без дальнейшего преобразования Y в какой-либо другой продукт. К счастью, существуют иные, более общие способы использования ферментов для сопряжения реакций в едином процессе. На чем они основаны — тема, которую мы обсуждаем далее.
2.2.11. Для биосинтеза нужны активированные молекулы-носители
Энергия, высвобождаемая в ходе окисления молекул пищи, должна быть временно запасена, прежде чем будет направлена на строительство множества других молекул, необходимых клетке. В большинстве случаев энергия запасается в форме энергии химических связей в ограниченном наборе активированных «молекулносителей», содержащих одну или более богатых энергией ковалентных связей. Эти молекулы быстро распространяются по всей клетке и таким образом переносят запасенную в них энергию связей из мест ее выработки к участкам, где эта энергия потребляется для биосинтеза и других процессов, протекающих в клетке (рис. 2.55). Активированные носители запасают энергию в легко изменяемой форме — или
ввиде легко переносимой химической группы, или в виде электронов высокой энергии — и могут выполнять двоякую роль в реакциях биосинтеза: источника и энергии, и химических групп. По традиции эти молекулы иногда называют также коферментами. Важнейшие из активированных молекул-носителей — это ATP и еще две молекулы, состоящие в близком родстве друг с другом: NADH и NADPH, о которых мы вскоре поговорим подробнее. Мы увидим, что клетки используют активированные молекулы-носители словно деньги для оплаты реакций, которые
вином случае были бы невозможны.
Рис.2.55.Переносэнергииирольактивированныхпереносчиковвметаболизме.Служамаршрутными перевозчиками энергии, молекулы активированных переносчиков выполняют функцию посредников между происходящим с высвобождением энергии расщеплением молекул пищи (катаболизмом) иэнергопотребляющимбиосинтезоммаленькихибольшихорганическихмолекул(анаболизмом).

Глава 2. Химия клетки и биосинтез 125
2.2.12. Образование активированного носителя сопряжено с энергетически благоприятной реакцией
Когда молекула топлива, такого как глюкоза, окисляется в клетке, ферментативные реакции способствуют тому, что бóльшая часть свободной энергии, высвобождаемой в процессе окисления, запасается в химически доступной форме, а не выделяется в виде теплоты. Это возможно благодаря сопряженной реакции, когда энергетически благоприятная реакция подпитывает энергетически неблагоприятную, в ходе которой образуется молекула активированного носителя или какого-либо иного полезного накопителя энергии. Механизмы сопряжения требуют ферментов и лежат в основе всех энергетических операций клетки.
Характер сопряженной реакции проиллюстрирован на аналогии из механики, как это представлено на рис. 2.56, где энергетически благоприятная химическая реакция представлена камнями, падающими с утеса. Энергия падающих камней обычно полностью бесполезно расходуется в форме теплоты, производимой трением при ударе камней о землю (см. схему с падающим кирпичом на рис. 2.39). Однако при помощи искусной конструкции часть этой энергии может быть использована для приведения в действие колеса с лопастями — чтобы поднять ведро воды (рис. 2.56, б). Поскольку камни могут теперь достигнуть земли только после сообщения движения колесу с лопастями, мы говорим, что энергетически благоприятная реакция – падение камней – напрямую сопряжена с энергетически неблагоприятной реакцией – подъем ведра воды. Обратите внимание, что, поскольку в варианте б часть энергии идет на выполнение работы, камни падают на землю с меньшей скоростью, чем в случае варианта а, и, соответственно, меньше энергии рассеивается в виде теплоты.
Рис. 2.56. Механическая модель, иллюстрирующая принцип сопряженных химических реакций.
Самопроизвольная реакция, показанная на виде а, может служить аналогией процесса прямого окисленияглюкозывCO2 иH2O,результатомкоторогобудетпроизводствотолькотеплоты.Вбтажереакция сопряжена со второй реакцией; эта вторая реакция аналогична синтезу молекул активированных носителей.Энергия,произведеннаявреакцииб,находитсявболеедоступнойформе,чемвыработанная вреакцииа,иможетбытьиспользованадляпроведениямногихдругихэнергетическинеблагоприятных реакций(в).

126 Часть 1. Введение в мир клетки
Подобные процессы происходят в клетках, где ферменты играют роль лопастного колеса из нашего примера-аналогии. С помощью механизмов, которые мы обсудим позже в этой главе, они сопрягают энергетически благоприятную реакцию, такую как окисление пищевых продуктов, с энергетически неблагоприятной реакцией, такой как синтез молекулы активированного носителя. В результате количество теплоты, высвобожденной в реакции окисления, сокращается точно на то количество энергии, которая запасается в богатых энергией ковалентных связях активированной молекулы-носителя. Активированная молекула-носитель, в свою очередь, вбирает такую порцию энергии, которой будет достаточно для обеспечения химической реакции в каком-либо участке клетки.
2.2.13. ATP — наиболее распространенная активированная молекула-носитель
Наиболее важный и универсальный (многоцелевой) активированный носитель
вклетках — это ATP (аденозинтрифосфат). Точно так же как энергия, запасенная
вподнятом ведре воды, изображенном на рис. 2.56, б, может приводить в действие массу разнообразных гидравлических машин, ATP служит удобным и универсальным накопителем, или «оборотным активом», энергии, употребляемой на подпитку множества различных химических реакций, происходящих в клетках. ATP синтезируется в результате энергетически неблагоприятной реакции фосфорилирования,
входе которой фосфатная группа присоединяется к аденозиндифосфату (adenosine diphosphate, ÀDP). В случае необходимости ATP отдает свой энергетический заряд — путем энергетически благоприятного гидролиза до ADP и неорганического фосфата (рис. 2.57). После этого восстановленный ADP готов к использованию в следующем цикле реакции фосфорилирования – в результате чего вновь образуется ATP.
Энергетически благоприятная реакция гидролиза ATP сопряжена со множеством как таковых неблагоприятных реакций, связанных с синтезом других молекул. С несколькими из таких реакций мы встретимся далее в этой главе. Многие из них предполагают перенос концевого фосфата с ATP на другую молекулу, как показано на примере реакции фосфорилирования на рис. 2.58.
ATP — самый распространенный активированный носитель в клетках. Для примера скажем, что он снабжает энергией многие из тех насосов, которые переносят вещества в клетку и из клетки (обсудим их в главе 11). Кроме того, он питает энергией молекулярные двигатели, которые позволяют мышечным клеткам сокращаться, а нервным клеткам — транспортировать вещества от одного конца их длинных аксонов до другого (отложим их обсуждение до главы 16).
2.2.14. Запасенная в ATP энергия часто используется в реакции конденсации
Мы уже рассматривали один из способов, которыми энергетически благоприятная реакция может быть сопряжена с энергетически неблагоприятной реакцией X → Y, чтобы та осуществлялась. По той схеме второй фермент катализирует энергетически благоприятную реакцию Y → Z, втягивая тем самым все молекулы X в реакцию с образованием Y (см. рис. 2.54). Но когда требуется продукт Y, а не Z, этот механизм уже неприемлем.
Входе обычной реакции биосинтеза две молекулы, А и B, соединяются вместе
собразованием соединения A–B путем энергетически неблагоприятной реакции

Глава 2. Химия клетки и биосинтез 127
Рис. 2.57. Гидролиз ATP до ADP и неорганического фосфата. Два наиболее удаленных фосфата в ATP
связаны с остальной частью молекулы высокоэнергетическими фосфоангидридными связями и легко переносятсянадругиемолекулы.Какпоказанонарисунке,присоединениекATPмолекулыводыприводиткобразованиюADPинеорганическогофосфата(Pi).ТакойгидролизконцевогофосфатаATPдаетот11 до13ккал/мольполезнойэнергиивзависимостиотусловийвнутриклетки.Большоеотрицательноезначение Gдляэтойреакцииобусловленонесколькимифакторами.Высвобождениеконцевойфосфатной группыустраняетнеблагоприятноеотталкиваниемеждусоседнимиотрицательнымизарядами;кроме того,высвобожденныйионнеорганическогофосфата(Pi)стабилизируетсярезонансомиобразованием энергетическиблагоприятныхводородныхсвязейсмолекуламиводы.
Рис.2.58.Примерреакциипереносафосфата.Посколькувысокоэнергетическаяфосфоангидриднаясвязьв ATPпревращаетсявфосфоэфирнуюсвязь,этареакцияэнергетическиблагоприятна,таккакзначение G<< 0. Реакциитакоготипазадействованывсинтезефосфолипидовинапервыхэтапахкатаболизмасахаров.
