
- •Химия окружающей среды Учебное пособие
- •Физико-химические процессы в литосфере Введение
- •1. Строение литосферы и структура земной коры
- •Примеры решения задач
- •2. Минералы и горные породы
- •2.1. Магматические породы
- •2.2. Осадочные породы
- •2.3. Метаморфические горные породы
- •Пример решения задач
- •3. Гипергенез и почвообразование
- •Пример решения задач
- •4. Механический состав почв
- •Примеры решения задач
- •5. Элементный состав почв
- •Примеры решения задач
- •6. Органические вещества почвы
- •6.1. Классификация органических веществ почвы
- •6.2. Неспецифические органические соединения в почвах
- •6.3. Специфические гумусовые вещества почв
- •6.4. Органоминеральные соединения в почвах
- •Примеры решения задач
- •7. Поглотительная способность почв
- •7.1. Катионообменная способность почв
- •7.2. Обменные катионы почв
- •Примеры решения задач
- •8. Щелочность и кислотность почв
- •Примеры решения задач
- •9. Соединения азота в почве
- •Примеры решения задач
- •10. Соединения фосфора в почве
- •Примеры решения задач
- •Контрольные вопросы по теме «Физико-химические процессы в литосфере»
- •Задачи для самостоятельного решения
- •«Физико-химические процессы в литосфере»
- •Вопросы
- •К учебному модулю
- •Задачи к учебному модулю
- •Литература
- •Содержание
- •Учебное издание
Примеры решения задач
Пример 17. Для почвы с буферной емкостью
БЕ = 22 ммоль Н+/(кг • рН)
рассчитайте буферную емкость в кг Н+/(га- рН), полагая, что масса 1 га почвы равна 2500 т. Если почва первоначально имела pH1 5,0, определите рН почвы после поступления ионов Н+ из атмосферы и продуцирования их в почве в количестве до 3,5 кг Н+/(га • год) в течение 10 лет (рН2) и последующего внесения 3,2 т/га порошка известняка, нейтрализующая способность которого составляет 80% таковой СаСО3 (рН3).
Решение. Решение задачи сводится к пересчету с учетом изменения размерности буферной емкости (БЕ):
БЕ = К • БЕ*;
БЕ*
=
22
•
10–3![]() ,
,
где Мпочв – масса почвенного слоя на 1га, кг;
Мн – молярная масса атомов водорода, г/моль;
БЕ* = 22 · 10–3 · 2500 · 103 · 10–3 = 55 [кгН+/(га · рН)].
Определение рН почвы основывается на уравнении баланса с учетом продуцирования и поступления ионов водорода из различных источников.
Количество поступивших в почву ионов водорода (Мн+) в соответствии с условием задачи должно быть равно:
МН+ = БЕ · (pH1 – рН2).
Отсюда можно получить значение рН2:
рН 2=![]()
рН2
=![]()
На этой стадии внесение 3,2 т СаСО3 на 1 га почвы приводит к повышению рН почвы до рН3:
mCaCOзW = БЕ · К(рН3 – рН2)
где К – коэффициент, учитывающий величину заряда иона кальция, а также пересчет буферной емкости по водороду на карбонат кальция;
W – учитывает реальную нейтрализующую способность карбоната кальция – 80%.
Отсюда получаем:
рН3
=![]()
Ответ: БЕ = 55 кг Н+/(га · рН); рН2 = 4,4; рН3 = 5,3.
Пример 18. Потребность в извести почвы с рН 5,2, предназначенной для производства сельскохозяйственных культур, равна 8 т СаСО3/га. Рассчитайте, сколько времени должно было бы пройти после внесения этого количества извести до его следующего внесения, если предположить, что фермер позволил рН снизиться до 6,0. Примите, что после внесения в почву карбоната кальция значение рН должно достичь 6,7. Известно, что ежегодное поступление ионов водорода в почву составляет: в результате дыхания – 4,4, нитрификации – 2,0, поглощения питательных веществ – 0,7 и атмосферных поступлений – 1,3 кг Н+/(га · год).
Решение. В основе решения задачи лежит представление о существовании диапазона концентраций ионов водорода (рН), оптимальных для развития сельскохозяйственных растений. Примем для решаемой задачи оптимальную величину рН, равную 6,7. Тогда потребность
СаСО3 = БЕ · рН,
где БЕ – буферная емкость;
рН – изменение рН.
БЕ =
![]() [т
СaCO3/(pH
·
га)]
[т
СaCO3/(pH
·
га)]
В соответствии с условием задачи определим необходимое количество СаСО3 для доведения рН почвы до 6:
потребность СаСО3 (рН 6) = 5,3 · (6 – 5,2) = 4,2 (т СаСО3/га).
Таким образом, оставшаяся часть СаСО3 [mост = 8 – 4,2 = 3,8 (т)] идет на взаимодействие с поступающими из различных источников ионами водорода по уравнению:
СаСО3 + 2Н+ Са2+ + Н2О + СО2
Количество молей СаСО3 и Н+ составит:
![]() =
38(кмоль),
=
38(кмоль),
где МСаСОз – молярная масса карбоната кальция, равная 100 кг/кмоль.
Сумма всех поступлений ионов водорода в почву nH+ равна:
![]() =
8,4 [кмольН+/(га
·
год)].
=
8,4 [кмольН+/(га
·
год)].
Поскольку реагенты вступают в реакцию в стехиометрическом соотношении СаСО3:Н+ = 1:2, с учетом материального баланса искомое выражение для определения времени можно записать следующим образом:
![]() ,
,
где t – время до следующего внесения в почву СаСО3;
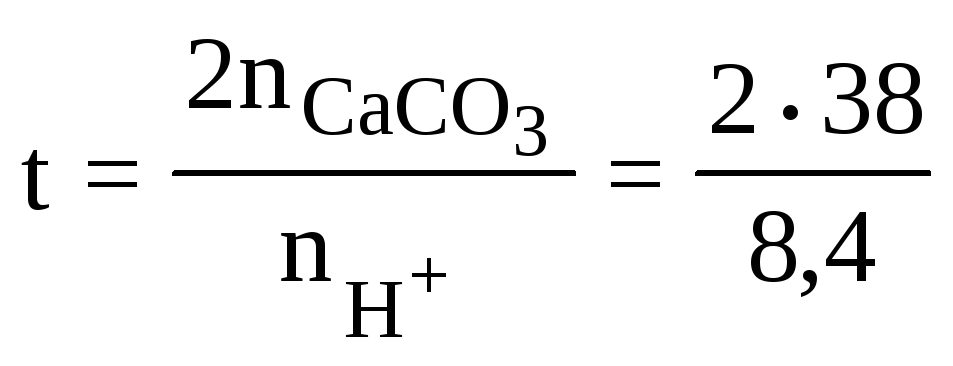 =
9 (лет).
=
9 (лет).
Ответ: до следующего внесения извести в почву должно пройти 9 лет.
