
- •КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- •Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу
- •Классификация
- •Функциональные производные карбоновых кислот – соединения, образующиеся в в результате химических превращений по
- •Замещенные карбоновые кислоты – кислоты, содержащие в углеводородном радикале другие функциональные группы.
- •Номенклатура
- •Ацилат (ацилоксигруппа) - остаток карбоновой к-ты, образующийся при отщеплении Н-атома от карбоксильной группы
- •По ИЮПАК карбоксильная группа
- •Карбоксильная группа обозначается префиксом «карбокси», если она не является старшей, или входит в
- •Названия
- •Пропановая кислота пропаноил пропаноат
- •Названия производных кислот
- •Способы получения
- •Окисление спиртов, альдегидов и кетонов.
- •Окисление метилкетонов: окисляют гипогалогенитами (галоформная реакция) - (получается к-та с числом С- атомов
- •2. Гидролиз.
- •В алифатическом ряду
- •Гидролиз сложных эфиров
- •Высшие жирные к-ты получают омылением жиров
- •Гидролих гем-тригалогензамещенных
- •3. Карбоксилирование металлорганических соединений (метод Гриньяра)
- •4. Оксосинтез. Карбонилирование алкенов – с увеличением числа С-атомов на 1
- •Строение
- •Вкарбоксильной гр. 3 полярные связи
- •Физические свойства
- •Вследствии этого Ткип и Тпл аномально высокие по сравнению со спиртами.
- •Химические свойства
- •Электронная плотность на О-атоме ОН-гр. снижается, связь О-Н становится более полярной, что приводит
- •Карбоновые кислоты обладают высокой реакционной способностью, в них можно выделить различные реакционные центры:
- •Для кислот характерны след. р-ции:
- •Восстановление
- •КК довольно устойчивы к окислению, поэтому они часто являются продуктами окисления других соединений.
- •Р-ции с участием СООН-группы -
- •• Большей полярностью О-Н группы,
- •Меньшей энергией диссоциации связи О-Н, т.к. при ее диссоциации образуется относительно устойчивый анион
- •В водном растворе карбоновые кислоты диссоциируют с образованием карбоксилатаниона и иона гидроксония
- •Поскольку КК более сильные кислоты, чем спирты, то они образуют соли не только
- •КК являясь более сильными кислотами, чем угольная, взаимодействуют с содой с образованием угольной
- •Ряд кислотности О-Н кислот:
- •На силу КК оказывает влияние строение углеводородного радикала:
- •Кислотность ароматических кислот
- •Основность КК низкая, сравнима с основностью А и К и проявляется в сильнокислой
- •Соли карбоновых кислот и их свойства
- •Соли высших жирных к-т называют мылами. Калиевые и натриевые соли хорошие ПАВ.
- •Соли аммония при нагревании отщепляют воду с образованием
- •Одной из важных р-ций декарбоксилирования является нагревание серебряных солей карбоновых кислот с
- •В отличие от КК, которые обладают низкой основностью и нуклеофильностью, карбоксилат- ионы, являясь
- •б) Реакции с галогенидами фосфора и серы – образование галогенангидридов
- •Вследствие низкой электрофильности С-атома в СООН –гр. слабые нуклеофилы (HCl) не замещают ОН-гр.
- •Галогенангидриды карбоновых кислот и их свойства
- •Физические свойства
- •Эти р-ции называют реакциями ацилирования, т.к в молекулы реагентов вместо атома Н либо
- •Механизм реакции ацилирования
- •2) отщепление уходящей группы с образованием конечного продукта. Эта стадия идет быстро, т.к.
- •Механизм реакции с участием
- •Р-ция ацилирования классифицируется как реакция нуклеофильного замещения у ненасыщенного С-атома SN2, протекающая через
- •Р-ция ацилирования - процесс равновесный. Положение равновесия зависит от соотношения прямой и обратной
- •Реакционную способность ацилирующего средства определяет
- •Соли не проявляют ацилирующей способности, т. к.
- •Чем выше реакционная способность ацилирующего средства, тем выше скорость р-ции и тем больше
- •Р-ции производных КК с сильными нуклеофилами не требуют kt,
- •Роль катализаторов такая же, как и для р-ций АN А и К.
- •Ангидриды кислот и их свойства
- •Физические свойства
- •Сложные эфиры и их свойства
- ••Реакцией этерификации –
- •Р-ция этерификации – частный случай р-ции ацилирования.
- •КК – слабое ацилирующее средство, спирт – слабый нуклеофил, поэтому р-ция этерификации идет
- •Сильные органические к-ты, напр. муравьиная реагируют и без кат-ра.
- •Механизм этерификации
- •Пространственные факторы также оказывают влияние на р-цию этерификации. Увеличение объема радикалов и в
- •По этой же причине р-ции этерификации с участием
- ••Сложные эфиры – слабые ацилирующие средства, поэтому гидролиз проводят в условиях кислотного или
- •Механизм щелочного гидролиза :
- •Сложные эфиры легко восстанавливаются с разрывом связи между карбонильным С-атомом и О- атомом
- •Сложные эфиры КК проявляют
- •Амиды и их свойства
- ••Нагреванием кислот с аминами
- ••Ацилированием аммиака галогенангидридами, ангидридами,
- •Амидная группа имеет плоское строение, имеет место делокализация электронов. В результате электронная плотность
- •Низшие амиды жидкости, х.р. в воде, некоторые из них используют как растворители.
- •Важнейшие реакции:
- •Нитрилы и их свойства
- •Ароматические –
- •Важнейшие реакции
- •Декарбоксилирование
- •Реакции КК по углеводородному радикалу-образование замещенных КК
- •По этой причине легко подвергается галогенированию по SR-механизму – выход α-замещенной к-ты больше,
- •В присутствии небольших количеств
- •В ароматическом ряду
- •Важнейшие представители
- •Бензойная кислота. Распространена в природе – как в свободном виде, так и виде
- •Общие сведения о ненасыщенных и дикарбоновых кислотах
- •Химическое поведение непредельных к-т связано с наличием
- •Реакции АЕ (HHal, H2O идут против правила Марковникова (1,4- присоединение у сопряженных диенов).
- •К двойной связи может присоединиться и нуклеофил:
- •Акриловая кислота.
- •Метакриловая кислота
- •Высшие непредельные кислоты – входят в состав жиров (масел).
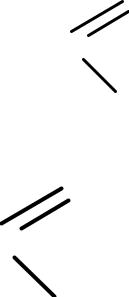
- •Дикарбоновые кислоты
- •Диссоциируют в 2 ступени:
- •Двухосновные к-ты сильнее одноосновных, т.к вторая СООН-гр. за счет –I-эффекта способствует ионизации первой
- •Кислота
- •Отношение к нагреванию.
- •1,4- и 1,5-Дикарбоновые кислоты (янтарная, глутаровая и фталевая) при нагревании отщепляют воду с
- •COOH
- •1,6- и 1,7-Дикарбоновые кислоты (адипиновая и пимелиновая) при нагревании подвергаются декарбоксилированию и дегидратации,
- •Наибольший интерес представляет
- •В малоновой и алкилмалоновых к- тах) и их эфирах a-С-атом связан с двумя
- •Карбанион этой соли стабилизирован – 6 электронов распределены по 3 С-атомам и 2
- •Карбанион натриймалонового эфира проявляет выраженные нуклеофильные свойства и легко вступает в реакции С-
- •С–Н кислотность алкилмалонового эфира ниже, чем малонового эфира, поэтому для его ионизации требуется
- •Алкил- и диалкилмалоновые эфиры легко гидролизуются, а образующиеся алкил- и диалкилмалоновые кислоты легко
- •Планирование синтеза на основе МЭ
- •Примеры:
- •Для синтеза диалкилуксусных к-т необходимо после алкилирования МЭ повторить стадии 1)-2) - получить
- •COOC2H5C2H5ONa
- •Получение дикарбоновых к-т см. Тексты лекций
- •Отдельные представители
- •Янтарная к-та.
- •n HOOC
- •Фталевые к-ты.
- •Наиболее ценные фталевая и терефталевая к-ты. Фталевая к-та склонна к образованию ангидрида, который
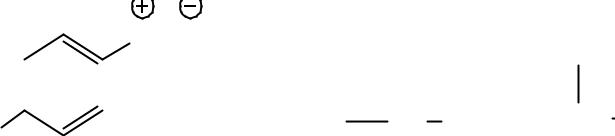
Карбоксильная группа обозначается префиксом «карбокси», если она не является старшей, или входит в состав заместителя.
|
|
|
N2 Cl |
|
|
|
3 |
CH2 |
|
COOH |
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
6 |
H2 |
4 |
|
2 |
|
1 |
|||
HOOC |
HOOC |
5 C |
H2C |
|
CH CH2 |
|
COOH |
||||||
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
4-карбоксибензол- |
|
3-карбоксиметилгексан- |
|||||||||||
диазонийхлорид |
|
диовая кислота |
|
|
|
|
|||||||
Названия
ацильных остатков образуют из названий соответствующих кислот с суффиксом «ил (оил)»,
ацилатных остатков – с суффиксом «ат».
Метановая кислота метаноил метаноат
(муравьиная) формил формиат Этановая кислота этаноил этаноат
(уксусная) ацетил ацетат
Пропановая кислота пропаноил пропаноат
(пропионовая) пропионил пропионат Бутановая кислота бутирил бутират (масляная)
Бензойная кислота бензоил бензоат
Названия производных кислот
образуют из названий
соответствующих кислот.
H3C |
|
C O |
этаноат натрия |
||
|
|||||
|
|
|
|
ONa |
ацетат натрия |
|
|
|
|
O |
этаноилхлорид |
H3C |
|
C |
ацетилхлорид |
||
|
|||||
|
|
|
|
Cl |
|

H3C |
|
|
|
C O |
этановый ангидрид |
|
|
||||
|
|
|
|
O |
уксусный ангидрид |
H3C |
|
C |
ацетангидрид |
||
|
|||||
|
|
|
|
O |
|
|
|
C O |
этилэтаноат |
||
H3C |
|
этилацетат |
|||
|
|||||
|
|
O C H |
этиловый эфир |
||
|
|
2 5 |
уксусной кислоты |
||

H3C C O
|
|
|
NH2 |
||
H3C |
|
C |
O CH3 |
||
|
|||||
|
|
|
N |
||
|
|
|
|
CH3 |
|
H3C |
|
C |
|
||
|
|
||||
|
|
||||
|
|
||||
этанамид
ацетамид
N,N-диметилэтанамид N,N-диметилацетамид
Nэтаннитрил
ацетонитрил
Способы получения
1. Окисление.
Окисление алканов в промышленности осуществляют О2 воздуха при высокой температуре в присутствии или отсутствии катализатора – при этом образуется смесь к-т с меньшим числом С-атомов.
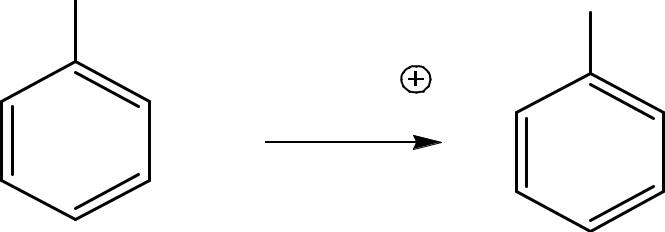
В ароматическом ряду – окислители: KMnO4/H+, K2Cr2O7/H+, HNO3 – при этом боковые цепи алкилбензолов окисляются до
СООН-группы. |
|
СН3 |
СООН |
KMnO4 /H
t
|
|
|
|
|
|
|
|
C2H5 |
|
СООН |
|
|
|||
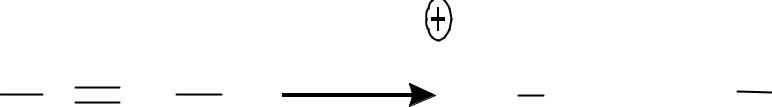
Окисление непредельных углеводородов идет с разрывом связи С=С и образованием кислот с меньшим числом С-атомов :
R C |
CH R' |
KMnO4,H |
R COOH +R' COOH |
|
|||
H |
|
|
|
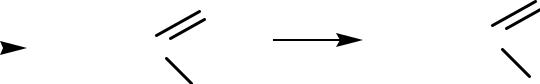
Окисление спиртов, альдегидов и кетонов.
Окисление первичных спиртов и альдегидов приводит к образованию к-т с тем же числом С-атомов
|
|
H2 |
|
|
[O] |
|
|
|
|
O |
|
[O] |
|
|
O |
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
C |
|
OH |
|
|
|
R |
|
C |
|
|
|
R |
|
C |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
OH |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Окисление вторичных спиртов приводит к образованию кетонов, которые затем окисляются с разрывом С-С-связи с образованием смеси кислот.
