
диссертации / 51
.pdf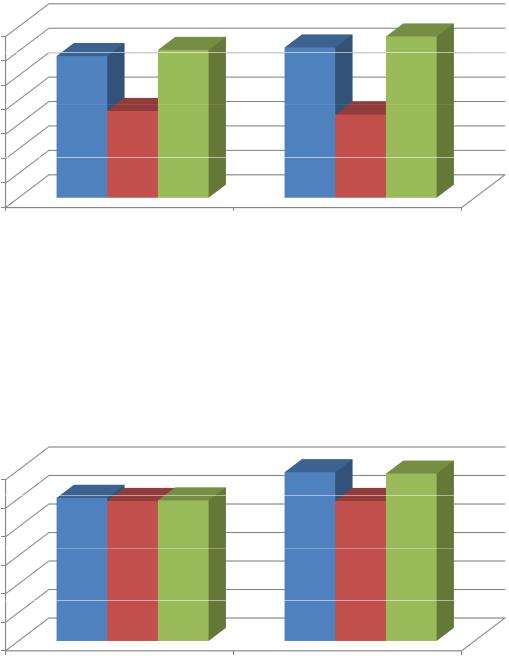
221
Интенсивность флуоресценции (УЕФ)
14
12
10
8
6
4
2
0
|
|
|
12,3 |
13,2 |
11,6 |
|
12,1 |
|
|
|
|
|
||
|
|
|
|
|
|
7,1 |
|
|
6,8 |
|
|
|
|
TLR2 рецепторы |
TLR4 рецепторы |
 Дети группы контроля (n=30)
Дети группы контроля (n=30)
 Дети с нормоергическим вариантом АД до лечения (n=34)
Дети с нормоергическим вариантом АД до лечения (n=34)
 Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Рисунок 34. Уровень экспрессии лимфоцитами TLR2- и TLR4-рецепторов у детей с нормоергическим клинико-патогенетическим вариантом АД после лечения альфа-глутамил-триптофаном
(УЕФ) |
|
|
|
59,2 |
58,7 |
60 |
50,2 |
49,3 |
|
|
|
флуоресценции |
49,1 |
49,1 |
|
||
30 |
|
|
|
|
|
|
50 |
|
|
|
|
Интенсивность |
40 |
|
|
|
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
0 |
|
|
|
|
|
|
TLR2 рецепторы |
|
TLR4 рецепторы |
|
 Дети группы контроля (n=30)
Дети группы контроля (n=30)
 Дети с нормоергическим вариантом АД до лечения (n=34)
Дети с нормоергическим вариантом АД до лечения (n=34)
 Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Рисунок 35. Уровень экспрессии нейтрофильными лейкоцитами TLR2- и TLR4-рецепторов у детей с нормоергическим клинико-патогенетическим вариантом АД после лечения альфа-глутамил-триптофаном
Таким образом, увеличение экспрессии TLR2 и TLR4 на гранулоцитах, моноцитах и лимфоцитах периферической крови у больных с нормоергическим вариантом АД после применения альфа-глутамил-триптофана до нормальных
222
величин свидетельствовало о нормализации процессов естественной резистентности, повышении противоинфекционной защиты и уменьшении продукции провоспалительных цитокинов.
Проведенные после окончания лечения альфа-глутамил-триптофаном исследования (табл. 37) показали, что содержание эндогенного оксида азота у детей с нормоергическим клинико-патогенетическим вариантом АД достоверно снизилось (22,1±1,2 мкмоль/л) по сравнению с исходными величинами
(62,57±1,14 мкмоль/л) и не отличалось от показателей детей контрольной группы (21,03±0,18 мкмоль/л).
Таблица 37 Уровень NO у детей с нормоергическим клинико-патогенетическим вариантом АД под влиянием альфа-глутамил-триптофана (М±m)
Обследуемые группы |
NO (мкмоль/л) |
Дети контрольной группы (n=30) |
21,03±0,18 |
Дети с нормоергическим |
|
патогенетическим вариантом АД |
62,57±1,14* |
до лечения (n=32) |
|
Дети с нормоергическим |
|
патогенетическим вариантом АД |
22,1±1,2** |
после терапии (n=30) |
|
*р<0,001 – достоверно по отношению к детям контрольной группы;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Полученные результаты объективно демонстрируют, что нормализация уровня эндогенного оксида азота как важного маркера степени выраженности воспалительного процесса у детей с нормоергическим клиникопатогенетическим вариантом АД после терапии альфа-глутамил-триптофаном напрямую коррелировала с уменьшением основных клинических симптомов заболевания.
Проведенная после лечения альфа-глутамил-триптофаном оценка выработки антител к общей антигенной детерминанте всех бактерий у детей с нормоергическим клинико-патогенетическим вариантом АД показала достоверное повышение аффинности сывороточных анти-ОАД-антител (1830

223
усл. ед.) по сравнению с исходными величинами (1350 усл. ед.), что достоверно не отличалось от показателей контрольной группы детей (1800 усл. ед.) (рис. 36).
Усл. ед.
|
1800 |
1830 |
|
|
|
2000 |
|
1350 |
1500
1000
500
0  анти-ОАД-антитела
анти-ОАД-антитела
 Дети группы контроля (n=30)
Дети группы контроля (n=30)
 Дети с нормоергическим варантом АД до лечения (n=34)
Дети с нормоергическим варантом АД до лечения (n=34)
 Дети с нормоергическим варантом АД после терапии альфа-глутомил-триптофаном (n=30)
Дети с нормоергическим варантом АД после терапии альфа-глутомил-триптофаном (n=30)
Рисунок 36. Уровень аффинности антител у детей с нормоергическим клинико-патогенетическим вариантом АД после лечения альфа-глутамил- триптофаном
Значительно возросшая аффинность сывороточных анти-ОАД-антител свидетельствовала о нормализации процессов созревания и становления аффинности антител гуморального антибактериального иммунитета.
Таким образом, включение в схему лечения альфа-глутамил-триптофана у детей с нормоергическим клинико-патогенетическим вариантом АД позволило эффективно повысить механизмы естественной резистентности и устранить разнонаправленные нарушения иммунного гомеостаза.
Удетей с гиперергическим клинико-патогенетическим вариантом АД до
ипосле окончания дифференцированной терапии мы также оценивали наиболее характерные показатели иммунного гомеостаза и факторы неспецифической естественной резистентности: уровень общего IgE в сыворотке крови и эозинофилов в кровяном русле, состояние клеточного звена
иммунитета, профиль цитокиновой секреции, фактор ингибирования миграции
224
макрофагов и уровень оксида азота.
В зависимости от применяемых лечебных методик данную оценку проводили через 12 недель от начала терапии у 30 больных 1 терапевтической группы, получавших системную (циклоспорин А) и местную (такролимус мазь 0,03%, пимекролимус крем 1%) иммуносупрессивную терапию, и через 12 месяцев от начала лечения у 30 пациентов 3 терапевтической группы, получавших омализумаб и такролимус мазь 0,03%.
Динамика уровней общего IgE и эозинофилов после применения дифференцированных лечебных методик приведена в таблице 38. Содержание общего IgE в сыворотке крови больных 1 терапевтической группы через 12 недель терапии достоверно снизилось в 2,9 раза по сравнению с исходными величинами (в среднем с 963,5±8,5 МЕ/мл до 331,2±8,2 МЕ/мл), однако не достигло при этом нормальных референтных значений. Параллельно с уменьшением уровня общего IgE и стиханием клинических проявлений АД у пациентов данной группы нами было отмечено существенное достоверное снижение числа эозинофилов в кровяном русле (в среднем с 1,48×10 9/л до 0,29×10 9/л), практически достигшее референтных значений (r=0,9).
Содержание общего IgE в сыворотке крови больных 3 группы через 12 месяцев от начала лечения омализумабом и такролимусом мы не определяли, т.к. используемая методика определения не позволяет дифференцировать свободный IgE и связанный с омализумабом IgE. Однако после окончания дифференцированной терапии у больных этой группы уровень эозинофилов в периферической крови снизился в 8,7 раза относительно исходных значений (в среднем с 1,56×10 9/л до 0,18×10 9/л) и достоверно не отличался от нормальных показателей. При этом снижение степени эозинофилии до референтных величин коррелировало с регрессом клинических проявлений заболевания как со стороны кожи, так и со стороны дыхательной системы (r=0,9).
225
Таблица 38
Уровень общего IgE и эозинофилов
у больных с гиперергическим клинико-патогенетическим вариантом АД до и после применения дифференцированных лечебных методик (М±m)
|
Терапевтические группы больных с гиперергическим |
||||
|
клинико-патогенетическим вариантом АД |
||||
|
|
|
|
|
|
Показатель |
1 группа (n=30) |
3 группа (n=30) |
|||
|
|
Через |
До |
Через |
|
|
До лечения |
12 недель |
12 месяцев |
||
|
лечения |
||||
|
|
лечения |
лечения |
||
|
|
|
|||
Общ. IgE, МЕ/мл |
963,5±8,5* |
331,2±8,2*, ** |
685,2±9,1* |
|
|
Референтные |
н.о. |
||||
значения – 0 – 50,0 |
|
|
|
|
|
EOS,×10 9/л |
|
0,29*, ** |
1,56* |
|
|
(медиана, min – max) |
1,48* |
0,18** |
|||
Референтные |
0,732–4,561 |
0–0,735 |
0,643– |
0–0,521 |
|
4,728 |
|||||
значения – 0 – 0,2 |
|
|
|
||
|
|
|
|
||
*р<0,001 – достоверно по отношению к референтным значениям;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Таким образом, представленные результаты убедительно свидетельствует о патогенетической обоснованности и высокой эффективности использованных дифференцированных лечебных методик у 1 и 3 терапевтических групп больных с гиперергическим клинико-патогенетическим вариантом АД.
Применение дифференцированных лечебных методик оказывало выраженное нормализующее влияние на количественные пропорции основных субпопуляций иммунорегуляторных клеток у детей обеих терапевтических групп (табл. 39). Отмечалось достоверное снижение общей популяции Т- лимфоцитов с 78,5±1,1% до 66,1±1,3% и 67,2±1,2% соответственно, не отличавшееся после окончания лечения от показателей группы контроля. Содержание хелперно-индукторных лимфоцитов (CD4+) снизилось примерно в 1,3 раза по сравнению с исходными величинами (в среднем с 46,1±0,9% до 36,4±1,2% и 36,9±1,0% соответственно) и достоверно не отличалось от контрольных значений. Уровень цитотоксических лимфоцитов (CD8+) на фоне проводимой терапии существенно не изменился (19,2±1,2% до и 19,0±1,4% и
226
20,4±1,3% соответственно после лечения) и достоверно не отличался от референтных значений. Отмечалось достоверное снижение содержания СD20+ и СD30+ клеток по сравнению с исходным уровнем до субнормальных значений. Иммунорегуляторный индекс уменьшился с 2,5±0,1 до 2,0±0,1 и 1,9±0,1 соответственно, достигнув нормальных показателей контрольной группы.
Таблица 39
Основные показатели клеточного звена иммунитета
удетей с гиперергическим клинико-патогенетическим вариантом АД под воздействием дифференцированных лечебных методик (М±m)
|
|
|
Дети с гиперергическим |
||
|
Дети |
клинико-патогенетическим вариантом АД |
|||
|
группы |
|
|
|
|
Показатель |
|
|
Терапевтические группы |
||
контроля |
|
|
|||
До лечения |
|
1 группа (n=30) |
3 группа (n=30) |
||
|
(n=30) |
|
|||
|
(n=60) |
|
Через 12 недель |
Через 12 месяцев |
|
|
|
|
|||
|
|
|
|
лечения |
лечения |
СD3+,% |
66,3±1,2 |
78,5±1,1* |
|
66,1±1,3** |
67,2±1,2** |
|
|
|
|
|
|
СD4+,% |
36,2±1,1 |
46,1±0,9* |
|
36,4±1,2** |
36,9±1,0** |
|
|
|
|
|
|
СD8+,% |
20,1±1,4 |
19,2±1,2 |
|
19,0±1,4 |
20,4±1,3 |
|
|
|
|
|
|
СD20+,% |
18,0±1,6 |
29,4±1,6* |
|
23,6±1,8* , ** |
23,2±1,4*, ** |
|
|
|
|
|
|
СD30+,% |
10,8±1,3 |
25,8±0,8* |
|
13,9±1,1* , ** |
14,6±1,2*, ** |
|
|
|
|
|
|
ИРИ |
1,9±0,1 |
2,5±0,1* |
|
2,0±0,1** |
1,9±0,1** |
|
|
|
|
|
|
*р<0,001 – достоверно по отношению к детям группы контроля;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Таким образом, восстановление должных количественных пропорций основных субпопуляций иммунорегуляторных клеток под воздействием дифференцированных лечебных методик свидетельствовало о нормализации процессов дифференцировки Th0-порядка и устранении дисбаланса между Т- хелперами второго (Th2) и первого (Th1) порядков у детей с гиперергическим клинико-патогенетическим вариантом АД.
227
После окончания дифференцированной терапии у детей обеих терапевтических групп нами отмечено снижение уровней IL-4, IL-5, IL-10, TNF-α в сыворотке крови по сравнению с исходными величинами до нормальных значений (табл. 40).
Таблица 40
Уровень продукции цитокинов в сыворотке крови у детей с гиперергическим клинико-патогенетическим вариантом АД
до и после окончания дифференцированной терапии (М±m)
|
|
|
Дети с гиперергическим |
||
|
Дети |
клинико-патогенетическим вариантом АД |
|||
Показатель |
группы |
|
|
|
|
|
Терапевтические группы |
||||
(пг/мл) |
контроля |
|
|||
До лечения |
1 группа (n=30) |
3 группа (n=30) |
|||
|
(n=30) |
||||
|
(n=60) |
Через 12 недель |
Через 12 месяцев |
||
|
|
||||
|
|
|
лечения |
лечения |
|
IL-4 |
22,4±1,6 |
41,3±1,5* |
21,8±1,4** |
22,1±1,6** |
|
|
|
|
|
|
|
IL-5 |
17,5±1,8 |
26,5±1,6* |
17,1±1,6** |
17,8±1,5** |
|
|
|
|
|
|
|
IL -10 |
12,0±1,3 |
22,4±1,2* |
12,5±1,4** |
12,2±1,1** |
|
|
|
|
|
|
|
IL-13 |
21,2±2,5 |
31,8±2,1* |
26,4±2,2* , ** |
27,0±2,3*, ** |
|
|
|
|
|
|
|
TNF-α |
42,3±2,4 |
126,9±3,4* |
43,1±2,6** |
44,3±2,4** |
|
|
|
|
|
|
|
INF-γ |
25,6±3,2 |
29,2±2,1 |
29,1±2,3 |
28,3±2,2 |
|
|
|
|
|
|
|
*р<0,001 – достоверно по отношению к детям группы контроля;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Так, уровень IL-4 у детей 1 и 3 группы достоверно уменьшился с 41,3±1,5 пг/мл до 21,8±1,4 пг/мл и 22,1±1,6 пг/мл соответственно и не отличался от показателей детей контрольной группы. Аналогичная тенденция прослеживалась и для IL-5, IL-10 и TNF-α. Также в обеих терапевтических группах нами отмечено снижение IL-13 до субнормальных значений, с 31,8±2,1
пг/мл до 26,4±2,2 пг/мл и 27,0±2,3 пг/мл соответственно. Уровень INF-γ до и после лечения существенно не изменился и достоверно не отличался от показателей детей контрольной группы.
228
Таким образом, нормализация уровней ключевых цитокинов и профиля цитокиновой секреции свидетельствовала о нормализиции цитокинопосредованной регуляции иммунного ответа у детей с гиперергическим клинико-патогенетическим вариантом АД под воздействием дифференцированных лечебных методик.
Проведенные после окончания дифференцированной терапии исследования показали (табл. 41), что концентрация МИФ у детей 1 и 3 терапевтических групп с гиперергическим клинико-патогенетическим вариантом АД в среднем достоверно уменьшилась с 30,2±2,8 нг/мл до 5,0±0,4 нг/мл и 5,3±0,2 нг/мл соответственно, достигнув нормальных референтных значений (5,2±0,3 нг/мл).
Таблица 41 Концентрация МИФ в крови у детей с гиперергическим клиникопатогенетическим вариантом АД под воздействием применяемых
дифференцированных лечебных методик (М±m)
|
|
|
Дети с гиперергическим |
||
|
Дети |
клинико-патогенетическим вариантом АД |
|||
Показатель |
группы |
|
|
|
|
|
Терапевтические группы |
||||
(нг/мл) |
контроля |
|
|||
До лечения |
1 группа (n=30) |
3 группа (n=30) |
|||
|
(n=30) |
(n=60) |
|
|
|
|
Через 12 недель |
Через 12 месяцев |
|||
|
|
||||
|
|
|
лечения |
лечения |
|
Концентрация |
5,2±0,3 |
30,2±2,8* |
5,0±0,4** |
5,3±0,2** |
|
МИФ |
|||||
|
|
|
|
||
*р<0,001 – достоверно по отношению к детям группы контроля;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Применение дифференцированных лечебных методик (рис. 37) способствовало значительному статистически достоверному уменьшению спонтанного высвобождение МИФ культурой моноцитов у детей 1 и 3 терапевтических групп с гиперергическим клинико-патогенетическим вариантом АД (с 12,3±1,4 нг/мл – в исходном фоне до 4,0±1,2 нг/мл и 4,6±1,4 нг/мл соответственно, при 4,2±1,3 нг/мл у детей группы контроля). Отмечалось также выраженное статистически достоверное снижение продукции МИФ

229
моноцитами у детей обеих терапевтических групп при стимуляции их конковалином А с 48,2±8,3 нг/мл до 25,2±1,2 нг/мл и 26,1±1,3 нг/мл соответственно при референтных значениях 25,3±1,4 нг/мл.
нг/мл
|
|
48,2 |
|
|
50 |
|
|
|
|
45 |
|
|
|
|
40 |
|
|
|
|
35 |
25,3 |
|
25,2 |
26,1 |
|
|
|
|
|
30 |
|
|
|
|
25 |
|
|
|
|
20 |
|
12,3 |
|
|
15 |
|
|
|
|
10 |
4,2 |
4 |
|
4,6 |
|
|
|
|
5
0  Уровень продукции МИФ
Уровень продукции МИФ
 Спонтанная продукция МИФ у детей группы контроля (n=30)
Спонтанная продукция МИФ у детей группы контроля (n=30)
 МИФ у детей группы контроля после стимуляции конковалином А (n=30)
МИФ у детей группы контроля после стимуляции конковалином А (n=30)
 Спонтанная продукция МИФ у детей с гиперергическим вариантом АД до лечения (n=60)
Спонтанная продукция МИФ у детей с гиперергическим вариантом АД до лечения (n=60)
 МИФ у детей с гиперергическим вариантом АД после стимуляции конковалином А до лечения (n=60)
МИФ у детей с гиперергическим вариантом АД после стимуляции конковалином А до лечения (n=60)
 Спонтанная продукция МИФ у детей 1 тер. группы после дифф. терапии (n=30)
Спонтанная продукция МИФ у детей 1 тер. группы после дифф. терапии (n=30)
 МИФ у детей 1 тер. группы после дифф. терапии и стимуляции конковалином А (n=30)
МИФ у детей 1 тер. группы после дифф. терапии и стимуляции конковалином А (n=30)
 Спонтанная продукция МИФ у детей 3 тер. группы после дифф. терапии (n=30)
Спонтанная продукция МИФ у детей 3 тер. группы после дифф. терапии (n=30)
 МИФ у детей 3 тер. группы после дифф. терапии и стимуляции конковалином А (n=30)
МИФ у детей 3 тер. группы после дифф. терапии и стимуляции конковалином А (n=30)
Рисунок 37. Уровень спонтанной продукции МИФ моноцитами крови у детей с гиперергическим клинико-патогенетическим вариантом АД до и после стимуляции конковалином А на фоне применяемых дифференцированных лечебных методик
После окончания дифференцированной терапии площадь миграции клеток, определяемая балансом МИФ и МСФ у детей 1 и 3 терапевтических групп с гиперергическим клинико-патогенетическим вариантом АД, увеличилась более чем на 10%. Индекс клеточной миграции (табл. 42), значительно уменьшившись, варьировал от 3,0±0,4% до 5,6±0,5% и не отличался от референтных значений. Наиболее значимое снижение индекса клеточной миграции отмечалось у пациентов с распространенными,
230
обширными очагами поражения в виде тотальной и/или парциальной эритродермии.
Таблица 42 Среднее значение индекса клеточной миграции у детей с гиперергическим клинико-патогенетическим вариантом АД под воздействием применяемых
дифференцированных лечебных методик (М±m)
|
|
Дети с гиперергическим |
||
|
клинико-патогенетическим вариантом АД |
|||
Показатель |
|
|
|
|
|
Терапевтические группы |
|||
(%) |
|
|||
До лечения |
1 группа (n=30) |
3 группа (n=30) |
||
|
||||
|
(n=60) |
Через 12 недель |
Через 12 месяцев |
|
|
|
лечения |
лечения |
|
Индекс клеточной |
26,3±5,2* |
4,8±0,6** |
5,2±0,4** |
|
миграции |
||||
|
|
|
||
*р<0,001 – достоверно по отношению к референтным значениям;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Таким образом, на основании результатов проведенных исследований можно сделать вывод о том, что положительный клинический эффект под воздействием применяемых дифференцированных лечебных методик у детей с гиперергическим клинико-патогенетическим вариантом АД был в немалой степени обусловлен нормализацией продукции МИФ.
Проведенные после окончания дифференцированной терапии исследования (табл. 43) показали, что содержание эндогенного оксида азота у детей обеих терапевтических групп с гиперергическим клиникопатогенетическим вариантом АД достоверно снизилось (20,2±1,3 мкмоль/л и 21,8±1,1 мкмоль/л соответственно) по сравнению с исходными величинами (66,2±2,6 мкмоль/л) и не отличалось от показателей детей группы контроля
(21,03±0,18 мкмоль/л).
При этом снижение уровня эндогенного оксида азота до референтных величин четко коррелировало с уменьшением остроты и степени выраженности воспалительной реакции основных клинических симптомов АД.
