
диссертации / 51
.pdf
211
терапии омализумабом у больных 3-й группы частота клинически значимых обострений БА снизилась в среднем на 86,4% (через 6 месяцев – на 85%, через 12 месяцев – на 87,8%), в то время как при терапии АД CsA у пациентов 4-й группы снижения частоты клинически значимых обострений БА нами отмечено не было (рис. 30).
5
|
|
|
4,7 |
|
4,5 |
|
|
|
|
|
|
5 |
|
|
|
|
4,3 |
|
|
|
|
|
|
4,5 |
|
|
|
|
|
4 |
|
|
|
|
|
3,5 |
|
|
|
|
|
3 |
|
|
|
|
|
2,5 |
|
|
|
|
|
2 |
|
|
|
|
|
1,5 |
|
|
0,75 |
|
0,61 |
|
|
|
|
||
1 |
|
|
|
|
|
0,5 |
|
|
|
|
|
0 |
|
|
|
|
|
До лечения |
6 месяцев |
12 месяцев |
|||
|
|
Терапевтическа группа 3 (n=32) |
|
Терапевтическая группа 4 (n=30) |
|
|
|
|
|||
|
|
|
|||
Рисунок 30. Частота клинически значимых обострений БА у больных 3-й и 4-й групп с гиперергическим клинико-патогенетическим вариантом АД на фоне терапии
При оценке эффективности лечения БА нами учитывалась также потребность в частоте оказания медицинской помощи и лекарственных препаратах для купирования ее приступов. В 3-й терапевтической группе большинство больных отмечали существенное улучшение состояния по БА уже после первого месяца лечения омализумабом. К окончанию второго полугодия в этой группе больных значительно снизилась потребность в ИГКС (88% больных полностью перестали в них нуждаться). Через 12 месяцев от начала использования омализумаба у всех пациентов 3-й группы была констатирована стабильная клинико-функциональная ремиссия БА. Пациенты 4-й группы сохраняли потребность в дополнительном приеме короткодействующих β2-
212
агонистах на фоне базовой терапии ИГКС в течение всего периода исследования.
При исследовании функции внешнего дыхания до начала терапии у всех 62 детей отмечалось нарушение бронхиальной проходимости различной степени выраженности (табл. 32). Повышение объема форсированного выдоха после бронходилятации (ОФВ1’) на 19,7% свидетельствовало о недостаточном контроле БА у наблюдаемых нами больных, несмотря на проводимую им терапию ИГКС.
Таблица 32 Динамика ФВД у больных 3-й и 4-й групп с гиперергическим
клинико-патогенетическим вариантом АД на фоне лечения (М±m)
Определяемые |
До |
Через 6 месяцев |
Через 12 месяцев |
||
показатели |
лечения |
Группа 3 |
Группа 4 |
Группа 3 |
Группа 4 |
(%) |
(n=62) |
(n=32) |
(n=30) |
(n=32) |
(n=30) |
ФЖЕЛ |
92,9±18,4 |
98,8±16,5* |
94,3±19,3 |
103,7±19,2* |
93,8±17,6 |
ОФВ1 |
78,2±18,1 |
94,1±18,4* |
78,6±19,2 |
100,4±17,5* |
79,3±18,4 |
ОФВ1’ |
97,9±21,8 |
100,8±22,1* |
98,1±20,3 |
104,2±16,9* |
97,7±19,6 |
ЖЕЛ |
97,6±17,3 |
103,8±14,6* |
97,8±18,1 |
106,3±19,8* |
98,2±19,2 |
*p<0,05 – достоверно относительно исходных значений
Через 6 месяцев от начала лечения в 3-й группе пациентов, получавших терапию омализумабом, отмечался статистически достоверный прирост скоростных показателей бронхиальной проходимости: ФЖЕЛ возросла на 5,9%, ОФВ1 – на 15,9%, в то время как после ингаляции бронхолитика прирост ОФВ1 составил 6,7%, что в 2,9 раза меньше, чем было до начала терапии. Это свидетельствовало об улучшении бронхиальной проходимости.
Через 12 месяцев от начала терапии омализумабом у пациентов 3-й группы отмечалось дальнейшее улучшение состояния бронхиальной проходимости: ФЖЕЛ увеличилась на 10,8%, ОФВ1 вырос на 22,2%, после ингаляции бронхолитика прирост ОФВ1 составил 3,8%, что свидетельствовало о полном контроле БА.
213
Таким образом, результаты анализа лечения больных с различными клинико-патогенетическими вариантами тяжелых форм АД позволяют считать, что обоснованная, разработанная и примененная нами дифференцированная терапия показала свою высокую клиническую эффективность. Объективная динамика, выражающаяся в степени регресса основных клинических симптомов заболевания, сроках достижения клинической ремиссии и сохранении ее длительности, а также купировании проявлений сопутствующих заболеваний, убедительно демонстрирует адекватность разработанных нами методов дифференцированной терапии различных клинико-патогенетических вариантов тяжелых форм атопического дерматита у детей. В процессе лечения нами не было обнаружено побочных действий и осложнений, что свидетельствовало о безопасности применения разработанных терапевтических методик и хорошей переносимости использованных лекарственных средств. Применение дифференцированной терапии позволило значительно снизить, а в ряде случаев и полностью исключить потребность назначения топических и ингаляционных ГКС при уверенном сохранении длительного, надежного и эффективного контроля над течением «атопического марша».
7.3. Динамика основных иммунологических показателей и факторов неспецифической естественной резистентности у детей с различными клинико-патогенетическими вариантами тяжелых форм атопического дерматита под воздействием применяемых дифференцированных лечебных методик
После окончания дифференцированной терапии мы провели исследование основных наиболее характерных показателей иммунного гомеостаза и факторов неспецифической резистентности у детей с нормоергическим и гиперергическим клинико-патогенетическими вариантами АД и сравнили полученные результаты с исходными данными.
У детей с нормоергическим клинико-патогенетическим вариантом заболевания данную оценку проводили через 8 недель от начала лечения только
214
у 30 больных 1 терапевтический группы, получавших альфа-глутамил- триптофан в составе традиционной комплексной терапии.
Применение альфа-глутамил-триптофана оказывало выраженное нормализующее влияние на состояние клеточного и гуморального звеньев иммунитета (табл. 33).
Таблица 33 Основные показатели клеточного и гуморального иммунитета
у детей с нормоергическим клинико-патогенетическим вариантом до и после лечения альфа-глутамил-триптофаном (М±m)
|
Дети |
Дети с нормоергическим |
|
Показатель |
контрольной |
клинико-патогенетическим вариантом АД |
|
группы |
|
|
|
|
До лечения (n=32) |
Через 8 недель |
|
|
(n=30) |
||
|
лечения (n=30) |
||
|
|
|
|
СD3+, % |
66,3±1,2 |
61,3±0,51* |
61,8±0,4* |
|
|
|
|
СD4+, % |
36,2±1,1 |
36,8±1,8 |
36,5±1,2 |
|
|
|
|
СD8+, % |
20,1±1,4 |
32,6±1,3* |
20,4±1,5** |
|
|
|
|
СD20+, % |
18,0±1,6 |
20,1±1,8 |
18,9±1,4 |
|
|
|
|
СD30+, % |
10,8±1,3 |
14,7±0,9* |
12,9±0,6 * , ** |
|
|
|
|
ИРИ |
1,9±0,1 |
1,2±0,2* |
1,8±0,2** |
|
|
|
|
IgG, г/л |
13,0±0,5 |
9,1±0,3* |
13,2±0,3** |
|
|
|
|
IgA, г/л |
2,3±0,17 |
2,1±0,15 |
2,2±0,18 |
|
|
|
|
IgM, г/л |
2,1±0,1 |
2,3±0,2 |
2,2±0,2 |
|
|
|
|
*р<0,001 – достоверно по отношению к детям контрольной группы;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Так, количество Т-лимфоцитов с рецептором CD8+ достоверно снизилось и не отличалось от контрольного уровня. В то же время наблюдалось достоверное снижение CD30+ клеток по сравнению с исходным уровнем, однако не достигшее значений контрольной группы. По сравнению с исходными величинами ИРИ достоверно повысился и достиг нормальных
215
показателей группы контроля. Уровень IgG также достоверно повысился и не отличался от показателей контрольной группы.
Результаты проведенных иммунологических исследований свидетельствовали о положительных изменениях в цитокиновом профиле и содержании эозинофилов в кровяном русле у детей 1 терапевтической группы, получавших альфа-глутамил-триптофан (табл. 34).
Таблица 34 Уровень продукции цитокинов в сыворотке крови и эозинофилов
вкровяном русле у детей с нормоергическим клинико-патогенетическим вариантом до и после лечения альфа-глутамил-триптофаном (М±m)
|
Дети |
Дети с нормоергическим |
|
Показатель |
контрольной |
клинико-патогенетическим вариантом АД |
|
группы |
|
|
|
|
До лечения (n=32) |
Через 8 недель |
|
|
(n=30) |
||
|
лечения (n=30) |
||
|
|
|
|
IL-4, пг/мл |
22,4±1,6 |
14,9±1,8* |
22,1±1,5** |
|
|
|
|
IL-5, пг/мл |
17,5±1,8 |
19,2±1,5 |
18,6±1,4 |
|
|
|
|
IL -10, пг/мл |
12,0±1,3 |
13,4±1,6 |
12,8±1,2 |
|
|
|
|
IL-13, пг/мл |
21,2±2,5 |
15,3±2,2* |
21,4±2,3** |
|
|
|
|
TNF-α, пг/мл |
42,3±2,4 |
45,6±2,3 |
43,7±2,2 |
|
|
|
|
INF-γ, пг/мл |
25,6±3,2 |
25,1±2,4 |
25,4±2,8 |
|
|
|
|
EOS, ×10 9/л |
Референтные |
|
|
значения – |
0,42±0,15* |
0,15±0,02 ** |
|
|
0 – 0,2 |
|
|
*р<0,001 – достоверно по отношению к детям контрольной группы и референтным значениям;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Из представленных в таблице 34 данных видно, что уровень эозинофилов периферической крови через 8 недель лечения достоверно снизился до 0,15±0,02×10 9/л по сравнению с исходной величиной до начала терапии (0,42±0,15×10 9/л) и находился в пределах референтных значений (0 – 0,2×10 9/л).
216
Кроме того, нами отмечено достоверное повышение уровней IL-4 и IL-13 по сравнению с исходными значениями (22,1±1,5 пг/мл и 21,4±2,3 пг/мл после лечения при 14,9±1,8 пг/мл и 15,3±2,2 пг/мл до начала лечения), достигшими показателей контрольной группы. Также мы наблюдали небольшое
(статистически недостоверное) снижение содержания IL-5, IL-10 и TNF-α (18,6±1,4 пг/мл, 12,8±1,2 пг/мл и 43,7±2,2 пг/мл соответственно) по сравнению с полученными результатами до начала лечения (19,2±1,5 пг/мл, 13,4±1,6 пг/мл и 45,6±2,3 соответственно), не отличающееся от показателей контрольной группы
(17,5±1,8 пг/мл, 12,0±1,3 пг/мл и 42,3±2,4 пг/мл). Уровень INF-γ после лечения
(25,4±2,8 пг/мл) также не отличался от исходных величин и значений группы контроля (25,1±2,4 пг/мл и 25,6±3,2 пг/мл соответственно). Представленные данные убедительно свидетельствуют о нормализации функциональной активности клеток моноцитарно-макрофагального ряда у больных с нормоергическим клинико-патогенетическим вариантом АД в процессе лечения альфа-глутамил-триптофаном и восстановлении адекватного регуляторного ответа.
Проведенные исследования после применения альфа-глутамил- триптофана показали (табл. 35), что концентрация МИФ у больных 1-й терапевтической группы в среднем достоверно уменьшилась с 42,9±3,1 нг/мл до 5,4±0,5 нг/мл и достигла нормальных референтных значений (5,2±0,3 нг/мл).
Применение альфа-глутамил-триптофана (рис. 31) способствовало достоверному уменьшению спонтанного высвобождение МИФ культурой моноцитов больных с нормоергическим вариантом АД (с 16,4±1,2 нг/мл – в исходном фоне до 4,8±1,3 нг/мл при 4,2±1,3 нг/мл в группе контроля). Отмечалось достоверное снижение продукция МИФ моноцитами больных с нормоергическим вариантом АД при стимуляции их конковалином А с 66,4±8,6 нг/мл до 25,8±1,6 нг/мл при референтных значениях 25,3±1,4 нг/мл.

217
Таблица 35 Концентрация МИФ в крови у детей с нормоергическим
клинико-патогенетическим вариантом АД под влиянием альфа-глутамил-триптофана (М±m)
|
Концентрация МИФ (нг/мл) |
||
Обследуемые группы |
|
|
|
До начала лечения |
Через 8 недель лечения |
||
|
|||
|
(n=30) |
(n=30) |
|
|
|
|
|
Дети с нормоергическим |
42,9±3,1* |
5,4±0,5** |
|
вариантом АД |
|||
|
|
||
Дети контрольной |
5,2±0,3 |
||
группы (n=30) |
|||
|
|
||
*р<0,001 – достоверно по отношению к детям контрольной группы;
**р<0,05 – достоверно по сравнению с исходным уровнем.
нг/мл
|
|
66,4 |
70 |
|
|
60 |
|
|
50 |
|
|
40 |
25,3 |
25,8 |
|
|
|
30 |
|
16,4 |
|
|
|
20 |
4,2 |
4,8 |
|
||
10 |
|
|
0  Уровень продукции МИФ
Уровень продукции МИФ
 Спонтанная продукция МИФ у детей группы контроля (n=30)
Спонтанная продукция МИФ у детей группы контроля (n=30)
 МИФ у детей группы контроля после стимуляции конковалином А (n=30)
МИФ у детей группы контроля после стимуляции конковалином А (n=30)
 Спонтанная продукция МИФ у детей с нормоергическим вариантом АД до лечения (n=30)
Спонтанная продукция МИФ у детей с нормоергическим вариантом АД до лечения (n=30)
 МИФ у детей с нормоергическим вариантом АД после стимуляции конковалином А до лечения (n=30)
МИФ у детей с нормоергическим вариантом АД после стимуляции конковалином А до лечения (n=30)
 Спонтанная продукция МИФ после терапии альфа-глутамил-триптофаном (n=30)
Спонтанная продукция МИФ после терапии альфа-глутамил-триптофаном (n=30)
 МИФ после терапии альфа-глутамил-триптофаном и стимуляции конковалином А (n=30)
МИФ после терапии альфа-глутамил-триптофаном и стимуляции конковалином А (n=30)
Рисунок 31. Уровень спонтанной продукции МИФ моноцитами крови у детей с нормоергическим клинико-патогенетическим вариантом АД до и после стимуляции конковалином А под воздействием альфа-глутамил- триптофана
218
В результате применения альфа-глутамил-триптофана площадь миграции клеток, определяемая балансом МИФ и МСФ у детей с нормоергическим вариантом АД, увеличилась более чем на 14%. Индекс клеточной миграции (табл. 36), значительно уменьшившись, варьировал от 3,2±0,5% до 5,4±0,6% и не отличался от референтных значений. Наиболее значимое падение индекса клеточной миграции прослеживалось у пациентов с обширными очагами поражения и распространенной вторичной бактериальной инфекцией.
Таблица 36
Среднее значение индекса клеточной миграции у детей с нормоергическим клинико-патогенетическим вариантом АД
до и после применения альфа-глутамил-триптофана (М±m)
|
Индекс клеточной миграции (%) |
||
Обследуемые группы |
|
|
|
До начала лечения |
Через 8 недель |
||
|
(n=30) |
лечения (n=30) |
|
|
|
|
|
Дети с нормоергическим |
34,2±7,8* |
5,3±0,6** |
|
вариантом АД |
|||
|
|
||
*р<0,001 – достоверно по отношению к референтным значениям;
**р<0,05 – достоверно по сравнению с исходным уровнем.
Таким образом, на основании результатов проведенных исследований можно сделать вывод о том, что положительный клинический эффект, связанный с применением альфа-глутамил-триптофана у детей с нормоергическим клинико-патогенетическим вариантом АД, в немалой степени обусловлен нормализацией продукции МИФ.
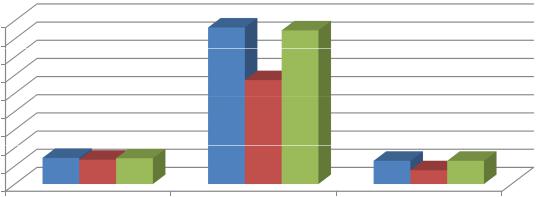
Проведенные исследования показали, что применение альфа-глутамил- триптофана у детей 1-й терапевтической группы с нормоергическим вариантом АД способствовало повышению функционально-метаболической активности нейтрофилов (рис. 32).
Показатели биоцидности нейтрофилов в спонтанном НСТ-тесте после лечения альфа-глутамил-триптофаном существенно не изменились (6,7±0,3% – в исходном фоне и 7,1±0,2% – после терапии, при референтных значениях –
219
7,2±0,2%). Однако показатель индуцированного зимозаном НСТ-теста после применения альфа-глутамил-триптофана достоверно повысился и находился в пределах референтных значений (42,3±2,4% – после лечения при 43,1±2,2% – в группе контроля). Также после лечения нами отмечено повышение индекса стимуляции зимозаном с 3,8±0,01 до 6,4±0,01, которое носило достоверный характер и не отличалось от показателей контрольной группы.
|
|
|
|
43,1 |
42,3 |
|
|
|
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
35 |
|
|
|
28,6 |
|
|
|
30 |
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
20 |
|
|
|
|
|
|
|
15 |
7,2 |
6,7 |
7,1 |
|
|
6,4 |
6,4 |
|
|
|
|
||||
10 |
|
|
|
|
|
|
3,8 |
5 |
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
Спонтанный НСТ-тест % |
Зимозан индуцированный |
Индекс стимуляции |
||||
|
|
|
|
НСТ-тест % |
|
|
|
 Дети группы контроля (n=30)
Дети группы контроля (n=30)
 Дети с нормоергическим вариантом АД до лечения (n=32)
Дети с нормоергическим вариантом АД до лечения (n=32)
 Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Рисунок 32. Показатели биоцидности нейтрофилов у детей с нормоергическим клинико-патогенетическим вариантом АД до и после применения альфа-глутамил-триптофана
Проведенные после окончания лечения альфа-глутамил-триптофаном исследования показали (рис. 33), что интенсивность экспрессии TLR2- и TLR4-
моноцитами достоверно повысилась (55,3±4,2 УЕФ и 42,1±3,6 УЕФ) по сравнению с исходными величинами (44,2±4,8 УЕФ и 28,1±7,1 УЕФ) и не отличалась от показателей контрольной группы (56,5±4,6 УЕФ и 42,9±3,2 УЕФ).

220
(УЕФ) |
56,5 |
|
55,3 |
|
|
|
|
||
|
|
|
|
|
флуоресценции |
60 |
44,2 |
|
|
30 |
42,9 |
42,1 |
||
|
|
|||
|
50 |
|
||
|
|
|
|
|
Интенсивность |
40 |
|
|
28,1 |
20 |
|
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
0 |
|
|
|
TLR2 рецепторы TLR4 рецепторы
 Дети группы контроля (n=30)
Дети группы контроля (n=30)
 Дети с нормоергическим вариантом АД до лечения (n=34)
Дети с нормоергическим вариантом АД до лечения (n=34)
 Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Дети с нормоергическим вариантом АД после терапии альфа-глутамил-триптофаном (n=30)
Рисунок 33. Уровень экспрессии моноцитами TLR2- и TLR4-рецепторов у
детей с нормоергическим клинико-патогенетическим вариантом АД после лечения альфа-глутамил-триптофаном
После применения альфа-глутамил-триптофана аналогичная нормализация экспрессии TLR2 и TLR4 отмечена нами у больных с нормоергическим вариантом АД и на лимфоцитах периферической крови (рис. 34). Так, интенсивность флюоресценции лимфоцитов для рецепторов TLR2 и TLR4 достоверно повысилась (12,1±2,2 УЕФ и 13,2±2,3 УЕФ) по сравнению с результатами до начала лечения (7,1±2,1 УЕФ и 6,8±2,5 УЕФ) и достигла значений группы контроля (11,6±2,2 УЕФ и 12,3±2,1 УЕФ).
Проведенные исследования показали (рис. 35), что применение альфа- глутамил-триптофана привело к достоверному увеличению экспрессии TLR4 на нейтрофильных гранулоцитах у больных с нормоергическим вариантом АД
(49,1±2,4 УЕФ – до начала лечения и 58,7±3,2 УЕФ – после лечения при
59,2±5,6 УЕФ – в группе контроля). Вместе с тем интенсивность экспрессии TLR2 осталась на прежнем уровне.
