
- •Измерение температуры
- •Основные положения
- •2. Описание лабораторного стенда и порядок выполнения работы
- •3. Контрольные вопросы
- •Основные положения
- •Изохорный процесс
- •Изобарный процесс
- •Изотермический процесс
- •Адиабатный процесс
- •Политропные процессы
- •Описание лабораторного стенда
- •Порядок выполнения работы
- •Обработка результатов измерений
- •5. Контрольные вопросы
- •Измерение теплоёмкости воздуха
- •Основные положения
- •2. Описание лабораторного стенда
- •3. Порядок выполнения работы
- •4. Обработка результатов измерения
- •5. Контрольные вопросы
- •2. Описание лабораторного стенда
- •3. Порядок выполнения работы
- •4. Обработка результатов измерения
- •5. Контрольные вопросы
- •1. Основные положения
- •2. Описание лабораторного стенда
- •3. Порядок проведения работы
- •4. Обработка результатов измерения
- •5. Контрольные вопросы
- •1. Основные теоретические положения
- •2. Экспериментальная часть
- •2.1. Теплоотдача от горизонтальной трубы (поперечное обтекание)
- •Плотность
- •Температурный коэффициент объёмного расширения:
- •Коэффициент теплопроводности:
- •Коэффициент кинематической вязкости:
- •2.2. Теплоотдача от вертикальной трубы (продольное обтекание)
- •3. Контрольные вопросы
- •1. Основные положения
- •Переходный режим (2320 Re 104)
- •2. Описание лабораторного стенда
- •3. Порядок выполнения работы
- •4. Обработка результатов измерений
- •5. Контрольные вопросы
- •1. Основные положения
- •Закон Планка
- •Закон смещения Вина
- •Закон Стефана – Больцмана
- •Закон Кирхгофа
- •4. Описание лабораторного стенда
- •5. Порядок выполнения работы
- •6. Обработка результатов измерений
- •5. Контрольные вопросы
- •Литература
- •Оглавление
Порядок выполнения работы
Опустить колбу в емкость с водой, проверив, чтобы вода в ёмкости полностью закрывала стеклянную колбу.
Записать начальные значения параметров состояния воздуха в колбе и атмосферное давление. Для этого в лаборатории должен быть барометр.
Включить установку, с помощью регулятора напряжения установить мощность нагревателя электроплитки так, чтобы скорость нагрева не превышала 2 градуса в течение 5 минут.
Через каждые 2 градуса изменения температуры в протокол измерений (табл. 2) заносить показания термометра и манометра.
Измерения заканчиваются, когда столбик воды в трубке U-образного манометра начнет подходить к верхнему уровню.
После последнего замера быстро поднять колбу из емкости с водой.
Установить регулятор напряжения в начальное положение и выключить установку.
Таблица 2
|
Номер замера |
Температура |
Избыточное давление |
Атмосферное давление, Па |
Абсолютное давление, Па | ||
|
С |
К |
Мм вод. Ст. |
Па | |||
|
1 2 3 4 5 . . . i |
|
|
|
|
|
|
Обработка результатов измерений
По экспериментальным данным построить зависимость рэксп = f(Т), учитывая, что в качестве параметров состояния используются абсолютное давление и абсолютная температура.
На этом же графике построить теоретическую зависимость ртеор = f(Т), рассчитав по уравнению изохорного процесса значения давления системы при соответствующих значениях температуры. Расчеты первых 2-х значений привести в протоколе полностью, остальные результаты свести в таблицу.
Определить изменение внутренней энергии системы при условии, что теплоемкость системы постоянная (можно принять сv = 0,71
 ).
).Определить изменение энтропии системы при постоянной теплоемкости.
На основе анализа полученных графиков определить максимальную относительную погрешность экспериментальных данных.
5. Контрольные вопросы
Что называется термодинамическим процессом?
Какие характеристики процесса определяются при типовой схеме его изучения?
Дать характеристику основным термодинамическим процессам в соответствии с типовой схемой.
Какие процессы называются политропными?
Какие процессы и почему называются частными случаями политропного процесса?
Дать физическую интерпретацию диаграммы политропных процессов.

Измерение теплоёмкости воздуха
Цель работы: определение изобарной теплоёмкости воздуха методом проточного калориметра.
Задания:
Экспериментально определить среднюю объёмную изобарную теплоемкость воздуха.
На основе полученных опытных данных рассчитать средние массовую и молярную изобарную теплоемкости и средние массовую, объёмную и молярную теплоемкости воздуха.
Определить показатель адиабаты для воздуха.
Сравнить полученные данные с табличными.
Дать оценку точности экспериментальных данных.
Основные положения
Теплоёмкость – свойство, показывающее, какое количество теплоты необходимо подвести к системе, чтобы изменить её температуру на один градус:
![]() .
(1)
.
(1)
В такой формулировке теплоемкость имеет смысл экстенсивного параметра, т.е. зависящего от количества вещества в системе.
В этом случае невозможно количественно оценивать тепловые свойства различных материалов, сравнивая их между собой. Для практического применения гораздо более информативным параметром является так называемая удельная теплоёмкость.
Удельная теплоёмкость показывает, какое количество теплоты необходимо подвести к единице количества вещества, чтобы нагреть его на один градус. В зависимости от того, в каких единицах измеряется количество вещества, различают:
удельную массовую теплоёмкость (С). В системе СИ измеряется в
 ;
;удельную объёмную теплоёмкость (С). В системе СИ измеряется в
 ;
;удельную молярную теплоёмкость (С). В системе СИ измеряется в
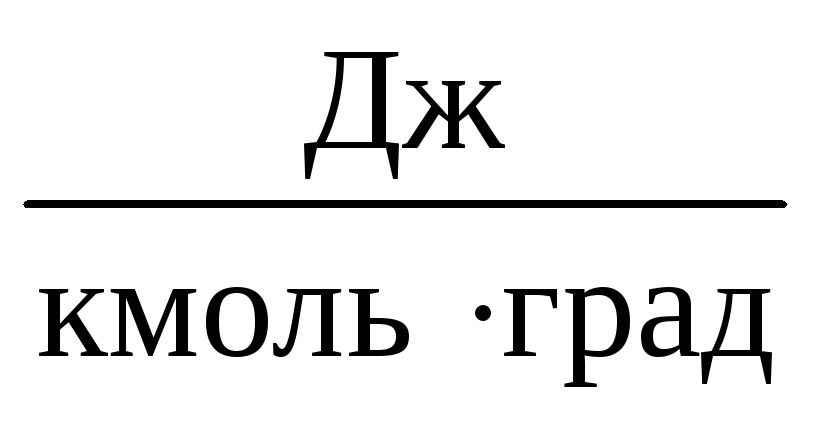 .
.
Различные виды удельной теплоемкости связаны между собой:
![]() ,
(2)
,
(2)
где С, С´, Сμ – соответственно, удельная массовая, объёмная и молярная теплоёмкость;
![]() – плотность
газа при нормальных физических условиях,
кг/м3;
– плотность
газа при нормальных физических условиях,
кг/м3;
μ – молярная масса газа, кг/кмоль;
![]() –объём одного
киломоля идеального газа при нормальных
физических условиях.
–объём одного
киломоля идеального газа при нормальных
физических условиях.
В общем случае теплоемкость зависит от температуры, при которой её определяют.
Теплоемкость, определяемая при данном значении температуры, т.е. когда изменение температуры системы в данный момент времени стремится к нулю (Т → 0), называется истинной теплоёмкостью.
 .
(3)
.
(3)
Однако выполнение инженерных расчетов процессов теплообмена существенно упрощается, если принять, что при совершении процесса в интервале изменения температуры системы от Т1 до Т2 теплоёмкость не зависит от температуры и остается постоянной. В этом случае в качестве расчетной принимается так называемая средняя теплоёмкость.
(4)
Теплоёмкость зависит от характера процесса подвода теплоты к системе. В изобарном процессе для того, чтобы нагреть систему на один Средняя теплоёмкость (Ст) – теплоёмкость системы постоянная в интервале изменения температуры от Т1 до Т2.
![]() .
градус необходимо
подвести большее количество теплоты,
чем в изохорном процессе. Это связано
с тем, что в изобарном процессе теплота
затрачивается не только на изменение
внутренней энергии системы, как в
изохорном процессе, но еще и на совершение
системой работы изменения объёма.
.
градус необходимо
подвести большее количество теплоты,
чем в изохорном процессе. Это связано
с тем, что в изобарном процессе теплота
затрачивается не только на изменение
внутренней энергии системы, как в
изохорном процессе, но еще и на совершение
системой работы изменения объёма.
В связи с этим различают изобарную (Ср) и изохорную (Сv) теплоёмкости, причем изобарная теплоёмкость всегда больше изохорной. Связь между этими видами теплоемкости определяется формулой Майера:
Ср = Сv + R , (5)
где R – газовая постоянная, Дж/(кгград).
При практическом применении данной формулы необходимо быть внимательным в отношении соответствия размерности величин (Ср), (Сv) и R. В данном случае, например, необходимо использовать удельную массовую теплоемкость. Данная формула будет справедлива и для других видов удельной теплоемкости, но во избежание расчетных ошибок всегда необходимо обращать внимание на соответствие размерностей величин, входящих в формулу. Например, при использовании вместо R универсальной газовой постоянной Rμ теплоёмкость должна быть удельной молярной и т.д.
В изотермическом процессе вся теплота, подводимая к системе, затрачивается на совершение внешней работы, а внутренняя энергия и, следовательно, температура не изменяются. Теплоемкость системы в таком процессе бесконечно велика. В адиабатном процессе температура системы изменяется без теплообмена с внешней средой, а значит, теплоёмкость системы в таком процессе будет равна нулю. По этой причине не существует понятий изотермической или адиабатной теплоёмкости.
