
- •Тема 8. Происхождение человека. Представления об антропосоциогенезе в современном естествознании.
- •Часть 1. Теме посвящены две лекции.
- •30% Россиян – затруднились ответить – обратите внимание на это потрясающее число (при достаточно высоком уровне образования в России)
- •Тема 8. Часть 2. Происхождение человека. Представления об антропосоциогенезе в современном естествознании.
- •2018. Rosehip cells (клетки шиповника)
- •1) Альтруизм. Эгоизм. 2) Сексуальное поведение. 3) Агрессия
- •Тема 10. Политическое и эстетическое поведение человека: биологические и социальные факторы в представлениях биополитики и биоэстетики.
- •1. Генетические факторы
- •2. Гормоны
- •3. Нейрострасмиттеры (нейромедиаторы)
- •Тема 11. Проблема индвидуальности человека в современной науке.
- •1. Рождение в результате полового размножения
- •2. Мутации
- •3. Средовые воздействия
- •Тема 11. Часть 2. Проблема индивидуальности человека в современной науке.
- •1. Антропологическая школа уголовного права.
- •Тема 12. Ценностные и правовые регулятивы развития новых технологий и направлений науки.
- •2. Для получения новых источников энергии.
- •3. В сельском хозяйстве:
- •Электронный микроскоп.
- •Объемные наноструктурированные материалы (3d)
- •Наноструктурированные планарные материалы (2d)
- •Наноструктурированные 1d материалы.
- •Посмотрим на новые развивающиеся нанообласти:
- •Недостатки правового регулирования этой сферы. Юристы пишут в специализированной литературе следующее:
- •Часть 1. Социокультурный контекст и факторы формирования современной биоэтики.
- •I. Естественнонаучный подход.
- •3. Формирование центральной нервной системы.
- •Тема 13. Человека как объект и субъект естественнонаучного познания: этическое и правовое регулирование биоэтических ситуаций.
- •Часть 2. Изменение представления о пределах человеческого существования в свете современных научных данных (начало жизни).
- •2012 Год. Дания.
- •1.Пределы допустимых манипуляций с половыми клетками и эмбрионами.
- •Тема 13. Человек как объект и субъект естественнонаучного познания: этическое и правовое регулирование биоэтических ситуаций
- •Часть 3 Смерть и умирание как биоэтические проблемы
- •2012 Год Канада, воз «Международные руководящие принципы для констатации смерти»:
- •Тема 13. Человек как объект и субъект естественнонаучного познания: этическое и правовое регулирование
- •Часть 4. Биоэтическое регулирование медико-биологических экспериментов
- •Тема 13. Человек как объект и субъект естественнонаучного познания: этическое и правовое регулирование биоэтических ситуаций. Лекция 4. Моральные проблемы трансплантации органов и тканей.
- •1. Рутинный забор; (советская система здравоохранения с 1937 г. До 1992 года).
- •2. Забор, основанный на презумпции согласия (предполагаемое согласие, “Opting out” (Opt-out))
- •3. Забор, основанный на «презумпции несогласия» (четко выраженное согласие, информированное согласие, “opting in” (opt-in))
- •1992 Г. "Закон Российской Федерации о трансплантации органов и (или) тканей человека"
- •Тема 14. Тренды науки XXI века: проблемы и перспективы
Тема 12. Ценностные и правовые регулятивы развития новых технологий и направлений науки.
1. Проблема ценности жизни: феномен «биотехнологии» и «генной инженерии».
2. Философские основания этико-социальных проблем развития генной инженерии и биотехнологии.
3. Нанотехнология и нанонаука: понятия, история становления (следующая лекция).
4. Основные направления и перспективы нанотехнологий.
Мы сегодня начинаем 12 тему курса, и она открывает для нас блок, связанный с регуляцией развития новейших направлений науки и технологий. Напоминаю, что в качестве одной из особенностей современной науки вы выделяли ориентацию на так называемую «технонауку», когда процесс получения знаний зависим и не может быть отделён от процесса технологических преобразований. В рамках 12 темы (мы посвятим ей 2 лекции) будет разговор об аксиологических (ценностных) и правовых регулятивах, развитии таких остромодных направлений науки и технологии, как биотехнология, генно-инженерная деятельность (этому будет посвящена сегодняшняя лекция) и нанотехнология и нанонаука (следующая лекция). После этой темы вплоть до окончания семестра в центре нашего внимания будет человековедческая проблематика – представление о том, как происходит трансформация естественно заданных границ человеческой жизни под влиянием науки и технологий, этико-правовое регулирование начала жизни (о статусе эмбриона, новых репродуктивных технологиях), конца жизни (критериях смерти, проблеме эвтаназии, проблеме поддержания жизни с помощью реанимационных технологий); проблемы, связанные с возможностями вмешательства в физическую и психическую целостность человека (экспериментирование, психиатрия, трансплантология); уделим особое внимание проблемам регулирования био-медицинских ситуаций в условиях пандемии. И закончим мы курс взглядом в будущее: последняя лекция будет посвящена трендам науки. С сегодняшней темы и до конца семестра будет разговор об очень непростых объектах, ситуациях, конфликтах, которые порождаются развитием науки и технологий.
Итак, сегодня в фокусе нашего внимания биотехнология. Обратимся к анализу термина. В самом слове биотехнология содержится указание на сочетание «био» – «жизнь» и «способом индустриального производства», «техно» – искусство, «логос» – учение. Термин «биотехнология» получил широкое распространение с 70-х годов XX века, и употребляется в широком и узком смысле слова. «Биотехнология - технология промышленного применения естественных и направленно созданных живых систем в качестве средства для удовлетворения потребностей человека».
Мы увидим, как взаимодействуют этические (ценностные) и правовые регулятивы. В начале 21-го века общество уже не может позволить себе, чтобы наука развивалась бесконтрольно.
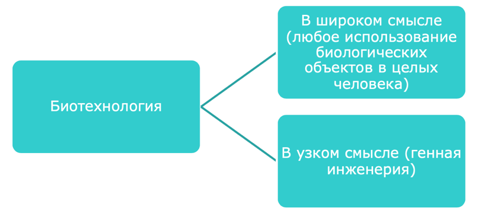
В широком смысле биотехнология – совокупность технологий, где в процесс производства включаются живые объекты; под это определение подпадают традиционные человеческие практики – уже много тысяч лет человек варит пиво, осуществляет выделку кож, обработку чая, хлебопечение и т.п. – все эти технологии базируются на применении микроорганизмов и известны человеку очень давно. Например, в Вавилоне пивоварение было известно уже 6 тыс. лет назад. В течении тысячелетий человек использовал процессы, не зная ничего ни о клетках, ни о ферментах, ни о видовой специфичности или генетическом аппарате. Но только овладение микробиологическим синтезом, то есть целенаправленным получением биологически-активных веществ с помощью микроорганизмов, (основана эта технология на действии микробной клетки) позволило создать микробиологическую промышленность. Поэтому, когда сегодня говорят о биотехнологии в широком смысле – имеют в виду биологическую промышленность, основу которой составляют живые организмы, микроорганизмы, растения, животные, ткани разных биологических видов в интересах человека. Современная биоинженерия основана на достижениях молекулярной биологии, генетики и биоорганической химии. Ее особенность в том, что она способна использовать биологические объекты для того, чтобы производить небиологические объекты по происхождению, но естественные по веществу.
В узком смысле – представление о направленном изменении наследственности, то есть это знания и технологи, которые ведут к созданию живых объектов через получение рекомбинантной ДНК. В узком смысле это синоним генно-инженерной деятельности.
Генной инженерией называют область молекулярной генетики, разрабатывающую методы конструирования новых функционально активных генетических программ и, соответственно, деятельность по применению этих сконструированных генетических программ. Датой зарождения генной инженерии принято считать 1972 год, когда группа ученых под руководством Берга (США) создала первую рекомбинантную молекулу ДНК – то есть полученную от разных организмов. Она состояла из фрагмента ДНК, взятого у обезьяньего вируса ОВ40 и бактериофага (т.е. вируса бактерии).
Занфира: белок – рестриктаза.
Биотехнология провозглашен одним из критериев прогресса, ключевое направление научного прогресса, отвечающее национальным интересов во многих странах. И это мировой тренд.
Качественные особенности биотехнологии по сравнению с другими видами технологии:
1. Во-первых, интегративный характер. Очень тесная связь науки и производства, потому что то, что становится методом получения объектов – это интеграция, во-первых, разных наук, и, во-вторых, интеграция науки с производством. Технико-технологические приемы – результат интеграции биологии с физикой, химией, кибернетикой и другими науками.
2. Во-вторых, сращивание науки и производства. В форме биотехнологии задается ориентация на развитие нового технологического способа производства. Возникает новый тренд на производство за счёт именно использования знаний. Если мы посмотрим на структуру биотехнологических компаний, то в них 95% работников – это исследователи (учёные), а рабочий индустриальный персонал составляет не больше 5%. Это то самое инновационное производство.
3. Система, которая является биологической и искусственной одновременно. Результатом конструирования является искусственно сконструированная, но при этом самодостаточная, саморегулирующаяся система (биологическая и искусственная одновременно). По происхождению получаемый объект (продукт) искусственный (так как сконструирован и создан человеком); а по вещественному составу и по функционированию этот объект можно назвать естественным (биологическим). Эта коллизия будет иметь правовые последствия.
Для того, чтобы развивать генно-инженерную деятельность, то есть биотехнологию в узком смысле, а дальше мы будем говорить именно о ней, необходимо было разработать методы расшифровки последовательности нуклеотидов в молекуле ДНК, то есть разработать методы секвенирования.
Этапы создания рекомбинантных ДНК
Важную роль в генной инженерии играют:
метод секвенирования биополимеров. Небольшой ролик, который иллюстрирует, что такое секвенирование: http://www.youtube.com/watch?v=91294ZAG2hg. Слишком разным оказался состав молекул, следовательно, нужно понять, какую роль играет последовательность генов, какие гены за что отвечают, как происходит регуляция. Секвенирование (дословный перевод - последовательность) – термин возник тогда, когда стало понятно, что в биологии свойства и функции полимеров не могут определяться просто их составом, как привыкли думать химики, слишком похожим оказался состав ДНК у совершенно разных (с точки зрения функций) молекул, а если дело не в составе, значит ключевую роль играет последовательность. Наибольший интерес вызывает не только последовательность генома, а понимание того, как геном функционирует (включение и выключение генов) – то есть как геном регулируется и какие генные пути начинают работать в ответ на воздействие внешней среды.
Секвенирование
Секвенирование – первый результат, который лежит в основе создания рекомбинантной ДНК. Секвенирование – метод установления последовательность генов в ДНК, создание ферментов специализированно «разрезающих» и «сшивающих» молекулы ДНК.
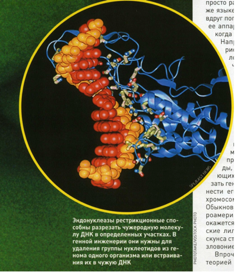
Второй метод – разрезание и сшивание ДНК с помощью ферментов для конкретной последовательности нуклеотидов, они сшивают или разрезают молекулу ДНК. Второе, что нужно было сделать в науке – это разработать ферменты, с помощью которых можно было бы фрагменты ДНК определять, отделять друг от друга (т.е. вырезать) и сшивать. Дело в том, что с ДНК невозможно работать никакими самыми тонкими механическими приборами, никакой скальпель не позволит вам разрезать ДНК в нужном месте, и эту функцию выполняют ферменты, специально разрабатываемые для конкретной последовательности нуклеотидов. Они распознают эту последовательность и разрезают или сшивают (правильное использование терминологии) структуру ДНК в нужном месте.
Далее я коротко расскажу, как создаётся трансгенный организм.
Этапы создания рекомбинантных ДНК
1. Точно определить границы «донорского гена». Во-первых, нужно точно определить, какая функция нам нужна, на базе какого белка она реализуется. То есть нужно определить тот донорский ген, в котором записана информация о необходимом нам белке. Например, нам нужно получить в промышленных масштабах интерферон или гормон роста, или глутамат, который придаёт вкус супам быстрого приготовления, то есть можно выделить фермент, который нам нужен и определить, какая структура ДНК за него отвечает (находим нужный донорский ген). Нужный ген определяют, используя биологический секвенатор.
2. Вырезать ген или копировать нужный участок ДНК. Ножницами служат специальные ферменты – рестриктазы. Ферменты разрезают молекулу в строго определённом месте, где находятся нуклеатиды, распознаваемые данной рестриктазой. При этом образуются так называемые «липкие концы» (они не липкие в обыденном смысле, просто обрезанные) – рестриктаза оставляет зубчатые концы у рекомбинантных ДНК. Это те участки, благодаря которым последовательность нуклеатидов может быть восстановлена в целостность. «Липкие концы» содержат короткие фрагменты одноцепочечной ДНК, и эти фрагменты могут с легкостью соединяться с новой ДНК, еси комплементарно подходят друг другу основания (вспоминайте генетику). Между липкими концами можно встроить дополнительные пары оснований: например, можно выделить какие-то гены из разных организмов и соединить их вместе, встраивая необходимые гены в какую-то другую структуру ДНК; можно встроить дополнительные гены – флуоресцентными или отвечающими за быстрое размножение.
3. Встроить ген в другую молекулу ДНК с использованием природных переносчиков генетической информации – вирусов и плазмид. Плазмида – небольшие молекулы ДНК, которые находятся в бактериальной клетке отдельно от основного генома; это генетический элемент, который способен стабильно существовать в клетке (к плазмидам относятся группу митохондрий, пластид или групп сцеплений). Плазмида вне клетки – это просто молекула ДНК; а плазмида внутри клетки ведет вполне осмысленное существование; плазмида использует часть клетки для питания, плазмида напоминает домашнее животное, вирус – сам рубит сук, на котором сидит, убивает клетку. Плазмида вырабатывает фермент, который разрушает пеницилин, встает на защиту клетки как домашнее животное. Способность плазмиды переходить из клетки в клетку используется в генной инженерии.

Третий этап – встроить ген в другую структуру ДНК, которая обладает востребованным свойством, например, быстротой тиражирования того белка, который записан в ДНК в больших количествах. Чтобы доставить ген в другую ДНК, например, находящуюся в клетке обычно используют природные переносчики генетической информации – вирусы и плазмиды.
Вирусы часто используют в качестве векторов, проникающих в животные клетки. Например, геном обезьяньего вируса ОВ-40 обладает способностью встраиваться в хромосомы клеток млекопитающих. Так, например, с помощью этого вируса фрагменты ДНК мыши и кролика, которые ответственны за гемоглобин, перенесли в клетки обезьян, где они стали активно функционировать. Большой интерес представляет непосредственный перенос генов в клетки животных, но эта проблема пока находится в стадии разработки.
Второй природный переносчик генетической информации – плазмида – это небольшие кольцевые молекулы ДНК, которые находятся в бактериальной клетке, отдельно от основного генома. Плазмиды – это тоже фактор наследственности. Но, находящийся вне хромосом, этот генетический элемент приспособлен стабильно существовать в клетке, автономно, без связи с хромосомным состоянием наследственности. К плазмидам относят генетический аппарат клеточных организмов, например, митохондрий, пластид, а также группы сцеплений, не являющиеся жизненно важными для содержащих их клеток.
Для чего вообще клеткам нужны плазмиды? Плазмина вне клетки – это просто молекула ДНК. А внутри клетки она ведёт, скажет так, вполне осмысленное существование, ога использует часть ресурсов клетки для размножения, и в плазмида в этом смысле ведёт себя умнее вируса, потому что, когда вирус попадает в клетку, он рубит сук, на котором сидит, убивает клетку, а плазмида размножается вместе с клеткой-хозяином. Если вирус можно уподобить алчному хищнику, то плазмида напоминает домашнее животное – хозяин обязан кормить это домашнее животное и вроде как оно бесполезно, но до тех пор, когда, например, нужно защитить дом, тогда собака может спасти хозяина. И если клетка попадает во враждебную среду, например, в среде появляется пенициллин, то плазмида подобно верному псу бросается на борьбу с врагом. Плазмида вырабатывает фермент, который разрушает пенициллин, и позволяет клетке выжить. Как хозяин может отдать собаку соседу, так и клетки могут передавать друг другу плазмиды. Вот это свойство плазмид переходить из одной клетки в другую, как из рук в руки, оказалось востребованным в генной инженерии свойством. Плазмиды используются в генной инженерии в качестве основных компонентов разнообразных молекулярных переносчиков чужеродной ДНК. Посмотрите на изображение на слайде: вы видите, что в плазмиду внедрён участок ДНК, взятый из другой хромосомы, и туда же можно добавить какой-нибудь другой ген, например, ген, который обеспечивает флуоресценцию (мы это увидим на следующем слайде). И после проникновения в клетку рекомбинантная плазмида может запускать механизм считывания той информации, которая в ней записана, может очень быстро создавать копии, до 3 тысяч копий можно выращивать в специальных средах, и получать биомассу белков, выработанных изменённой плазмидой в промышленных масштабах.
Вирусы и плазмиды не применяются в биотехнологии в чистом, натуральном виде. Перед использованием из них пытаются удалить всё лишнее, чтобы оставить только тот фрагмент генов, который может обеспечить доставку нужных компонентов в клетки. Поэтому такие искусственные конструкции называют векторами-переносчиками. Вектор разрезают в нужном месте рестриктазами, вводят в контакт с нужным, вырезанным геном, добавляют сшивающий фермент – липазу. И вектор готов, получается как раз рекомбинантная ДНК.
Этот метод достаточно удобен, но в послезнее время всё чаще применяют способ копирования нужного участка – полимеразную цепную реакцию. Данный метод используют для диагностики Covid-19. Тогда достаточно маленького участка ДНК, соответствующего началу искомого гена, чтобы фермент нашёл, снял копию с гена, который начинается эти ферментом. И после того, как копия будет готова, с полимеразы и с участка, послужившего образцом, начинают снимать дальнейшие оттиски. И тогда результаты работы участком можно будет использовать для анализов.
Известны случаи, когда плазмиды переносят до 3 тысяч клеток. Получается рекомбинантный ДНК – с разными фрагментами ДНК от разных организмов. Последнее время все чаще применяют метод копирования участка, который называется ПЦР – полимеразная цепная реакция.
4. Внедрить рекомбинантную ДНК в клетку-мишень. После того, как рекомбинантная ДНК создана, она должна внедриться в клетку-мишень. Для этого нужно повысить проницаемость клеточной мембраны с помощью солей или электрического тока. Ни одна операция не даёт 100% успеха. Не все клетки-мишени получают необходимый донорский орган. Как тогда определить, какие клетки имеют генетически-модифицированные фрагменты, а какие нет.
5. Выявить трансгенные клетки, отделить их от неизменённых. Для этого в плазмиду (как мы видели на прошлом слайде) вводят гены, например, отвечающие за выживание в экстремальных ситуациях, например, ген обеспечивающий устойчивость к антибиотикам. Тогда можно выбрать бактерии, чувствительные, например, к антибиотикам, вставить плазмиды, которые содержат бактериальный ген, обеспечивающий устойчивость к антибиотику. И вместе с нужным геном встроить в клетку. А дальше начинается естественный отбор: клетки помещают в среду с антибиотиком, если клетка выживает, значит в ней есть рекомбинантная ДНК и с донорским геном, и с геном, который отвечает за выработку веществ, которые борются с антибиотиками. В качестве такого гена-индикатора используют часто гены (как вы видите на сайде), которые заставляют организмы в целом или его ткани светиться. Выведена светящаяся картошка, которая светится при недостатке влаги, флуоресцирующие поросята, мыши, кролики, обезьянки. Иногда это художественные эксперименты, но чаще всё-таки научные.
6. Заставить внедренный ген действовать в клетке-мишени. Итак, мы поняли, в какие клетки попала видоизменённая рекомбинантная ДНК. Теперь надо заставить внедрённый ген действовать в клетке-мишени, заставить работать. Вот эту функцию активации генов выполняют промоутеры – участки ДНК, которые ферменты клетки воспринимают как команду начать считывание генетической информации. Промоутеры открываются и закрываются – и этим регулируется активность гена. У вирусов есть свои промоутеры, которые не подчиняются клеточным регуляторам и всегда открыты для ферментов. Вот именно они заставляют клетку быть буквально ксероксом для того, чтобы печатать те белки, информация о которых есть в структуре нуклеиновой кислоты вируса. Если задачей было создание микроорганизма, то на этом этапе всё заканчивается, создаётся популяция микроорганизмов, которая вырабатывает нужный белок (энзим, гормон роста, интерферон и т.д.). Можно выделить целевой продукт, обрабатывать его и придавать ему товарную форму. Если целью является биологический объект с заранее заданными свойствами, то возникают другие проблемы и другие этапы, о которых я дальше расскажу.

Основные направления использования биотехнологий
Основные, потому что всё время новые направления появляются. Мы кратко пройдёмся по этим направлениям. Моя задача – показать, что сегодня наука может, над чем идёт работа и что обсуждается как критические развилки науки и технологий, а также последствия развития биотехнологии в узком смысле слова.
1. Для борьбы защиты окружающей среды. Речь о загрязнениях, которые могут разлагаться в результате жизнедеятельности биоорганизмов. Почти на любое органическое вещество, не свойственное природе, находится микроорганизм или группа микроорганизмов, которые при модификации могут разложить вещество до простых соединений. Например, есть бытовые сточные воды, муниципальные сточные воды, те, которые являются смесью бытовых сточных вод и отходы предприятий, и вот их надо очищать. Например, на объектах Олимпиады 2014 воды использовались технологии очистки сточных вод с эффективным удалением органических загрязнений и азота через биотехнологические установки.
