
- •1.Охарактеризуйте обмен веществ и энергии как сопряженную систему катаболических и анаболических процессов
- •2.Макроэргические вещества и радикалы. Строение и функции атф в организме.
- •4)Дыхательная цепь и комплексы с переносом заряда.
- •5)Структура и функции конкретных компонентов дыхательной цепи.
- •6.Функции атф-синтетазы и молекулярного кислорода в клеточном дыхании.
- •7. )Механизм синтеза атф путем окислительного фосфорилирования
- •8. ) Механизм и биологическое значение разобщения окислительного фосфорилирования.
- •9.Цикл лимонной кислоты – центральный процесс энергетического обмена
- •10.) Регулирование скорости цикла лимонной кислоты.
- •11.Пути образования активного ацетила.
- •12.Пути потребления активного ацетила.
- •13) Назначение и пути потребления кетоновых тел
- •14.Пути образования и превращения пвк
- •15.Синтез жира из углеводов.
- •16.Особенности превращений углеводов в пищеварительном тракте и в ходе метаболизма в организме жвачных.
- •17.Биохимические механизмы поддержания нормального уровня глюкозы в крови при голодании.
- •18.Биологическое значение пентозного пути окисления углеводов.
- •19.Нарушение углеводного обмена.
- •1. Нарушение всасывания углеводов в жкт
- •2. Состояния, при которых нарушен процесс синтеза или расщепления гликогена
- •3. Состояния, вызывающие нарушения промежуточного обмена углеводов
- •4. Гипергликемия
- •20. Пути образования и превращений фосфатидной кислоты.
- •21.Спонтанное свободнорадикальное окисление ненасыщенных соединений и пути его предотвращения. Антиоксиданты
- •22.Строение и функции клеточных мембран, их участие в метаболизме.
- •23. Транспорт липидов в организме.
- •24.Метаболизм липидов и холестерина.
- •25. Строение, синтез и биологическое значение холестерола.
- •26. Биологически активные производные холестерина.
- •27. Нарушение липидного обмена.
- •28. Биохимические механизмы образования и утилизации аммиака в организме.
- •29. Участие трансаминаз в метаболизме.
- •30) Биохимическая роль нуклеотидов в метаболизме.
- •31. Отличия и сходства строения днк и рнк.
- •32. Отличия и сходства механизмов синтез днк и рнк.
- •33. Субстраты, ферменты и механизм синтеза и репарации днк.
- •36. ) Конечные продукты пуринового обмена у разных видов животных.
- •37.) Особенности азотистого обменау разных видов животных.
10.) Регулирование скорости цикла лимонной кислоты.
Основная функция цикла лимоной кислоты – обеспечение энергией, дыхательный контроль, осуществляемыйпри функционировании дыхательной цепи и окислительного фосфорилирования, является определяющим фактором при регуляции активности рассматриваемого цикла. Активность этого цикла непостредственно связана с поступлением окислительных кофакторов дегидрогеназ. Свойства ряда ферментов этого цикла указывают на то, что кроме общей регуляции существует также регуляция на уровне самого цикла. В клетках головного мозга, в которых ацетил-СоА образуется в основном из углеводов, регуляция цикла лимонной кислоты может происходить на стадии, катализируемой пируватдегидрогеназой. В самом цикле регуляция может осуществляться путем аллостерического ингибирования цитратсинтазы при действии АТР или ацил-СоА-производных длинноцепочечных жирных кислот. Митохондриальная NAD-зависимая изоцитратдегидрогеназа аллострически активируется ADP и ингибируется ATP и NADH. а-Кетоглутаратдегидрогеназный комплекс регулируется аналогично пируватдегидрогеназе. Сукцинатдегидрогеназа ингибируется оксалоацетатом, а образование оксалоацетата в малатдегидрогеназной реакции зависит от соотношения [NADH]/[NAD+}. Поскольку величиа Км цитратсинтазы для оксалоацетата такого же порядка, что и величина внутримитохондриальной концентрации оксалоацетата, концентрация последнего играет определенную роль в регуляции скорости образования цитрата. Какие из вышеперечисленных механизмов регуляции в самом цикле функционируют in vivo^ пока еще не известно.
11.Пути образования активного ацетила.
АцетилКоА- это центральный метаболит липидного обмена. Источники:
1)Глюкоза
2)глицерин
3)АК (при кратковременной напряженной мышечной работе)
4)Жирные к-ты (в-окисление при длительной мышечной работе, голодании, на холоде, при беременности и сахарном диабете).
Ацетил-СоА является ключевым промежуточным соединением в превращении всех основных питательных веществ. В аэробных условиях он образуется из сахаров при окислительном декарбоксилировании пировиноградной кислоты, липидов при β-окислении жирных кислот и при гликолитическом распаде глицерина, АК путем образования пирувата, промежуточных соединений цикла лимонной кислоты или др промежуточных соединений .
12.Пути потребления активного ацетила.
АцетилКоА- это центральный метаболит липидного обмена.
Пути использования образовавшегося ацетилКоА зависят от функционального состояния клетки (энергетический заряд) и ее специфики. Если в кл достаточно АТФ, то он используется на синтез ж к-т,т.к. АТФ активирует ключевой фермент ситеза ж к-т, а их накопление стимулирует синтез жира. Распад жира тормозится и в-окисление при этом тоже тормозится. Напряженная мышечная работа, стресс, увел-ие секреции катехоламинов активирует липолиз, в-окисление ж к-т; в этом случае актив-ся синтез кетоновых тел и ЦТК.
Пути
использования: 1. окисляется в цикле
Кребса(90%); 2.используется в синтезе ЖК
(9%) 3. Образование В-гидрокси-в-метилглутарилКоА
(ГМГ-коА)(а из него либо холестерин, либо
кетоновые тела -1%)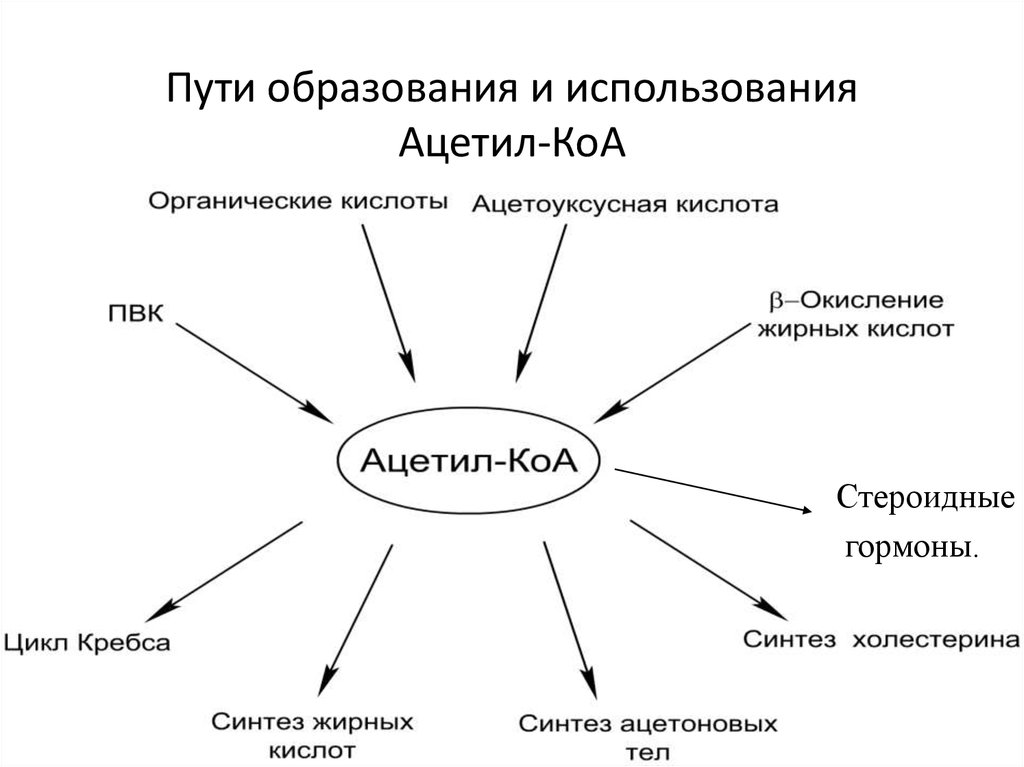
13) Назначение и пути потребления кетоновых тел
Кетоновые тела - это способ транспорта ацетильной группы
При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс "трудоемкий", а нервная ткань вообще неспособна окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела.
К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон.
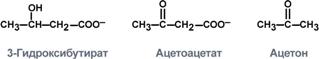
Строение кетоновых тел
Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетонов. Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола.
В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот.
Синтез кетоновых тел (кетогенез)
Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой.
Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников.
Реакции утилизации кетоновых тел примерно совпадают с обратным направлением реакций синтеза. В цитозоле 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
Для понимания причин кетоацидоза при различных ситуациях необходимо понимать роль оксалоацетата для регуляции цикла трикарбоновых кислот.
В печени при длительной мышечной нагрузке резервы гликогена истощаются, развивается тенденция к гипогликемии, значительно усиливается глюконеогенез, количество оксалоацетата снижается, и жирные кислоты, попавшие в печень, будут окисляться с образованием кетоновых тел.
При голодании глюкоза не в состоянии обеспечить наличие должного количества оксалоацетата, поскольку ее мало и в крови, и в гепатоците. Вместе с этим, в печени при голодании активен глюконеогенез для которого используется оксалоацетат Поэтому при голодании жирные кислоты, поступающие в большом количестве в печень, не сгорают в ЦТК, а уходят в синтез кетоновых тел.
При сахарном диабете 1 типа (инсулинзависимом) в гепатоците глюкозы может быть много, т.к. глюкоза проникает в него через ГлюТ-2 без участия инсулина. Однако, точно также как при голодании, соотношение инсулин/глюкагон низкое, и оксалоацетат очень активно уходит на синтез глюкозы, что тормозит ЦТК и отправляет ацетил-SKoA на образование кетоновых тел. При сахарном диабете 2 типа (инсулиннезависимом) инсулина достаточно и соотношение инсулин/глюкагон велико, поэтому глюконеогенез не активен и оксалоацетата хватает для поддержания ЦТК. Образуемый здесь ацетил-SKoA либо сгорает в ЦТК, либо используется для синтеза холестерина и синтеза жирных кислот (который стимулируется инсулином). К тому же при наличии инсулина попадающие в печень жирные кислоты будут не окисляться, а вовлекаться в синтез триацилглицеролов и ЛПОНП.
