
- •1.Охарактеризуйте обмен веществ и энергии как сопряженную систему катаболических и анаболических процессов
- •2.Макроэргические вещества и радикалы. Строение и функции атф в организме.
- •4)Дыхательная цепь и комплексы с переносом заряда.
- •5)Структура и функции конкретных компонентов дыхательной цепи.
- •6.Функции атф-синтетазы и молекулярного кислорода в клеточном дыхании.
- •7. )Механизм синтеза атф путем окислительного фосфорилирования
- •8. ) Механизм и биологическое значение разобщения окислительного фосфорилирования.
- •9.Цикл лимонной кислоты – центральный процесс энергетического обмена
- •10.) Регулирование скорости цикла лимонной кислоты.
- •11.Пути образования активного ацетила.
- •12.Пути потребления активного ацетила.
- •13) Назначение и пути потребления кетоновых тел
- •14.Пути образования и превращения пвк
- •15.Синтез жира из углеводов.
- •16.Особенности превращений углеводов в пищеварительном тракте и в ходе метаболизма в организме жвачных.
- •17.Биохимические механизмы поддержания нормального уровня глюкозы в крови при голодании.
- •18.Биологическое значение пентозного пути окисления углеводов.
- •19.Нарушение углеводного обмена.
- •1. Нарушение всасывания углеводов в жкт
- •2. Состояния, при которых нарушен процесс синтеза или расщепления гликогена
- •3. Состояния, вызывающие нарушения промежуточного обмена углеводов
- •4. Гипергликемия
- •20. Пути образования и превращений фосфатидной кислоты.
- •21.Спонтанное свободнорадикальное окисление ненасыщенных соединений и пути его предотвращения. Антиоксиданты
- •22.Строение и функции клеточных мембран, их участие в метаболизме.
- •23. Транспорт липидов в организме.
- •24.Метаболизм липидов и холестерина.
- •25. Строение, синтез и биологическое значение холестерола.
- •26. Биологически активные производные холестерина.
- •27. Нарушение липидного обмена.
- •28. Биохимические механизмы образования и утилизации аммиака в организме.
- •29. Участие трансаминаз в метаболизме.
- •30) Биохимическая роль нуклеотидов в метаболизме.
- •31. Отличия и сходства строения днк и рнк.
- •32. Отличия и сходства механизмов синтез днк и рнк.
- •33. Субстраты, ферменты и механизм синтеза и репарации днк.
- •36. ) Конечные продукты пуринового обмена у разных видов животных.
- •37.) Особенности азотистого обменау разных видов животных.
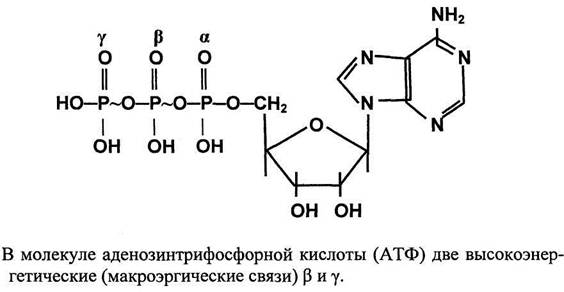
2.Макроэргические вещества и радикалы. Строение и функции атф в организме.
Строение молекулы АТФ По строению относится к нуклеотидам, состоит из: -моносахарида рибозы -азотистого основания аденина -трех остатков фосфорной кислоты, причем последние два остатка присоединены с помощью особой, макроэргической связи, в которой содержится много энергии (40 кДж/моль).
В
обменных процессах от нее последовательно
отщепляются остатки фосфорной кислоты
путем разрыва богатой энергией, но
непрочной связи между вторым и третьим
остатками фосфорной кислоты. Отрыв
одной молекулы фосфорной кислоты
сопровождается выделением около 40 кДж
энергии. В этом случае АТФ переходит в
аденозиндифосфорную кислоту (АДФ), а
при дальнейшем отщеплении остатка
фосфорной кислоты от АДФ образуется
аденозинмонофосфорная кислота
(АМФ)
 Энергия
макроэргических связей используется
для совершения любой работы: активации
соединений (например, глюкозы, чтобы
могла начаться цепь ее окислительных
превращений), синтеза биополимеров
(нуклеиновых кислот, белков, полисахаридов),
избирательного поглощения веществ
из окружающей клетку среды и выброса
из клетки ненужных продуктов, мышечного
сокращения и восстановления активного
состояния организма и т. д. Запас
этих соединений позволяет организму
быстро реагировать на изменение
внешних условий и совершать физическую
работу. При спортивной тренировке
содержание макроэргических соединений
в мышцах и скорость их образования
возрастают. Есть и другие формы
запасания энергии. Во-первых, это разность
электрических потенциалов на биологических
мембранах, которая может быть использована
для синтеза макроэргических соединений
и на поддержание которой клетке
приходится расходовать энергию.
Во-вторых, поскольку любой организм
способен окислять углеводы и жиры
с образованием макроэргических
соединений, то можно считать, что
жировые капли, зерна крахмала, частицы
гликогена — это не только запасы
пластического («строительного»)
материала, но и запасы энергии,
только в более инертной и менее
доступной для быстрого использования
форме, чем макроэргические соединения.
Энергия
макроэргических связей используется
для совершения любой работы: активации
соединений (например, глюкозы, чтобы
могла начаться цепь ее окислительных
превращений), синтеза биополимеров
(нуклеиновых кислот, белков, полисахаридов),
избирательного поглощения веществ
из окружающей клетку среды и выброса
из клетки ненужных продуктов, мышечного
сокращения и восстановления активного
состояния организма и т. д. Запас
этих соединений позволяет организму
быстро реагировать на изменение
внешних условий и совершать физическую
работу. При спортивной тренировке
содержание макроэргических соединений
в мышцах и скорость их образования
возрастают. Есть и другие формы
запасания энергии. Во-первых, это разность
электрических потенциалов на биологических
мембранах, которая может быть использована
для синтеза макроэргических соединений
и на поддержание которой клетке
приходится расходовать энергию.
Во-вторых, поскольку любой организм
способен окислять углеводы и жиры
с образованием макроэргических
соединений, то можно считать, что
жировые капли, зерна крахмала, частицы
гликогена — это не только запасы
пластического («строительного»)
материала, но и запасы энергии,
только в более инертной и менее
доступной для быстрого использования
форме, чем макроэргические соединения.
Функции АТФ: -Служит универсальным источником энергии в клетках.
Дополнительные функции АТФ (кроме энергетической):
-Вместе с другими нуклеозидтрифосфатами (ГТФ, ЦТФ, УТФ) является исходным продуктом при синтезе РНК. -Является предшественником при синтезе циклического аденозинмонофосфата (цАМФ) – вторичного посредника передачи в клетку гормонального сигнала адреналина и глюкагона -Является аллостерическим эффектором некоторых ферментов -Участвует в активации молекул путём их фосфорилирования -Трансмембранном транспорте катионов водорода и органических веществ -Является источником фосфатных групп для синтеза других макроэргических соединений -В виде АТФ аккумулируется энергия в процессах фотосинтеза и дыхания -Осуществляется дальний транспорт энергии по флоэмной системе растений и кровеносной системе человека и животных, тогда как большинство других макроэргических соединений дальнему транспорту не подвергаются. 3. Промежуточные метаболиты-доноры электронов и протонов для клеточного дыхания.
NAD - зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD+ является коферментом и выполняет роль акцептора водорода. Символ 2Н+ означает два электрона и два протона, обычно переносимые в виде гидрид иона. В этом случае вместо терминов «донор электронов» и «акцептор электронов» иногда используют термины «донор или акцептор водорода». FAD - зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Коферментом является FAD, который является акцептором водорода от субстрата. NADH - дегидрогеназа катализирует окисление NADH и восстановление убихинона (CoQ). Переносчиком водорода является кофермент - FMN (комплекс 1). В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем передается на убихинон. Флавиновые коферменты (FAD и FMN) прочно связаны с ферментом как простетические группы, поэтому ферменты, в состав которых они входят, называются флавопротеины. Флавинмононуклеотид (FMN), или рибофлавин фосфат, неразрывно связан с белковой частью фермента. Строго говоря, FMN не является нуклеотидом, так как флавиновая часть связана с рибитолом, а не с рибозой.
Цитохромы это маленькие глобулярные белки, которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками.
Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальныхмембранах. Цитохромы катализируют окислительно-восстановительные реакции. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей. В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c.
Убихинон это жирорастворимые коферменты, представленные преимущественно в митохондрияхэукариотических клеток. Убихинон является компонентом цепи переноса электронов и принимает участие вокислительном фосфорилировании. Максимальное содержание убихинона в органах с наибольшими энергетическими потребностями, например, в сердце и печени.
Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:
Цитохромоксидаза переносит электроны с цитохрома С на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в геме цитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохрома а3, происходит на молекуле фермента. Каждый из атомов молекулы кислорода присоединяет по два электрона и протона, образуя при этом молекулу воды.
Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов на нескольких стадиях, однако, не совсем ясны их локализация и механизм действия.
