
- •1.Охарактеризуйте обмен веществ и энергии как сопряженную систему катаболических и анаболических процессов
- •2.Макроэргические вещества и радикалы. Строение и функции атф в организме.
- •4)Дыхательная цепь и комплексы с переносом заряда.
- •5)Структура и функции конкретных компонентов дыхательной цепи.
- •6.Функции атф-синтетазы и молекулярного кислорода в клеточном дыхании.
- •7. )Механизм синтеза атф путем окислительного фосфорилирования
- •8. ) Механизм и биологическое значение разобщения окислительного фосфорилирования.
- •9.Цикл лимонной кислоты – центральный процесс энергетического обмена
- •10.) Регулирование скорости цикла лимонной кислоты.
- •11.Пути образования активного ацетила.
- •12.Пути потребления активного ацетила.
- •13) Назначение и пути потребления кетоновых тел
- •14.Пути образования и превращения пвк
- •15.Синтез жира из углеводов.
- •16.Особенности превращений углеводов в пищеварительном тракте и в ходе метаболизма в организме жвачных.
- •17.Биохимические механизмы поддержания нормального уровня глюкозы в крови при голодании.
- •18.Биологическое значение пентозного пути окисления углеводов.
- •19.Нарушение углеводного обмена.
- •1. Нарушение всасывания углеводов в жкт
- •2. Состояния, при которых нарушен процесс синтеза или расщепления гликогена
- •3. Состояния, вызывающие нарушения промежуточного обмена углеводов
- •4. Гипергликемия
- •20. Пути образования и превращений фосфатидной кислоты.
- •21.Спонтанное свободнорадикальное окисление ненасыщенных соединений и пути его предотвращения. Антиоксиданты
- •22.Строение и функции клеточных мембран, их участие в метаболизме.
- •23. Транспорт липидов в организме.
- •24.Метаболизм липидов и холестерина.
- •25. Строение, синтез и биологическое значение холестерола.
- •26. Биологически активные производные холестерина.
- •27. Нарушение липидного обмена.
- •28. Биохимические механизмы образования и утилизации аммиака в организме.
- •29. Участие трансаминаз в метаболизме.
- •30) Биохимическая роль нуклеотидов в метаболизме.
- •31. Отличия и сходства строения днк и рнк.
- •32. Отличия и сходства механизмов синтез днк и рнк.
- •33. Субстраты, ферменты и механизм синтеза и репарации днк.
- •36. ) Конечные продукты пуринового обмена у разных видов животных.
- •37.) Особенности азотистого обменау разных видов животных.
28. Биохимические механизмы образования и утилизации аммиака в организме.
Аммиак постоянно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени,
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
жизнедеятельность бактерий толстого кишечника,
распад пуриновых и пиримидиновых оснований – во всех тканях.
Сначала аммиак требуется обезвредить
Так как аммиак является чрезвычайно токсичным соединением, то в тканях существуют несколько реакций связывания (обезвреживания) аммиака – синтез глутаминовой кислоты и глутамина, синтез аспарагина, синтез карбамоилфосфата:
синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
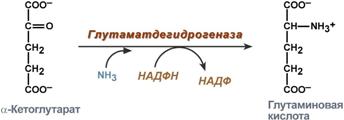
Реакция синтеза глутаминовой кислоты
синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
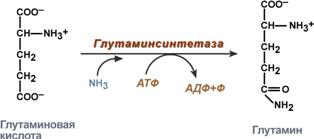
Реакция синтеза глутамина
Образование большого количества глутамина обеспечивает высокие концентрации его в крови (0,5-0,7 ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового и пиримидинового колец, гуанозинмонофосфата (ГМФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
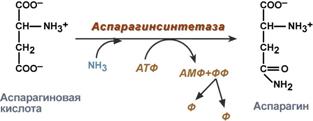
Реакция синтеза аспарагина
синтез карбамоилфосфата в митохондриях печени – реакция является первой в процессе синтеза мочевины, средства для удаления аммиака из организма.
29. Участие трансаминаз в метаболизме.
Для трансаминирования необходим витамин В6
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6).
В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
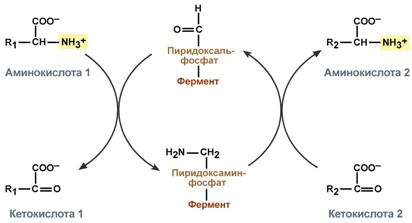
Схема реакции трансаминирования
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
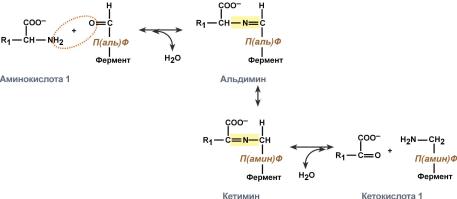
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота.
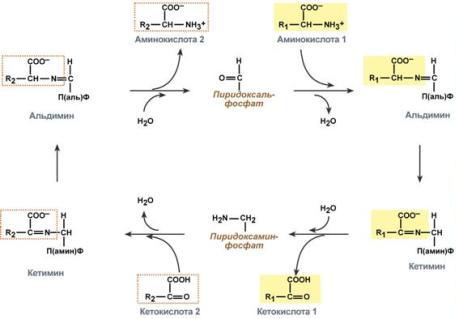
Чаще всего аминокислоты взаимодействуют со следующими кетокислотами:
пировиноградной с образованием аланина,
щавелевоуксусной с образованием аспартата,
α-кетоглутаровой с образованием глутамата.
Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты.
Далее глутаминовая кислота может вовлекается в процессы связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот.
Трансаминирование -заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
