
- •Микробиологическая диагностика дифтерии
- •I. Микроскопический метод
- •II. Бактериологический метод
- •Определение протеолитических свойств
- •Ускоренные методы диагностики
- •Определение токсигенности дифтерийных бактерии
- •Дифференциация различных видов бордетелл
- •Микробиологическая диагностика коклюша
- •I. Микроскопический метод
- •II. Бактериологический метод
- •Основные различия между коклюшными палочками и бактериями септического бронхита.
- •Серологический метод диагностики коклюша
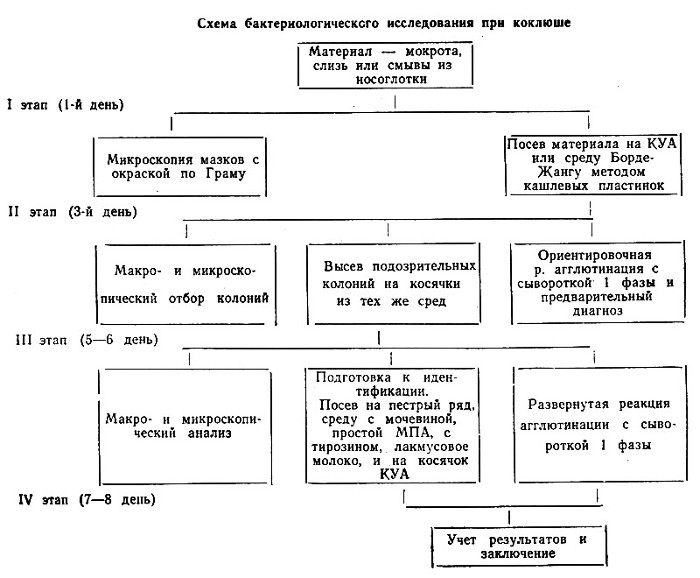
Микробиологическая диагностика коклюша
Коклюш относят к инфекциям с весьма длительным течением, что делает возможным применение двух основных (бактериологический, серологический) и одного вспомогательного (микроскопический) методов диагностики.
I. Микроскопический метод
Микроскопический метод является вспомогательным вариантом диагностики, так как коклюшные бактерии не имеют четких морфотинкториальиых особенностей.
Диагностическое значение имеет лишь 1 фаза существования коклюшных бактерий, соответствующих S - форме. В таком варианте патогенные штаммы возбудителя коклюша выделяются из организма. Это грамотрицательные, мелкие однородные, овоидной формы палочки без спор, но с нежными капсулами. При переходе во II и III фазы появляются полиморфные длинные или, наоборот, кокковидные бактерии. Для отличия названных стадий развития коклюшных палочек микроскопический метод незаменим.
II. Бактериологический метод
Выделение чистой культуры возбудителя является самым ранним и достоверным способом диагностики коклюша.
Материалом для исследования служат мокрота, слизь и смывы из носоглотки больного, выделяемые цри кашле или искусственно собранные стерильными носоглоточными тампонами.
Возбудитель коклюша очень требователен к питательным средам. Поэтому для его выделения используются элективные среды: казеиново-угольный агар (КУА), Борде-Жангу и молочно-кровяной агар Осиповой.
КАЗЕИНОВО-УГОЛЬНЫЙ АГАР ИЛИ СРЕДУ КУА готовят из сухого субстрата, выпускаемого ИЭМ имени Н. Ф. Гaмалей. Перед употреблением 4-5 г сухого порошка растворяют в 100 мл дистиллированной воды, стерилизуют в автоклаве 30 минут при +110 °C и, соблюдая стерильность, разливают в чашки Петри или пробирки. Готовые среды можно хранить при +4, +10 °C до двух недель.
Колонии коклюшных бактерий на среде КУА появляются на 3-4 день. Они мелкие, выпуклые, блестящие, гладкие, серовато-кремовые.
Колонии паракоклюшных бактерий такие же, но более крупные и дают коричневое окрашивание среды.
СРЕДА БОРДЕ-ЖАНГУ. 500 г мелко нарезанного очищенного картофеля заливают 1 л дистиллированной воды с 40 мл глицерина, варят до размягчения, а затем доводят дистиллированной водой до исходного объема, фильтруют через 2-3 слоя марли и дают отстояться до просветления. К 500 мл прозрачного картофельно-глицеринового экстракта добавляют 1,5 л солевого раствора, содержащего следующий комплекс солей: К2НРО4- 2,25 г; MgS04-0,075 г; КН2Р04 -0,75 г; NaCl-7,5 г; КС1 -1,50 г. После этого прибавляют 60 г агар-агара (3%), кипятят на огне с асбестовой сеткой до растворения, устанавливают pH = 7,1-7,2, фильтруют и, разлив в соответствующую посуду, стерилизуют 30 минут при +110 °C или 25 минут при +120 °C. Это основа среды. Она может храниться очень долго.
Перед употреблением среду растапливают, охлаждают до 4-45 °C и добавляют 15-20% стерильной дефебринированной крови (барана, кролика, человека, лошади).
Готовая среда светло-вишневого цвета (без пузырьков воздуха). Для подавления посторонней микрофлоры добавляют 0,25-0,50 единиц пенициллина на 1 мл среды (1 ед. тормозит развитие коклюшных бактерий).
1.Колонии коклюшных бактерий на этой среде гладкие, блестящие, прозрачные, куполообразные с жемчужным или ртутным оттенком, окруженные зоной гемолиза.
2. Колонии паракоклюшных бактерий крупные с коричневым окрашиванием среды и зоной гемолиза.
МОЛОЧНО-КРОВЯНОЙ АГАР ОСИПОВОЙ. 5% МПА расплавляют на водяной бане, добавляют 1% поваренной соли и смешивают с таким же количеством обезжиренного подогретого молока. Стерилизуют в автоклаве при 0,5 атм. 40 минут. Горячую смесь отфильтровывают от свернувшегося молока, разливают по флаконам и автоклавируют при 0,5 атм. 20 минут. К остуженному до +45°, +50 °C агару добавляют 20% дефибринированной крови барана и пенициллин из того же расчета, что и в среде Борде-Жангу.
При выделении чистой культуры возбудителя следует учитывать большую требовательность к питательным средам:
1. сравнительно медленное развитие колоний, отсутствие потемнения среды вокруг колоний,
2. относительную биохимическую инертность, морфологическую однородность
3. и способность агглютинироваться специфической противококлюшной сывороткой первой фазы.
При выделении чистой культуры коклюшных бактерий очень важно отдифференцировать их от часто встречающихся гемоглобинофильных бактерий паракоклюша и септического бронхита.
Антигенная дифференциация коклюшных и паракоклюшных бактерий должна проводиться с учетом общности и различий в их антигенном составе.
При отсутствии необходимых монорецепторных сывороток отличием могут служить прочие, в частности культурально-биохимические признаки.
Свойство бактерий коклюша и их отличие от палочек паракоклюша |
||
Свойства |
Бактерии коклюша |
Бактерии паракоклюша |
Морфология |
мелкие, коккобактерии |
крупные палочки |
Капсулы |
есть, нежные |
нет |
Рост на простом МПА |
- |
+ |
Энергия роста |
слабая, колонии видны на 3-4 день |
средняя, колонии видны на 2-3 день |
Образование коричневого пигмента на казеиновоугольном агаре (КУА) |
- |
+ |
Рост МПА с 0,1% тирозина |
- |
+ |
Гемолиз на кровяном МПА |
+ четкий |
+ слабый |
Рост на пептонной воде, |
- |
+ |
с гематином |
+ |
- |
с дрожжами (экстракт) |
+ |
- |
Ферментация углеводов: |
||
глюкозы |
- |
+ |
галактозы |
- |
+ |
левулезы |
- |
+ |
Разложение мочевины |
- |
+ |
Щелочение лакмусового молока |
на 10-14 день |
в первые 1-4 дня |
Специфические видовые антигены |
1 |
14 |
Типовые антигены |
2, 3, 4, 5, 6, 13 |
8, 9, 10 |
Отношение к мочевине выясняется пробой Закса, широко используемой при дифтерии.
