
Теплотехника. Мозговой Н.В., Бараков А.В
.pdfВоронежский государственный технический
университет
Н.В. Мозговой А.В. Бараков
ТЕПЛОТЕХНИКА
Утверждено Редакционно - издательским советом
университетом в качестве учебного пособия
Воронеж 2005
УДК 621.1.016 (075.8)
Мозговой Н.В., Бараков А.В. Теплотехника: Учеб. пособие. Воронеж: Воронеж. гос. техн. ун-т, 2005. 126с.
В учебном пособии изложены основы технической термодинамики и теории тепло- и массообмена.
Учебное пособие соответствует требованиям Государственного образовательного стандарта высшего профессионального образования по направлениям 280100 "Безопасность жизнедеятельности", 150100 "Металлургия", специальностям 280103 "Защита в чрезвычайных ситуациях" и 150104 "Литейное производство черных и цветных металлов" и 110302 "Электрификация и автоматизация сельского хозяйства", дисциплине "Теплотехника".
Учебное пособие подготовлено в электроном виде в текстовом редакторе MS Word XP и содержится в файле TT. doc.
Ил. 62. Библиогр.: 7 назв.
Научный редактор канд. техн. наук, доц. С.В. Дахин
Рецензенты: кафедра энергетики и гидравлики Воронежской государственной лесотехнической академии (зав. кафедрой д-р техн. наук, проф. В.М. Попов); д-р техн. наук, проф. В.И. Ряжский
©Мозговой Н.В., Бараков А.В.,
2005
©Оформление. ГОУВПО «Воронежский государственный технический университет» ,2005
2
ВВЕДЕНИЕ
Тепловая энергия способствовала возникновению всего живого, а также формированию человека. Этот вид энергии широко используется в промышленности, сельском хозяйстве, строительстве, на транспорте и в бытовых условиях.
При этом следует различать технологические и энергетические направления использования тепловой энергии.
Технологическое использование тепловой энергии подразумевает изменение с помощью тепловой энергии физико-механических свойств веществ в направлении, выгодном человеку. Сюда относятся такие процессы, как приготовление пищи, плавка стали, сушка древесины, отопление помещений и пр.
Под энергетическим использованием тепловой энергии понимается превращение ее в механическую и электрическую энергии. Превращение тепловой энергии в механическую осуществляется в тепловых машинах, к которым относятся двигатели внутреннего сгорания, паровые и газовые турбины, воздушно-реактивные двигатели, паросиловые установки и др.
Использование тепловой энергии в энергетических целях идет по линии получения из нее электрической энергии на тепловых электрических станциях (ТЭС). Из общего количества вырабатываемой в России электроэнергии около 80 % производится на ТЭС.
ТЕПЛОТЕХНИКА - общетехническая дисциплина, изучающая методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло- и парогенераторов, тепловых машин, аппаратов и устройств.
Теплотехника как научная дисциплина имеет следующие разделы:
3
1.Техническая термодинамика.
2.Основы теплообмена (теплопередача).
3.Котельные агрегаты.
4
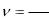
РАЗДЕЛ I. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА
1.1. Основные понятия и исходные положения термодинамики
1.1.1. Предмет и метод термодинамики
Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии.
Для осуществления этих процессов в тепловых и холодильных машинах необходимо рабочее тело, способное как хорошо воспринимать и отдавать тепло, так и значительно изменять свой объем. В качестве рабочих тел в тепловых и холодильных машинах используются газы. В паровых турбинах - это водяной пар. В двигателях внутреннего сгорания, газовых турбинах - газообразных продуктов сгорания, в холодильных машинах - пары фреона, аммиака, углекислоты.
1.1.2. Основные термодинамические параметры состояния газа
Свойства каждой термодинамической системы характеризуются рядом величин, которые принято называть термодинамическими. Основными среди них являются температура, давление и удельный объем. Для их наглядного определения используем известные из курса физики молекулярно кинетические представления об идеальном газе, как о системе не взаимодействующих друг с другом материальных точек.
Удельный объем ν - это объем единицы массы вещества, т.е.
V
M ` |
(1.1) |
где V - объем; М - масса.
В системе СИ единица измерения удельного объема есть м3/кг. Между удельным объемом вещества и его плотностью существует ношение
5

l
(1.2)
Температура с точки зрения молекулярно-кинетических представ псин и мера интенсивности движения молекул.
На практике широко применяется градус Цельсия (°С). В системе СИ единицей измерения температур является Кельвин (К).
Соотношение между ними имеет вид |
|
Т =t + 273,15 [К] |
(1.3) |
В США и Великобритании используется шкала Фаренгейта. |
|
T |
9 |
t |
32 |
|
5 |
|
|||
|
|
[F] |
(1.4) |
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью.
|
В системе СИ давление измеряется в Паскалях ( 1 Па = 1 |
Н/м2 ). |
Удобнее пользоваться 1 кПа = |
103 Па и 1 МПа= 106 Па Давление измеряется при помощи манометров, барометров и вакуумметров. Манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением Р и атмосферным давлением Ратм
Ризб = Р - Ратм |
(1.5) |
Вакуумметры дают значение разряжения (или вакуума)
Рb = Ратм –Р |
(1.6) |
Параметром состояния является абсолютное давление.
1.1.3. Уравнение состояния
Установлено, что объем, температура и давление простейших систем, которыми являются газы, пары и жидкости, связаны
уравнением состояния вида |
|
f(P,V,T) = 0 . |
(1.7) |
Для одного килограмма идеального газа методами молеку- лярно-кинетической теории получено уравнение состояния, извест-
ное как уравнение Клапейрона-Менделеева |
|
PV = RT, |
(1.8) |
где R - газовая постоянная; равная |
|
6

R |
8314 |
|
|
|
|
(1.9) |
|
|
|
||
|
|
|
|
Здесь 8314универсальная газовая постоянная, |
-вес моля. |
||
Умножив (1.8) на М, получим уравнение состояния для про- |
|||
извольной массы газа М, кг |
|
||
PV M R T |
(1.10) |
||
1.1.4.Смеси идеальных газов
Винженерной практике в большинстве случаев при-
ходится иметь дело с газовыми смесями, представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания (ДВС), газотурбинных установках (ГТУ), топках печей и паровых котлов, воздух в сушильных установках на деревообрабатывающих производствах и т.д.
Состав газовой смеси может быть задан массовыми и объемными (мольными) долями.
Массовой долей называется отношение массы отдельного компонента Мi к массе смеси Мсм
gi |
Mi |
|
|
M см |
(1.11) |
||
|
|||
|
|
Очевидно, что
n |
|
Мсм |
Мi |
i 1 |
(1.12) |
n
gi 1
i 1 |
(1.13) |
|
Массовые доли задаются и в процентах.
Объемная доля представляет собой отношение приведенного объема газа Vi к полному объему смеси Vсм
7
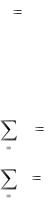
ri |
Vi |
|
|
Vсм |
(1.14) |
||
|
|||
|
|
Под приведенным понимается объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
С учетом закона Дальтона
|
n |
|
|
Vi |
Vсм |
i |
1 |
(1.15) |
|
n |
|
|
ri |
1 |
i |
1 |
(1.16) |
Объемные доли также могут задаваться в процентах.
1.1.5. Основные сведения о термодинамическом процессе
Изменение термодинамического состояния системы во времени называется термодинамическим процессом. В более частной постановке под термодинамическим процессом понимается процесс теплового силового взаимодействия газа с внешней, по отношению к нему, средой.
При этом под процессом теплового взаимодействия газа с внешней средой понимается процесс подвода тепла к газу извне или наоборот, процесс отвода тепла от газа во внешнюю среду.
Под процессом силового взаимодействия газа с внешней средой понимается процесс совершения газом работы против внешних сил давления или наоборот, процесс совершения работы внешними силами давления при сжатии газа.
Основными величинами, применяемыми для характеристики термодинамических процессов, являются теплота и работа процесса.
8
1.2.Первый закон термодинамики
1.2.1. Внутренняя энергия
Вбольшинстве теплоэнергетических процессов внутренняя энергия системы включает в себя;
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц.
Отсюда внутренняя энергия есть некоторая однозначная функция состояния тела, т.е. любых двух независимых параметров, определяющих это состояние:
U 1 (P,V );U 2 |
(P,T );U 3 |
(V ,T ) |
(1.17) |
|
|
|
Величина
U = U/M (1.18)
есть удельная внутренняя энергия. Она выражается в Дж / кг.
Так как внутренняя энергия есть функция состояния тела, то
ее изменение U в процессе не зависит от характера процесса, а определяется только начальным и конечным состояниями тела
2 |
|
U |
dU U2 U1. |
1 |
(1.19) |
1.2.2. Работа расширения
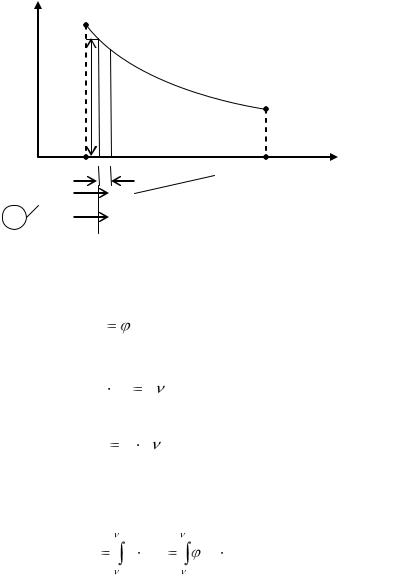
Рассмотрим 1 кг газа, находящегося в цилиндре с подвижным поршнем площадью F (рис.1). Если газу от источника тепла (и.т.) сообщить некоторое количество теплоты, то он будет расширяться, совершая при этом работу против внешнего давления р, оказываемого на него поршнем. Газ воздействует на поршень с силой, равной pF, и совершает элементарную работу
dl p F dh. |
(1.20) |
|
9
|
P |
1 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
P |
|
|
P=φ(v) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
v1 |
|
dV |
|
|
|
v2 |
|||
|
0 |
4 |
|
dh |
|
F |
3 |
|
v |
|||
|
|
|
|
|
|
|||||||
|
q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1кг |
P |
|
|
|
|
|
|
|
|
||
и.т. |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1
Здесь dhэлементарное перемещение поршня.
В P-V диаграмме указанный процесс изобразится кривой 1-
2 или
P (V ). |
(1.21) |
|
В (1.20) произведении F  dh есть элементарное приращение объема газа в процессе т.е.
dh есть элементарное приращение объема газа в процессе т.е.
F dh d |
(1.22) |
|
|
С учетом (1.22) работа элементарного процесса выразится |
|
как |
|
dl p d |
(1.23) |
|
и изобразится графически в координатах заштрихованной элементарной площадкой.
Работа конечного процесса, в котором объем газа изменяется от V1 до V2 ,найдем суммированием элементарных работ
|
2 |
2 |
|
l |
p dV |
|
(V dV ), |
|
1 |
1 |
(1.24) |
и она изобразится графически в р - V диаграмме площадью 12341. При вычислении по (1.24) работа процесса может быть по-
ложительной, отрицательной или равной нулю.
10
