
2522
.pdf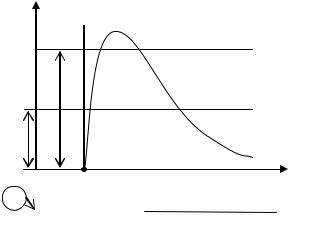
процесс парообразования в P-v диаграмме.
Начальное состояние воды с давлением р и температурой 0°С изобразится точкой а1. При подводе теплоты к воде ее температура возрастает до температуры кипения tS .Удельный объем несколько возрастает.
P |
|
K |
|
|
|||
|
|
I |
|
|
|||
|
|
а1 |
б1 в1 |
r1 |
|||
|
|
а1 б1 |
|
|
в1 |
r1 |
|
1 |
2 |
|
|
|
|
|
|
P |
P |
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
II |
|
|
|
v |
|
и.т. q |
|
|
|
|
|
||
|
|
|
|
|
|
||
1кг |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 11
Состояние жидкости при кипении изобразится точкой δ1. При дальнейшем подводе тепла начинается кипение
воды с сильным увеличением объема. В цилиндре находится двухфазная среда - смесь воды и пара, называемая влажным насыщенным паром. По мере подвода теплоты количество жидкой среды уменьшается, а паровой растет. Температура смеси при этом остается неизменной и равной tS. Наконец в точке b1 вся вода превращается в пар, который называется сухим насыщенным (в нем отсутствуют взвешенные частицы жидкой фазы). Двухфазная смесь, представляющая собой пар со взвешенными в нем капельками жидкости, называется влажным насыщенным паром.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться
(точка r1).
Если рассмотреть процесс парообразования при более высоком давлении, то имеют место следующие изменения. Точка а2 ос-
31

тается на той же вертикали т.к. вода практически несжимаема. Точка δ2 смещается вправо, т.к. с ростом давления увеличивается температура кипения, а жидкость при повышении температуры расширяется. Точка b2 смещается влево из-за более сильного влияния растущего давления.
При увеличений давления можно достичь такой точки, в которой удельные объемы жидкости и пара сравняются. Эта точка называется критической - К.
Если соединить одноименные точки плавными кривыми, то получим нулевую изотерму Т—II, П-К и верхнюю пограничную кривую К-III
1.5.2. Энтропийные диаграммы водяного пара
К ним относятся T-S и i-S диаграммы водяного пара. T-S диаграмма водяного пара строится путем переноса числовых данных таблиц водяного пара в Т- S координаты (рис.12). Энтропия воды при t = O°C и различных давлениях равна 0. Это точка а. Затем строятся изобары Р1 Р2> Р1 и т.д. Так, изобара Р1 изобразится ломаной линией aδ1b1r1, а изобара p2, линией аδ2b2r2. Соединив соответственно точки δ1 ,δ2 т. д. b1 ,b2 , получим нижнюю пограничную кривую I-K и верхнюю пограничную кривую K-II.
Область воды в T-S диаграмме прилегает к нижней пограничной кривой. Область влажного насыщенного пара лежит между линиями II-К и К-II. Область перегретого пара расположена выше и правее верхней пограничной кривой. Чем выше проходит изобара, тем большему давлению она соответствует (р2>p1).
32
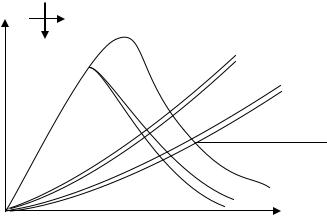
Рис. 12
Изохоры изображаются в Т - S диаграмме кривыми , для которых, чем выше проходит изохора, тем меньшему удельному объему она соответствует (v2 < v1). В T-S диаграмме наносятся линии степени сухости х.
Эта диаграмма служит для качественного анализа процесса парообразования. Так же, как T-S диаграмма, строится i-S диаграмма водяного пара (рис.13). По табличным данным строятся изобары, проводятся пограничные линии и наносятся изохоры, изотермы, адиабаты, линии i = const и линии постоянной степени сухости х.
I- К- нижняя пограничная кривая.
К- IIверхняя пограничная кривая.
За начало координат принято состояние воды (S0 = 0, i0 =0,). Область воды как и в Т - S диаграмме, выражена слабо, она прилегает непосредственно к нижней пограничной кривой. Область влажного насыщенного пара расположена между пограничными кривыми.
i
i |
S |
|
|
|
|
|
|
|
|
||
|
K |
v2 |
p2 |
||
|
|
||||
|
|
|
|
||
|
|
|
|
v1 p1 |
|
|
|
|
|
|
t2 |
|
|
|
|
|
|
|
|
|
|
|
t1 |
|
p2t2 |
|
x=1 |
||
|
x=0 |
|
|||
|
|
|
|
||
|
p1t1 |
|
|
|
|
|
Рис. 13 |
|
S |
||
Изобары изображаются в области насыщения прямыми, наклонными к оси S, а в области перегрева - кривыми линиями. Чем выше проходит изобара, тем большему давлению она соответствует, т.е.
Р2>Р1, Р3 >Р2.
Изохоры изображаются кривыми линиями, которые не-
33
сколько |
круче |
изобар, |
при этом |
v2<v1, v3 <v2 |
|
Изотермы в области насыщения совпадают с изобарами, а в области перегрева уходят вправо и идут почти горизонтально, при этом
t2>t1, t3 >t2
Как правило, в практике используется не вся диаграмма, а лишь ее, так называемая рабочая часть, которая в увеличенном масштабе приводится в справочной литературе. На практике i - S диаграмма водяного пара используется при качественных и количественных исследованиях термодинамических процессов и циклов.
Так, с помощью ; - S диаграммы можно определять параметры состояния пара (рис. 14). Если в i-S диаграмме задано положение точки, характеризующей какоелибо состояние пара, то параметры этого состояния легко определяются из i - S диаграммы по изохоре, изобаре,
Рис 14
изотерме, адиабате и линии i = const, проходящими через эту точку. Обычно положение точки, характеризующее состояние пара, задается в i - S диаграмме следующими параметрами:
а) в случае влажного насыщенного пара - х и Р; б) в случае сухого насыщенного пара только Р;
в) в случае перегретого пара положение точки фиксируется заданием Pиt.
1.5.3. Расчет основных термодинамических процессов для пара
Расчет термодинамических процессов для пара производит-
34
ся, как правило, графическим методом при помощи i-S диаграммы. Он сводится к определению параметров состояния пара в начале и конце процесса. Общий метод расчета сводится к следующему:
1)по данным, при которых рассчитывается процесс в диаграмме, наносится график процесса;
2)по положению начальной и конечной точек этого графика определяются параметры состояния пара в начале и конце процесса,
т.е. Р1, V1, i1,t1, S1 и Р2, V2, t2 , i2, S2;
3)по известным параметрам состояния пара в начале и конце процесса определяется изменение внутренней энергии пара в процессе ∆U, теплота процесса q и работа процесса l.
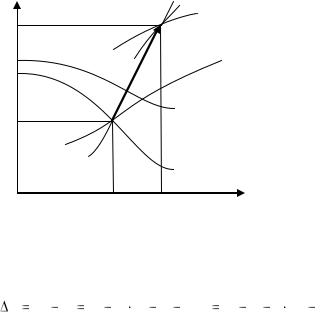
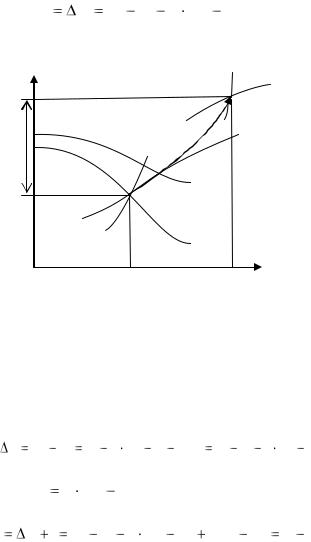
а) Изохорный процесс (рис.15). Пусть в изохорном процессе начальное состояние пара характеризуется давлением Р1, и степенью сухости х1 , а конечное температурой t2. Начальное состояние - это точка 1 и конечное 2. Точка 1 лежит на пересечении изобары Р1
илинии х1, а точка 2 расположена на пересечении изохоры V и изотермы t,.
|
v |
p2 t2 |
i |
|
|
i2 |
2 |
|
t1
x=1
i1 |
1 |
|
|
|
x1 |
S1 |
S2 |
S |
Рис. 15 |
|
|
|
|
Линия 1-2 лежит на изохоре V.
По положению точки 1 из i-S диаграммы находятся V1, i1,t1, S1 . По положению точки 2 находятся Р2, i2, S2. Изменение внутренней энергии пара в процессе равно
U U2 U1 (i2 P2 V ) (i1 |
P1V1 ) (i2 i1 ) V (P2 P1 ) (1.109) |
Работа процесса l= 0. |
(1.110) |
35
Теплота процесса согласно первому закону термодинамики
q |
U (i2 i1 ) V |
(P2 P1 ) |
(1.111) |
|
б) изобарный процесс (рис.16) |
|
|
|
|
i |
|
|
p |
|
i2 |
|
|
|
t2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
v2 |
t1 |
|
q |
|
|
||
|
|
|
|
|
|
|
x=1 |
|
|
i1 |
1 |
|
|
|
|
v1 |
x1 |
|
|
|
|
|
|
|
|
S1 |
S2 |
S |
|
|
Рис. 16 |
|
|
|
Пусть в процессе начальное и конечное состояние пара характеризуются параметрами Р , х1 , t2.
Точка 1 лежит на пересечении линий х1 и Р точка 2 лежит на пересечении t2 и Р. График процесса изобразится линией 1-2, лежащей на линии Р = const.
Из положения точки 1 определяются V1, i1,t1, S1 Из положения точки 2 находятся V2, i2, S2.
Изменение внутренней энергии пара в процессе равно
U |
U2 |
U1 |
(i2 |
P V2 ) (i1 |
P1V1 ) |
(i2 |
i1 ) P (V2 |
V1 ) (1.112) |
Работа процесса |
|
|
|
|
|
|||
|
l |
P (V2 |
V1 ) |
|
|
|
(1.113) |
|
Теплота процесса |
|
|
|
|
|
|||
q |
U l |
(i2 |
i1 ) P (V2 |
V1 ) |
P(V2 |
V1 ) i2 |
i1 (1.114) |
|
в) изотермический процесс (рис. 17).
Пусть в изотермическом процессе начальное состояние пара характеризуется Р1, х, конечное - Р2, Начальное состояние пара изобразится точкой 1, лежащей на пересечении х и Р, конечное со-
36

стояние точкой 2, лежащей на пересечении изотермы t, проходящей через точку 1 и изобары Р2. График процесса изобразится линией 1- 2, лежащей на изотерме t .
Из графика по положению точки 1 находится i1, S1, и по положению точки 2 - V2, i2, S2.
Изменение внутренней энергии пара
i |
|
p1 |
|
p2 |
i2 |
|
|
|
|
|
|
2 |
t |
|
|
|
|
|
|
i1 |
|
|
v2 |
|
|
|
|
|
|
|
|
|
x=1 |
|
v1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
x1 |
|
|
S1 |
|
S2 |
S |
|
Рис. 17 |
|
|
|
U U2 U1 (i2 P2 |
V2 ) (i1 |
P1V1 ) |
(i2 i1 ) |
P2V2 P1V1 ) (1.115) |
Теплота процесса |
q |
T (S2 |
S1 ) |
(1.116) |
Работа процесса |
|
|
|
|
l=q - ∆U. |
|
|
|
(1.117) |
г) адиабатный процесс (рис. 18).
Пусть в адиабатном процессе начальное состояние пара характеризуется Р1 и t1, а конечное -Р2.
37

Рис. 18
При заданных условиях начальное состояние пара в процессе изобразится точкой 1, лежащей на пересечении Р1 и t1, конечной точкой 2, лежащей на пересечении Р2, и S = const. График процесса изобразится линией 1-2, лежащей на адиабате
S = const. Из графика находятся: i1, S, i2, V1, V2, t2.
Изменение внутренней энергии пара в процессе
U U |
2 |
U |
1 |
(i |
2 |
P V ) |
(i |
PV ) |
(i |
i ) |
(P V |
PV ) . (1.118) |
||||
|
|
|
2 |
2 |
1 |
1 |
1 |
1 |
2 |
2 |
2 |
1 |
1 |
|||
|
Теплота адиабатного процесса равна |
|
|
|
|
|||||||||||
|
|
|
|
q |
0 |
|
|
|
|
|
|
|
|
|
(1.119) |
|
|
Работа процесса |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
l |
|
|
u |
u1 |
u2 |
|
|
|
|
|
|
(1.120) |
1.6.Истечение и дросселирование газов и паров
1.6.1.Уравнение 1 закона термодинамики для термодинамических процессов, осуществляемых при потоке газа
Допустим, что через суживающийся канал (рис. 19), заполняя все его сечение, движется газ слева направо. На участке канала между сечениями I-I и II-II к газу извне подводится теплота q. Дав-
ление газа в канале падает, т.е. P2 P1 . Трением газа о стенки канала пренебрегаем. В описанных условиях происходит расширение
газа |
в канале и увеличение скорости его движения V2 V1 и |
C2 |
C1 . Считаем, что температура газа не изменяется. |
38
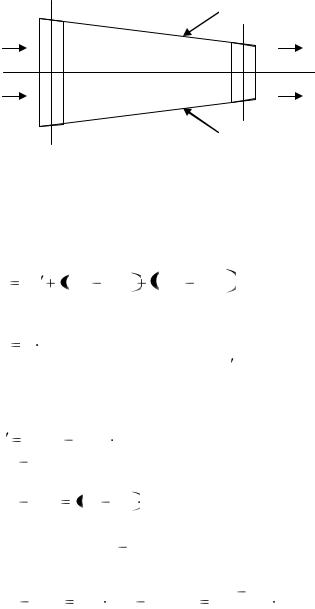
|
I |
q |
|
|
|
|
|
II |
газ |
|
p2,v2,c2,t2 |
|
|
p1,v1,c1,t1 |
|
|
газ |
|
|
q |
|
|
Рис. 19 |
Выделим в сечении I-I элементарную массу газа dM между двумя бесконечно близкими сечениями, а также изобразим ее и в сечении II-II.
Составим баланс энергии для выбранной массы газа при перемещении ее из сечений I-I в сечении II-II. Этот баланс энергий
имеет вид |
|
|
|
|
|
dQ |
dL dU2 dU1 |
dЭk |
|
dЭk |
(1.121) |
|
|
|
2 |
1 |
|
Здесь dQ - количество тепла, сообщенного выбранному |
|||||
элементу газа при перемещении его из сечения I в сечение II. |
|||||
dQ |
q dM , |
|
|
|
(1.122) |
где q - удельная теплота процесса. dL |
- работа вытеснения |
||||
(проталкивания), получающаяся при одновременном перемещении и изменении объема газа в условиях воздействия на него внешних сил давления
dL |
|
(P2V2 |
P1V1 ) |
dM ; |
|
|
|
(1.123) |
|||
dU2 |
dU1 |
- изменение |
внутренней |
энергии выбранного |
|||||||
элемента газа при перемещении его из сечения I в сечении II. |
|||||||||||
dU2 |
dU1 |
U 2 |
U1 dM ; |
|
(1.124) |
||||||
U1 ,U 2 - удельные внутренние энергии газа соответственно |
|||||||||||
в сечениях I-I и II –II; dЭk |
dЭk - изменение кинетической энер- |
||||||||||
|
|
|
|
|
|
2 |
1 |
|
|
|
|
гии элемента газа при перемещении его из сечения I-I в сечение II-II |
|||||||||||
|
|
|
|
C 2 |
|
C 2 |
C 2 |
C 2 |
|||
dЭk |
|
dЭk |
2 |
|
dM |
1 |
dM |
2 |
1 |
dM . (1.125) |
|
|
|
|
|
|
|
|
|||||
|
2 |
1 |
|
2g |
|
2g |
|
2g |
|||
|
|
|
|
|
|
||||||
39

Если в уравнении (1.121) подставить выражения (1.122) – (1.125) и сократить dM , то получим
|
|
|
|
|
|
|
|
C 2 |
C 2 |
|
|
q P V |
|
PV |
U |
|
U |
2 |
1 |
. |
(1.126) |
||
2 |
2 |
1 |
|
|
|||||||
2 |
1 |
1 |
|
|
|
2g |
|
||||
|
|
|
|
|
|
|
|
|
|
||
Формула (1.126) представляет собой уравнение I закона термодинамики для термодинамических процессов, осуществляемых при потоке газа.
Для удобства практического использования преобразуем
формулу (1.126) к виду |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
C 2 |
C 2 |
|
q |
U |
|
P V |
|
U |
|
PU |
2 |
1 |
; (1.127) |
|
2 |
2 |
1 |
1 |
|
|
||||||
|
|
2 |
|
1 |
|
2g |
|||||
|
|
|
|
|
|
|
|
|
|
||
U |
PV |
i |
|
|
|
|
|
|
(1.128) |
||
1 |
1 |
1 |
1 |
|
|
|
|
|
|
|
|
U2 |
P2V2 |
i2 |
|
|
|
|
|
|
(1.129) |
||
Здесь i1, i2 – энтальпии соответственно в течениях I-I и II-II.
Вводя (1.128) и (1.129) в (1.127), получим
|
|
C2 |
C2 |
|
|
q i |
i |
2 |
1 |
. |
(1.130) |
|
|
||||
2 |
1 |
2g |
|
||
|
|
|
|||
Отсюда очевидно, что теплота, подводимая к движущему газу, расходуется на изменение его энтальпии и кинетической энергии.
В дифференциальном виде
dq di |
dC2 |
|
|
. |
|
|
||
|
2g |
|
1.6.2. Истечение газов и паров через сопла
Соплами называются короткие каналы специального профиля, при прохождении через которые газ или пар приобретают большую скорость видимого движения.
Сопла являются важными элементами таких технических устройств, как паровые и газовые турбины, реактивные двигатели и т.д.
40
