
2522
.pdf
В P-ν координатах изохора представляется вертикальной линией, а в Т - S координатах логарифмической кривой (рис.6).
Из уравнения состояния PV = RT для начала процесса
|
PV |
RT |
(1.54) |
||
1 |
|
1 |
|||
и для конца процесса |
|
||||
P2V = RT2. |
(1.55) |
||||
Поделив (1.55) на (1.54) получим |
|
||||
|
P2 |
|
T2 |
|
|
|
P1 |
T1 |
(1.56) |
||
|
|
|
|
|
|
Из пропорции (1.56) можно определить один из параметров, если известны три другие. Баланс энергии в процессе на основании анализа уравнения 1-го закона термодинамики.
q = ∆u + l |
(1.57) |
|
Для изохорного процесса следует |
||
|
s2 |
|
q |
T dS 0, m.k.ds 0; |
|
|
s1 |
|
|
T2 |
|
u |
Cv |
dT 0, m.k.dT 0; |
|
T1 |
|
|
v2 |
|
l |
dv |
0, m.k.dv 0; |
v1
Таким образом, для изохорного процесса уравнение 1-го за-
кона термодинамики имеет вид |
|
q = ∆u. |
(1.58) |
-q = -∆u. |
(1.59) |
Отсюда следует, что в изохорном процессе вся теплота, подведенная к газу расходуется на изменение внутренней энергии и наоборот, все тепло отводимое от газа получается за счет уменьшения внутренней энергии газа. Изменение внутренней энергии в этом процессе находится
u |
Ccp |
t2 |
Cvcp |
|
t1 |
(1.60) |
|
|
2 |
|
1 |
|
|
|
|
|
|
|
||
при Cv = const |
|
|
|
|
|
|
u |
Cv |
(t2 |
t1 ) |
|
|
(1.61) |
|
|
|
|
|
|
21

Работа процесса
l=0. (1.62)
Теплота процесса
|
q |
u |
|
Ccp |
|
t2 Cvcp t1 |
|
(1.63) |
|
|
|
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
|
|
|
||
при |
Cv = const |
|
|
|
|
||||
|
q |
Cv (t2 |
t1 ) |
|
|
(1.64) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
1.4.3. |
Изобарный процесс |
|
|||||
Из определения следует, что уравнение изобарного процесса |
|||||||||
в перемен -ных Р и v выразится |
|
|
|||||||
|
Р = const. |
|
|
|
|
|
(1.65) |
||
В Т и S переменных |
|
|
|
|
|
|
|
||
|
dq = T ∙dS, |
|
|
|
(1.66) |
||||
|
dq = Cp∙dT. |
|
|
|
(1.67) |
||||
Из (1.66) и (1.67) следует |
|
|
|||||||
|
dS |
C p |
dT |
|
|
|
|
|
|
|
|
T |
|
|
|
(1.68) |
|||
|
|
|
|
|
|
|
|||
при Сp = const |
|
|
|
|
|
|
|
|
|
|
S |
C p |
lnT |
|
C |
|
(1.69) |
||
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
v=const |
|
|
|
|
|
|
|
|
|
|
2’ |
2’’ |
1 |
2’ |
|
|
|
|
|
|
|
-1 |
+1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
2’’ |
|
|
|||
|
|
|
|
|
|
|
|
+q |
|
|
|
|
|
|
|
|
|
-q |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
3’’ |
4’’4’ |
3’ S |
|
|
|
|
|
|
Рис. 7 |
|
|
|
Из рис.7 следует, что изобара в Р - v координатах - это горизонтальная линия, а в Т - S координатах логарифмическая кривая,
22
положе изохоры. |
|
|
|
|
||
Из уравнения состояния |
|
|||||
Pv = RT |
|
|
|
|||
для начала процесса |
|
|
|
|
||
|
P v1 |
|
RT1. |
(1.70) |
||
И для конца процесса |
|
|||||
|
P v2 |
|
RT2 . |
(1.71) |
||
Поделив (1.71) на (1.70), получим |
||||||
|
v2 |
|
T2 |
|
|
|
|
v1 |
T1 |
|
|
(1.72) |
|
|
|
|
|
|
|
|
Баланс энергии в процессе |
|
|||||
q |
u |
l |
|
(1.73) |
||
|
|
|
|
|
|
|
Для изобарного процесса следует |
|
|||||
|
|
s2 |
|
|
|
|
q |
T |
dS |
0, m.k.ds |
0; |
||
|
|
s1 |
|
|
|
|
|
|
|
T2 |
|
|
|
|
u |
Cv |
dt 0, m.k.dT |
0; |
||
|
|
|
T1 |
|
|
|
|
|
v2 |
|
|
|
|
l |
p |
dv |
0, m.k.dv 0; |
|||
v1
Для изобарного процесса уравнение 1-го закона термодинамики сохраняет свою общую форму, т.е.
q |
u l |
(1.74) |
|
|
|
-q = -∆u-l. |
(1.75) |
|
Отсюда следует, что в изобарном процессе тепло, подводимое к газу, частично расходуется на увеличение внутренней энергии газа и часть его идет на работу, совершаемую газом против внешних сил давления, и наоборот, тепло, отводимое от газа, получается за счет уменьшения внутренней энергии газа и за счет работы, совершаемой внешними силами давления при сжатии газа. Изменение
внутренней газа в изобарном процессе |
|
||
u Ccp t2 |
Cvcp |
t1 |
(1.76) |
2 |
|
1 |
|
|
|
||
23
при cv = const |
|
|
|
|
u |
cv (t2 |
t1 ). |
|
(1.77) |
|
|
|
|
|
Работа процесса получится |
|
|
||
|
v2 |
|
|
|
l |
p dv p(v2 |
v1 ) R(T2 T1 ). |
|
|
|
v1 |
|
|
(1.78) |
|
|
|
|
|
теплота процесса |
|
|
|
|
q C pcp 2 t2 |
C pcp1 |
t1 |
(1.79) |
|
|
|
|
|
|
при Ср = const |
|
|
|
|
q = Cср(t2-t1). |
|
(1.80) |
||
1.4.4. Изотермический процесс
Уравнение изотермического процесса в p-v переменных по-
лучается из основного уравнения состояния |
|
|
|
||
|
p∙v = RT = const. |
|
|
(1.81) |
|
В переменных Т и S уравнение процесса запишется |
|||||
|
Т = const. |
|
|
(1.82) |
|
P |
|
T |
|
|
|
2’’ |
|
|
|
|
|
|
|
2’’ |
|
1 |
2’ |
|
1 |
|
|
|
|
|
|
2’ |
-q |
|
+q |
-1 |
|
+1 |
|
||
|
|
|
|
||
3’’ |
4’’4’ |
3’ v |
|
|
S |
|
|
Рис. 8 |
|
|
|
Изотермы в p-v координатах представляются равнобокими гиперболами, а в T-S координатах горизонтальной линией (рис.8). Из уравнения состояния pv = R Т для начала процесса
P1∙ v1=RT (1.83)
И для конца процесса
24
P2∙ v2=RT |
(1.84) |
Поделив (1.84) на (1.83), получим |
|
|
p2 |
|
v2 |
|
|
|
|
|
|
|
p1 |
|
v1 |
|
|
|
|
|
(1.85) |
|
|
|
|
|
|
|
|
|
|
Баланс энергии в процессе q |
u |
l |
(1.86) |
||||||
|
|
s2 |
|
|
|
|
|
|
|
q |
T |
|
dS |
0, m.k.dS |
0; |
|
|
||
|
|
s1 |
|
|
|
|
|
|
|
|
|
T2 |
|
|
|
|
|
|
|
|
u |
|
C dT |
0, m.k.dT |
0; |
|
|||
|
|
T1 |
|
|
|
|
|
|
|
|
|
V2 |
|
|
|
|
|
|
|
l |
P |
dv |
0, m.k.dv |
0; |
|
|
|||
V1
и уравнение 1-го закона термодинамики для этого процесса
принимает вид |
|
q = l. |
(1.87) |
-q = -l. |
(1.88) |
Отсюда следует, что в изотермическом процессе теплота, подводимая к газу целиком расходуется на работу, совершаемую газом против внешних сил давления , и теплота, отводимая от газа, получается только за счет работы, совершаемой внешними силами давления при сжатии газа. Изменение внутренней энергии газа в
процессе |
|
|
|
|
|
|
|
|
|
|
|
|
|
∆u=0 |
|
|
|
|
|
|
|
|
|
|
|
(1.89) |
|
Работа процесса находится |
|
|
|
|
|
|
|
|
|
||||
v2 |
|
v2 |
|
dv |
|
|
|
v2 |
|
p1 |
|
||
l |
p dv |
|
R T |
|
RT ln |
RT ln |
|
||||||
v |
v1 |
p2 |
|
||||||||||
v |
|
v |
|
|
|
|
(1.90) |
||||||
1 |
|
1 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||
Теплота процесса |
|
|
|
|
|
|
|
|
|
|
|
|
|
q l |
RT ln |
v2 |
|
RT ln |
p1 |
|
|
|
|
||||
v1 |
p2 |
|
(1.91) |
||||||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
или
25
|
S2 |
|
q |
|
T dS T (S2 S1 ) |
|
S1 |
(1.92) |
|
|
1.4.5.Адиабатный процесс
Впеременных р и v уравнение адиабатного процесса имеет
вид
p∙vk = const, |
(1.93) |
где k - показатель адиабаты. |
|
K |
C p |
1 |
|
|
|||
Cv |
|||
|
(1.94) |
||
|
|
Показатель адиабаты зависит от атомности газа. Так, для адноатомного газа k = 1,66, для двухатомного k = 1,4, Для трех и многоатомного газов k = 1,33.
В T и S переменных
dq=0. |
|
|
(1.95) |
S=const. |
|
(1.96) |
|
P |
|
T |
|
|
|
|
2’’ |
2’’ |
|
|
|
|
|
|
1 |
|
1 |
|
|
-1 |
+1 |
2’ |
2’ |
|
|||
3’’ |
4’’4’ |
3’ v |
S |
|
|
Рис. 9 |
|
Поскольку К > 1,то в координатах P-v линия адиабаты идет круче линии изотермы и изображается обобщенной гиперболой, а в Т - S координатах - это вертикальная линия (рис.9).
Соотношение между параметрами в начале и конце адиабатного процесса имеет следующий вид:
26

T1 |
|
v2 |
|
|
P1 |
|
K 1 |
|
|
|
) K 1 |
|
|
|
|
|
|||
( |
( |
) K |
|
||||||
|
|
|
|
||||||
T2 |
|
v1 |
|
P2 |
(1.97) |
||||
|
|
|
|
|
|
|
|
|
|
Баланс энергии в адиабатном процессе согласно уравнению 1-го закона термодинамики находится следующим образом:
q |
T |
dS, т.к. dS=0; |
|
|
T2 |
|
|
|
U |
Cv |
dT 0, |
|
T1 |
|
т.к. dT≠0; |
|
|
|
|
|
V2 |
|
|
l |
P |
dv |
0, |
|
V1 |
|
т.к. dv≠0; |
|
|
|
|
Отсюда имеем |
|
|
|
-∆U=l |
|
(1.98) |
|
∆U=-l |
|
(1.99) |
|
Из уравнений (1.98), (1.99) следует, что в адиабатном процессе работа, совершаемая газом против внешних сил давления, получается за счет уменьшения внутренней энергии газа, и работа, совершаемая внешними силами давления при сжатии газа, целиком расходуется на увеличение внутренней энергии газа.
Изменение внутренней энергии в адиабатном процессе
U Cvcp |
t2 |
Cvcp |
t1 |
|
2 |
|
1 |
при Cv = const
U Cv (t2 t1 )
Теплота процесса |
|
q=0 |
|
|
|||||
Работа адиабатного процесса находится |
|
|
|||||||
|
v2 |
v2 |
dv |
|
const |
|
|
|
|
l |
p dv |
const |
|
(v1 k |
v1 k ) |
||||
|
|
||||||||
|
|
|
vk |
|
1 k |
2 |
1 |
||
|
v1 |
v1 |
|
|
|
||||
|
|
|
|
|
|
|
|||
(1.100)
(1.101)
(1.102)
1 |
(constv12 |
k |
constv11 |
k ). |
|||
|
|
||||||
1 k |
|
||||||
|
|
|
|
|
(1.103) |
||
Здесь |
|
|
|
|
|
|
|
|
constv12 |
k |
p2 |
v2k v12 |
k |
p2 v2 , |
|
27

constv11 k 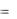 p1
p1  v1k
v1k  v11 k
v11 k  p1v1 .
p1v1 .
Отсюда
l |
|
1 |
|
( p v p |
v |
|
) |
R |
(T T ). |
||||
|
|
|
2 |
|
|||||||||
1 |
|
k |
1 |
1 |
2 |
|
|
k 1 |
1 |
2 |
|||
|
|
|
|
|
|
|
|
|
|||||
1.4.6. Политропный процесс и его обобщающее значение
Из определения
p∙vn = const, (1.104)
где n-показатель политропы, который может принимать любое численное значение в пределах от - ∞ до + ∞, но для данного процесса он является величиной постоянной.
Политропный процесс имеет обобщающее значение, т.к. охватывает всю совокупность основных термодинамических процессов. Докажем, что это справедливо:
1)n = ± ∞
р∙ v± ∞ = const,
1
p 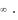 v const,
v const,
v = const .
Изохорный - это политропный процесс, у которого n
= ±∞
2)n = 0,
р∙ v0 = const,
р= const.
Изобарный - это политропный процесс с показателем политропы п = 0.
3)n = 1,
p∙v = const.
Изотермический - это политропный процесс, показатель политропы которого n=1.
4)n = К,
р vk = const.
Адиабатный - это политропный процесс, показатель политропы которого n=K
28
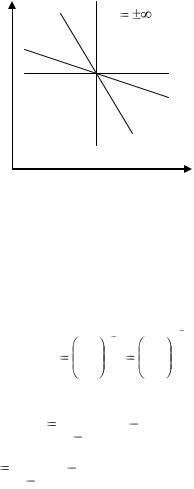
В p-v диаграмме на рис. 10 изображены политропные процессы с разными значениями показателя политропы. Изохора (n = ±∞) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой (расширение рабочего тела); процессы, расположенные левее изохоры, характеризуются отрицательной работой.
P |
n |
|
n=0
n=1
n=k
v
Рис. 10
Процессы, расположенные правее и выше адиабаты, идут с подводом тепла к рабочему телу, а лежащие левее и ниже адиабаты - с отводом тепла. Для процессов расположенных над изотермой п = 1, характерно увеличение внутренней энергии газа, расположенных под изотермой - уменьшение внутренней энергии.
Соотношение между параметрами для политропного процесса имеет вид
|
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
n 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
P1 |
|
|||||
|
|
|
|
|
|
v2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
T2 |
|
|
|
v1 |
|
P2 |
(1.105) |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Работа расширения газа в этом процессе |
|
|||||||||||||||
|
|
l |
|
|
1 |
|
( p1v1 |
p2 v2 ) |
|
|||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
n |
|
1 |
|
|
|
|
|
|
(1.106) |
|
l |
R |
|
|
(T |
T ) |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||||
или |
n |
1 |
1 |
|
2 |
|
|
|
|
|
|
(1.107) |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||
Количество подведенного (или отведенного) в процессе тепла находится
29

|
|
q |
|
U |
|
l, |
|
|
|
|
|
|
|
|
|
т.к |
U |
CV (T2 |
|
T1 ) |
и с учетом (1.107) получаем |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
q |
C |
n |
|
k |
T |
T |
C |
|
T |
T , |
|
||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
V |
n |
|
1 |
|
2 |
1 |
|
n |
2 |
1 |
(1.108) |
|
C |
|
C |
n |
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где |
|
n |
V |
n |
|
1 |
- теплоемкость газа в политропном про- |
||||||||
цессе.
1.5. Водяной пар. Расчет основных термодинамических процессов для пара
Вместе с однородными газами в технике в качестве рабочих тел и теплоносителей широко используются и пары жидкостей, главным образом водяной пар. Это объясняется выгодными термодинамическими свойствами водяного пара, безвредностью его для живых организмов и для металла и широким распространением в природе воды, из которой получают пар.
По своему агрегатному состоянию пар занимает промежуточное положение между жидкостью и газом, поэтому его уравнение состояния, а также уравнения для энтропии, энтальпии, внутренней энергии имеют сложный характер.
В расчетах, связанных с водяным паром, пользуются в основном таблицами и диаграммами, составленными на их основе.
1.5.1. Процесс парообразования. P-v диаграмма водяного пара
Рассмотрим процесс получения пара из воды, осуществляемый при Р -const. Для этого 1 кг воды при температуре 0°С поместим в цилиндр с подвижным поршнем. Приложим к поршню извне некоторую постоянную силу Р (рис.11).
Тогда при площади F давление будет постоянным и равным р =p/F, Изобразим
30
