
2522
.pdf1.2.3. Теплота
Кроме микрофизической формы передачи энергии - работы существуй также и микрофизическая, т.е. осуществляемая на молекулярном уровне форма обмена энергией между системой и окружающей средой. В этом случае энергия может быть передана без совершения работы. Мерой количества переданной энергии служит теплота. Теплота - это энергетическая характеристика процессов теплового взаимодействия системы с окружающей средой, показывающая то количество энергии, которое передано системе через границы в определенном процессе.
1.2.4. Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям, открытого М.В. Ломоносовым.
Допустим, что некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление P, сообщается извне бесконечно малое количество теплоты dQ. В результате подвода теплоты тело нагревается dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к увеличению расстояния между молекулами. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, оказывающей на него давление, то при своем расширении оно производит механическую работу dL против сил внешнего давления. Учитывая отсутствие других изменений в системе, согласно закону сохранения энергии
dQ = dU + dL, (1.25)
т.е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы. Уравнение (1.25) является математическим выражением первого закона термодина-
11

мики. Для системы, содержащей 1кг. рабочего тела,
dq = dU + dl. (1.26)
Проинтегрировав (1.26) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме
q U l , |
(1.27) |
где U U2 U1
1.2.5.Теплоемкость газов
Вобщем случае при подводе или отводе тепла изменяется температура газа. Предел отношения теплоты процесса, отнесенный
ккакой-либо количественной единице газа, к изменению температуры газа в этом процессе при условии, что изменение температуры газа в процессе стремится к нулю, называется теплоемкостью газа в процессе
lim( |
q |
) |
dq |
C |
|
|
|||
|
t |
dt |
|
|
Различают удельную массовую теплоемкость С, отнесенную к 1 кг газа и измеряемую в Дж/(кг К), удельную объемную теплоемкость, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях и измеряемую в Дж/(м3К) и
удельную мольную теплоемкость,  ломолю и измеряемую в Дж/(кмоль К).
ломолю и измеряемую в Дж/(кмоль К).
В термодинамических процессах широко используются теплоемкости при постоянном давлении Ср и при постоянном объеме Сν.Указанные теплоемкости взаимосвязаны уравнением Майера которое является одним из основных в технической термодинамике.
Ср -Сν =R. (1.29)
Теплоемкости Ср и Cν для идеальных газов устанавливаются опытным путем по спектроскопическому методу и приводятся в справочной литературе в виде таблиц, так называемых истинных теплоемкостей различных газов, при разных температурах. Вследствие того, что теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
12
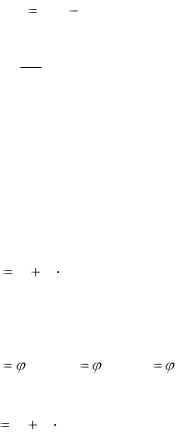
Средней теплоемкостью Ст (Сср ) данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур (t2-t1).
С |
|t |
2 |
q(t |
2 |
t ). |
|
ср |
t |
1 |
|
1 |
(1.30) |
|
|
|
|
|
|
|
Выражение
C 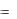 dq
dq
dT (1.31)
определяет теплоемкость при данной температуре, или так называемую истинную теплоемкость.
1.2.6.Энтальпия
Втермодинамике важную роль играет величина суммы внутренней энергии системы U и произведения давления системы Р на величину объема системы V, называемая энтальпией и обозначаемая
I U p V |
(1.32) |
|
Поскольку входящие в (1.32) величины являются функцией состоянии, то и сама энтальпия является функций состояния и поэтому может быть представлена в виде функции двух любых пара-
метров состояния: |
|
|
|
|
|
|
|
I |
|
(PV ); I |
|
(T ); H |
|
(P,T ). |
(1.33) |
|
1 |
1 |
2 |
|
3 |
|
|
|
|
|
|
||||
Энтальпия измеряется в джоулях. |
|
|
|
||||
Величина |
|
|
|
|
|
|
|
i U |
|
P V , |
|
|
|
|
(1.34) |
называемая удельной энтальпией, измеряется в Дж/кг.
Физически энтальпия системы представляет собой сумму внутренней энергии источника внешнего давления.
1.3.Второй закон термодинамики
1.3.1.Энтропия
13
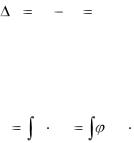
Представляется целесообразным выражать теплоту процесса по форме аналогичной работе. Для этого необходимо иметь два «тепловых» параметра состояния газа, аналогичных соответственно давлению и удельному объему газа.
Аналогом давления может быть температура T. В качестве аналога удельного объѐма при выражении теплоты процесса по форме, аналогичной работе в термодинамике, принимается особая
величина, называемая энтропией газа. |
|
dl = Pdv |
|
dq =Tds. |
(1.35) |
Таким образом, в случае элементарного процесса теплота |
|
процесса выражается |
|
dq =Тds. |
(1.36) |
Для 1 кг газа S измеряется в Дж/(кгК).
Для произвольного количества газа энтропия, обозначаемая через S, равна S = М • S и измеряется в Дж/К.
В технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в какомлибо процес-
се: |
|
|
|
|
S S2 |
S1 |
dq |
|
|
|
|
|||
T |
(1.37) |
|||
|
|
Понятие энтропии позволяет ввести удобную для термодинамических расчетов T-S диаграмму, на которой термодинамический процесс изображается линией (рис. 2).
Из уравнения (1.36) следует, что
2 |
2 |
|
q T dS |
(S) |
dS |
1 |
1 |
(1.38) |
Очевидно, что в T - S диаграмме элементарная теплота процесса dq изображается элементарной площадкой с высотой Т и основанием dS, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, равняется теплоте процесса.
14
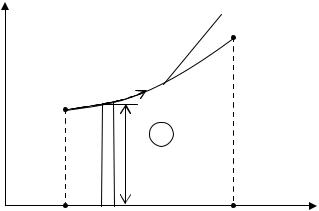
T=φ(S)
2
1 |
|
|
q |
|
T |
S1 |
S2 |
4 |
3 |
|
Рис. 2 |
Согласно (1.38) теплота процесса может быть положительной, отрицательной и равной нулю.
1.3.2. Общая формулировка второго закона термодинамики. Термический КПД цикла
Несмотря на эквивалентность теплоты и работы процессы взаимного превращения неравнозначны. Опыты свидетельствуют, что механическая энергия может быть полностью превращена в теплоту, например путем трения. В то же время теплоту полностью превратить в механическую энергию нельзя. Это связано с существованием второго закона термодинамики. Обратимся к понятиям о термодинамическом цикле. Термодинамическим циклом называется совокупность термодинамических процессов, в результате осуществления которых газ или другое рабочее тело возвращается в исходное состояние.
В системах координат P-V и T-S термодинамический цикл изображается замкнутыми линиями кругового типа (рис.3). В зависимости от направления хода этих линий различают прямые и обратные циклы.
15

|
|
q1 |
|
|
|
P |
|
|
T |
q1 |
|
|
|
|
|
A |
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
расш. |
|
|
|
|
|
|
|
|
|
|
б |
|
1 |
|
Б |
|
|
2 |
|
q2 |
|
|
сж. |
|
|
||
|
|
|
|
|
|
4 |
|
3 V |
4 |
|
3 S |
|
|
Рис. 3 |
|
|
|
Прямым циклом называется такой, график которого изображается в системах координат круговыми линиями, идущими по часовой стрелке. Обратным циклом считается такой, у которого круговые линии направлены протии часовой стрелки. По прямым циклам работают тепловые машины, по обратным -холодильные машины.
Как показал опыт, все тепловые машины должны иметь горячий и холодные источники тепла (рис.4).
/T1 / |
q1 |
1 кг
q2
/T2 /
Рис. 4
Работа двигателя осуществляется следующим образом. Расширяясь, по линии 1, a 2, рабочее тело совершает работу, равную площади 1 а 2 3 4 1.
(1.39)
Для многократного повторения этого процесса нужно возвращать рабочее ic ло в исходное положение. Требуется затратить работу на сжатие, но она должна быть меньше работы расширения,
16
т. е. линия сжатия должна лежать ниже линии расширения. lсж=пл. 162341 . (1.40)
В результате каждый килограмм рабочего тела совершает за цикл полезную работу lпол эквивалентную площади замкнутого контура, т.е.
lпол=пл.1а2б1 |
(1.41) |
В свою очередь, количество тепла, подведенное к рабочему телу от источника тепла согласно T-S диаграмме, изобразится
q1 |
пл.1А2341, |
(1.42) |
а отведенное в холодильник |
|
|
q2 |
пл.1Б2341. |
(1.43) |
Полезно использованное тепло |
|
|
qпол. |
q1 q2 пл.1А2Б1. |
(1.44) |
|
|
|
Это тепло не идет на изменение внутренней энергии рабочего тела, т.к. оно возвращается в цикле в свое первоначальное состояние и, следовательно,
U 0 . (1.45)
Отсюда в соответствии с первым законом термодинамики исчезнувшее в цикле количество теплоты q1-q2 превращается в работу.
q1 q2 lпол .
Эффективность прямого цикла характеризуется термически КПД, показывающим, какая часть тепла, подведенного к рабочему телу в цикле, преобразуется в нем в работу.
|
lпол. |
|
q1 q2 |
1 |
q2 |
|
t |
q1 |
|
q1 |
q1 |
|
|
|
|
|
||||
|
|
|
(1.47) |
|||
|
|
|
|
|
|
Тепловой двигатель без холодного источника теплоты, т.е. двигатель, полностью превращающей в работу всю полученную от горячего источника теплоту, называется вечным двигателем второго рода. Отсюда второй закон термодинамики формулируется: "Вечный двигатель второго рода невозможен".
17

1.3.3. Прямой цикл Карно
Таким образом, для превращения теплоты в работу в непрерывно действующей машине необходимы горячий и холодный источники и рабочее тело. Рассмотрим простейший случай, когда имеется один «горячий» с T1, и один «холодный» с температурой T2 источник теплоты, причем их теплоемкость столь велика, что отвод или подвод тепла не меняет их температуры.
Возможность осуществления обратного цикла заключается в следующем. Теплоту от горячего источника к рабочему телу нужно подводить изотермически. Охлаждать рабочее тело от температуры горячего до температуры холодного можно только адиабатическим расширением с совершением работы. По тем же соображениям процесс теплоотдачи от рабочего тела к холодному источнику тоже должен быть изотермическим, а процесс повышения температуры рабочего тела от T1, до T2 адиабатическим сжатием с затратой работы.
Такой цикл, состоящий из двух изотерм и двух адиабат, носит название цикла Карно (рис.5). С помощью этого цикла С. Карно в 1824 г. установил законы превращения тепловой энергии в механическую.
P |
T |
|
|
|
|
|
1 |
|
|
|
q1 |
|
|
|
|
|
|
|
||
2 |
T1 |
1 |
2 |
|
||
|
|
|
|
|
||
|
|
|
|
|
||
4 |
|
|
|
|
|
|
3 |
T2 |
4 |
|
|
3 |
|
|
|
|
||||
|
|
|
|
|
||
|
|
|
q2 |
|
||
|
|
|
|
|
||
v |
|
S1 |
S2 |
S |
||
Рис. 5 |
|
|
|
|
|
|
Расширяясь изотермически по 1-2 при температуре Т1 от объема V1, до объема V2, газ забирает от горячего источника теплоту q1 =T/S2 –S1. Дальнейшее расширение рабочего тела идет адиа-
18
батно по 2-3. Работа расширения lрасш совершается при этом только за счет внутренней энергии, в результате чего температура газа падает до Т2. Теперь возвратим тело в начальное состояние. Для этого будем сжимать рабочее тело по изотерме 3-4, затрачивая работу lсж и отводя при этом к холодному источнику рабочего тела теплоту q2 =T2(S2 –S1). Дальнейшее сжатие идет по адиабате 4-1. Работа, затраченная на сжатие по линии 4-1, идет на увеличение внутренней энергии, поэтому температура газа увеличивается до T1.
Таким образом, в результате цикла каждый килограмм газа получает от горячего источника теплоту q1, отдает холодному теплоту q2 и совершает работу lпол. Термический КПД цикла Карно запишется
1 T2 .
t |
T1 |
|
|
(1.48) |
|
|
|
Из (1.48) видно, что увеличить КПД цикла можно за счет увеличения температуры горячего источника или уменьшения температуры холодного, причем увеличение T1 повышает КПД меньше, чем уменьшение T2.
1.4. Исследование основных термодинамических процессов для идеальных газов
1.4.1. Основные положения
Основными термодинамическими процессами называются такие, которые осуществляются при условии отсутствия потока газа. К ним относятся изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный - процесс, при котором отсутствует теплообмен с окружающей средой, и политропный, удовлетворяющий уравнению р v n - const.
Метод анализа основных термодинамических процессов сводится к следующему:
19
1) выводится уравнение процесса, в переменных Р и v; строится кривая процесса в P-v и Т-S координатах;
устанавливается соотношение между основными параметрами состояния газа в начале и конце процесса;
на основании первого закона термодинамики устанавливается баланс энергии процесса;
выводится формула для изменения внутренней энергии A U, значения работы l и теплоты q процесса.
1.4.2. Изохорный процесс
Из определения следует, что уравнения изохорного процесса в переменных Р и ν выразится
v-const. (1.49)
В Т и S переменных
dq |
T |
dS |
|
|
(1.50) |
|
|
|
|
|
|
|
|
dq |
C |
|
dt |
|
|
(1.51) |
|
|
|
|
|
|
|
Из (1.50) и (1.51) следует |
|
|
||||
dS |
C |
|
dT |
, |
|
|
|
T |
|
(1.52) |
|||
|
|
|
|
|
||
при Сν=const |
|
|
|
|
|
|
S C |
lnT |
C. |
|
(1.53) |
||
|
|
|
|
|
|
|
P |
|
|
|
T |
|
|
2’ |
|
|
|
|
|
|
|
|
|
|
|
|
2’ |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2’’ |
|
|
|
|
2’’ |
+q |
|
|
|
|
|
||
|
|
|
|
|
|
-q |
|
|
|
|
v |
|
S |
|
|
|
|
Рис. 6 |
|
|
20
