
2718
.pdf
54 Ш952
СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
А.В. ШУВАЕВ
МОДУЛИ ПО ХИМИИ И МИКРОБИОЛОГИИ ВОДЫ
Учебное издание
Практикум
ШуваевАлександрВасильевич
МОДУЛИ ПО ХИМИИ И МИКРОБИОЛОГИИ ВОДЫ
Практикум
Редактор А.О. Квач Компьютерная верстка Ю.В. Борцовой
Изд. лиц. ЛР № 021277 от 06.04.98 Подписано в печать 10.10.2013
3,75 печ. л. |
3,0 уч.-изд. л. |
Тираж 100 экз. |
Заказ № 2718 |
Издательство Сибирского государственного университета путей сообщения |
|||
|
630049, Новосибирск, ул. Д. Ковальчук, 191 |
НОВОСИБИРСК |
|
|
Тел./факс: (383) 328-03-81. Е-mail: bvu@stu.ru |
2013 |
|
УДК 543 |
Оглавление |
|
Ш952 |
Введение .............................................................................................................................. |
3 |
|
Модуль 1. Свойства воды и водных растворов ............................................................ |
4 |
Шуваев А.В. Модули по химии и микробиологии воды:Прак- |
1.1. Растворимость различных веществ в воде....................................................... |
4 |
|
1.2. Теория растворов.................................................................................................. |
8 |
тикум. – Новосибирск: Изд-во СГУПСа, 2013. – 60 с. |
1.3. Кислотность и щелочность водных растворов.............................................. |
14 |
|
Модуль 2. Характеристика природных вод................................................................. |
18 |
|
2.1. Окислительно-восстановительные процессы ................................................ |
18 |
Отражена структура учебного курса «Химия и микробиология воды» и описаны |
2.2. Жесткость воды и методы ее устранения ....................................................... |
22 |
принципы его деления на модули. Для каждого модуля приводится перечень тем. Для |
2.3. Физико-химические показатели качества воды ............................................. |
27 |
самостоятельной работы подобраны задачи. |
Модуль 3. Основные процессы очистки природных и сточных вод..................... |
31 |
Предназначен для студентов, обучающихся по направлению подготовки «Водо- |
3.1. Коллоидные системы и процессы коагуляции............................................... |
31 |
снабжение и водоотведение». |
3.2. Обеззараживание воды ...................................................................................... |
36 |
|
3.3. Сточные воды и методы их очистки................................................................ |
39 |
Рассмотрени рекомендованк изданию на заседании кафедры «Хи- |
Модуль 4. Микробиология воды ................................................................................... |
43 |
мия». |
4.1. Морфология и физиология микроорганизмов .............................................. |
43 |
|
4.2. Санитарная микробиология воды.................................................................... |
46 |
|
4.3. Роль микроорганизмов в процессах очистки сточных вод.......................... |
49 |
|
Список рекомендуемой литературы ............................................................................. |
53 |
Ответственный редактор |
Ответы к задачам ............................................................................................................. |
55 |
д-р техн. наук, доц. С.А. Шахов |
Приложение ...................................................................................................................... |
57 |
Р ец ен з ен т |
|
|
завкафедрой инженерной экологии НГАВТа д-р хим. наук, проф. |
|
|
В.П. Зайцев |
|
|
Сибирский государственный университет путей сообщения, 2013
Шуваев А.В., 2013
Введение
Изучение курса «Химия и микробиология воды» студентами факультета «Промышленное и гражданское строительство» осуществляется в течение шестого семестра. Курс разделен на четыре модуля. Работа над каждым модулем оценивается в баллах и включает в себя: посещение обязательных лекционных, лабора- торно-практических занятий и выполнение внеаудиторных самостоятельных заданий. В течение семестра проводится три коллоквиума.
Общая сумма баллов за работу над модулями – 100. Подсчет баллов за конкретную работу производится при своевременном ее выполнении. При задержке до 1 недели количество баллов уменьшается на 30 %, более недели – 50 %. Допуск к сдаче зачета студенты получают при условии, что сумма набранных баллов за семестр составляет не менее 65.
Успешное усвоение материала курса «Химия и микробиология воды» невозможно без систематической самостоятельной работы студентами в течение семестра. Целью практикума является организация такого вида работы, который включает в себя знакомство с содержанием тем и вопросами модуля с последующей проработкой материала по конспекту лекций, учебнику, методическим разработкам кафедры и закрепление материала путем решения рекомендуемого списка задач по теме. При решении задач необходимо использовать материалы приложения: пункты 1.2, 2.3, 3.1, 3.3 (табл. П1); пункты 1.1, 2.2, 2.3, 3.2, 3.3 (табл. П2);
пункты 1.3,2.2(табл.П3);пункт 2.1(табл.П4).
3
Использование в тексте заданий для выражения количества эквивалентов вещества старой системы (г-экв) вместо современной системы СИ (моль эквивалентов вещества) сделано только с целью удобства работы с учебной литературой библиотечного фонда СГУПСа, в подавляющем большинстве которой доминирует именно первая система. Взаимный переход между единицами измерения в этих двух системах следующий: для количества эквивалентов вещества – 1 г-экв = 1 моль эквивалентов вещества; для молярной массы эквивалентов вещества – 1 г/г-экв = = 1 г/(моль эквивалентов вещества).
Для выяснения всех возникающих при изучении материала курса затруднений на кафедре «Химия» составляется расписание консультаций лектора и преподавателей, ведущих лабораторнопрактические занятия.
Модуль 1. СВОЙСТВА ВОДЫ И ВОДНЫХ РАСТВОРОВ (29 баллов)
1.1. Растворимость различных веществ в воде
Биологическое и технологическое значение воды. Химические и физические свойства чистой воды. Количественный и качественный аспекты проблемы водоснабжения для промышленных и бытовых целей. Водоснабжение комплекса сооружений железнодорожного транспорта.
Влияние температуры и давления на растворимость газов в воде. Взаимная растворимость жидкостей. Растворимость твердых веществ в воде. Диаграммы растворимости солей в воде. Правило фаз Гиббса. Примеси воды. Физико-химические методы количественного определения примесей.
Способы выражения концентраций растворов: массовая (процентная), моляльная, молярная, молярная концентрация эквивалентов вещества (нормальная), титр раствора. Взаимный переход от одних видов выражения концентрации к другим.
4

Произведение растворимости (ПР), расчет концентраций катиона, аниона и растворимости электролита в насыщенном водном растворе.
Пример 1. Приведите примеры реакций, в которых вода выступает в роли: а) кислоты; б) основания.
Решение. Вода обладает амфотерными свойствами. Она может реагировать в качестве кислоты, например:
NH3 + H2O = NH4OH;
BaO + H2O = Ba(OH)2,
так и в качестве основания, например: H2O + SO3 = H2SO4.
Пример 2. Растворимость сульфата меди (II) при 30 °С равна 25 г на 100 г воды. Определите, можно ли при этой температуре приготовить раствор соли с концентрацией: а) 18 %; б) 20 %;
в) 22 %?
Решение. Определим процентную концентрацию насыщенно-
го раствора CuSO4 при 30 °С: 25 · 100 / (25 + 100) = 20 %. Таким образом, условию задачи удовлетворяют только первые два варианта – 18%-й и 20%-й растворы соли.
Пример 3. Рассчитайте молярную, нормальную, моляльную концентрации и титр 16%-го раствора хлорида алюминия. Плотность раствора равна 1,15 г/мл.
Решение. а) Для вычисления молярной концентрации найдем массу хлорида алюминия, содержащуюся в 1000 мл раствора:
16 г AlCl3 – 100 / 1,15 мл раствора х = 16 · 1000 · 1,15 / 100 = 184 г
х– 1000 мл раствора
Молярная масса AlCl3 равна 133,5 г/моль, следовательно,
М = 184 / 133,5 = 1,38 моль/л.
б) Эквивалентная масса AlCl3 равна: 133,5 : 3 = 44,5 г/г-экв. Нормальная концентрация Cн = C(1/3AlCl3) = 184 : 44,5 =
= 4,13 г-экв/л.
5

в) Для расчета моляльной концентрации определим массу хлорида алюминия, приходящуюся на 1000 г воды:
16 г AlCl3 – (100 – 16) = 84 г воды |
у = 16 · 1000/84 = 190,5 г |
|
у |
– 1000 г воды |
|
Так, m = 190,5 / 133,5 = 1,43 моль/кг.
г) Титр раствора рассчитаем из пропорции:
16 г AlCl3 – 100 / 1,15 мл раствора z = 16 · 1 · 1,15 / 100 = 0,184 г
z– 1 мл раствора
Т= 0,184 г/мл.
Пример 4. Определите число фаз, число компонентов и число степеней свободы для равновесной системы:
CuSO4 · 5H2O (к) 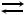 CuSO4(к) + 5H2O(г).
CuSO4(к) + 5H2O(г).
Решение. Число фаз Ф = 3 – две твердые и одна газообразная. В системе находятся три вещества, связанные друг с другом химическим равновесием, поэтому число независимых компонентов К = 3 – 1 = 2. Определим число степеней свободы по правилу фаз Гиббса: С = К – Ф + 2 = 2 – 3 + 2 = 1.
Пример 5. Исходя из произведения растворимости сульфида серебра, вычислите растворимость Ag2S и концентрации ионов Ag+ и S2‾ (моль/л) в насыщенном растворе.
Решение. Гетерогенное равновесие Ag2S(тв) = 2Ag+ + S2– характеризуетсявеличиной ПРAg2S = [Ag+]2·[S2–]=6·10–50(см.табл.П2).
Обозначим растворимость соли через s (моль/л), тогда концентрация ионов Ag+ в насыщенном растворе составит 2s моль/л, а ионов S2– составит s моль/л. Подставляя в исходное уравнение,
получаем: (2s)2s = 6 · 10–50; s = 3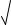 6 10 50 /4 2,47 · 10–17 моль/л; [Ag+] = 4,94 · 10–17 моль/л; [S2–] = 2,47 · 10–17 моль/л.
6 10 50 /4 2,47 · 10–17 моль/л; [Ag+] = 4,94 · 10–17 моль/л; [S2–] = 2,47 · 10–17 моль/л.
Задачи
1. Средний радиус водяной капли в облаках равен 10–6 м. Масса воды в 1 м³ облака колеблется от 0,3 до 4,0 г. Рассчитайте число капель в 1 м³ объема облака.
6
2.Сколько молекул тяжелой воды D2O содержится в 1 кг воды, если примесь тяжелой воды в природной воде составляет 0,02 % по массе?
3.Напишите уравнения термической и электролитической диссоциации воды.
4.Напишите два уравнения реакций, в одной из которых вода проявляет окислительные, а в другой – восстановительные свойства. Может ли вода одновременно проявлять свойства восстановителя и окислителя?
5.В 1 л воды при нормальных условиях растворяется 4,67 л сероводорода. Определите процентную концентрацию получившегося раствора.
6.Сколько граммов нитрата калия выкристаллизуется из 105 г насыщенного раствора при 60 °С, если охладить его до 0 °С. Растворимость соли при указанных температурах соответственно равна 110 и 13 г в 100 г воды.
7.В каком объеме воды надо растворить 67,2 л HCl (н.у.), чтобы получить 9%-й раствор HCl?
8.Из 400 г 20%-го раствора KNO3 при охлаждении выделилось 50 г соли. Чему равна процентная концентрация нитрата калия в оставшемся растворе?
9.Сколько граммов H2SO4 содержится в 3,5 л 0,2 н раствора серной кислоты?
10.До какого объема надо разбавить 500 мл 20%-го раствора NaCl (ρ = 1,152 г/мл), чтобы получить 4,5%-й раствор
(ρ = 1,029 г/мл)?
11.Какой объем 0,05 н раствора Na2SO4 можно получить из 100 мл 1 М раствора Na2SO4?
12.Плотность 9%-го раствора сахарозы C12H22O11 равна 1,035 г/мл. Определите титр, молярную, моляльную концентрации этого раствора.
7
13.К 100 мл 96%-го раствора H2SO4 плотностью 1,84 г/мл прибавили 400 мл воды. Получился раствор плотностью 1,220 г/мл. Рассчитайте процентную и нормальную концентрации разбавленного раствора.
14.Титр раствора хлорида кальция равен 0,0222 г/мл. Рассчитайте молярную и нормальную концентрации этого раствора.
15.Определите число фаз, число компонентов и число степеней свободы для равновесной системы при Р = const:
Na2CO3(к) + CO2(г) + H2O(г) = 2NaHCO3(к).
16.В чем состоит отличие тройной точки воды от температуры замерзания?
17.В стакан воды помещен кусок льда. Изменится ли объем воды в стакане после того, как лед растает, если первоначально кусок льда: а) плавал на поверхности воды; б) был полностью покрыт водой?
18.Вычислите произведение растворимости PbBr2 при
25 °С, если растворимость соли при этой температуре равна
1,32 · 10–2 моль/л.
19.Во сколько раз растворимость AgCl в 0,001 н растворе NaCl меньше, чем в воде?
20.Смешали равные объемы 0,02 н растворов хлорида кальция и сульфата натрия. Образуется ли осадок сульфата кальция?
1.2. Теория растворов
Дисперсные системы. Взвеси, суспензии, эмульсии, пены, коллоиды, растворы. Фазово-дисперсный критерий характеристики природных вод. Растворы ионной и молекулярной степени дисперсности.
Коллигативные свойства растворов. Давление пара над раствором. Свойства разбавленных растворов неэлектролитов. I и II законы Рауля. Осмос. Осмотическое давление и закон ВантГоффа. Явление осмоса в природе. Обратный осмос и его приме-
8
нение в процессах очистки воды. Свойства растворов сильных электролитов, изотонический коэффициент.
Реакции в растворах электролитов. Растворы неэлектролитов и электролитов. Водные растворы электролитов. Степень диссоциации электролитов. Сильные и слабые электролиты. Активность и коэффициент активности иона. Ионная сила раствора. Расчет коэффициентов активности ионов по уравнению Дебая – Хюккеля.
Кинетика химических реакций. Скорость химической реакции. Константа скорости реакции, ее физический смысл. Закон действия масс. Молекулярность и порядок реакции. Энергия активации. Зависимость скорости реакции от температуры (уравнение Аррениуса, правило Вант-Гоффа), концентраций реагентов, давления, природы реагирующих веществ, катализаторов. Обратимые и необратимые химические реакции. Условие химического равновесия. Константа химического равновесия. Принцип Ле Шателье и влияние концентраций реагентов, давления в системе, температуры на смещение химического равновесия. Скорость реакций и установление равновесия в гетерогенных системах.
Пример 1. Температура кипения водного раствора сахарозы C12H22O11 равна 101,4 °С. Вычислите моляльную и процентную концентрацию сахарозы в растворе. При какой температуре замерзает этот раствор?
Решение. Повышение температуры кипения раствора по отношению к чистой воде равно: tкип = 101,4 – 100 = 1,4 °С. По формуле tкип = Е · m находим моляльную концентрацию раствора m = 1,4 / 0,52 = 2,69 моль/кг. Молярная масса C12H22O11 равна 342 г/моль, значит, в 1 кг воды содержится 2,69 · 342 = 920 г сахарозы. Рассчитаем процентную концентрацию сахарозы в растворе: 920 · 100 / 1920 = 47,9 %. Понижение температуры замерзания раствора tзам = Кm = 1,86 · 2,69 = 5 °С. Раствор будет замерзать при –5 °С.
9

Пример 2. К растворам CuCl2, K2SO4, AlCl3, NaHS добавили избыток раствора гидроксида калия. В каких случаях произошли реакции? Напишите молекулярные и ионные уравнения реакций.
Решение. С гидроксидом калия будут взаимодействовать растворы CuCl2; AlCl3; NaHS. Уравнения реакций:
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl, |
Cu2+ |
+ 2OH‾ = Cu(OH)2; |
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl, Al3+ |
+ 4OH‾ = [Al(OH)4]‾; |
|
NaHS + NaOH = Na2S + H2O, |
HS‾ + OH‾ = S2‾ + H2O. |
|
Пример 3. Вычислите ионную силу и активность ионов в растворе, содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2.
Решение. Ионная сила раствора равна:
I= 0,5∑Cizi2 = 0,5(CMg2+ · 22 + СSO24– · 22 + CCl– · 12) =
=0,5(0,02 · 4 + 0,01 · 4 + 0,02) = 0,07.
Коэффициенты активности ионов рассчитаем по уравнению Дэвиса
|
|
|
|
|
|
2 |
0,511 |
|
|
|
I |
|
|||||
|
|
lg i |
z |
|
0,2 I |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
1 1,5 |
|
|
|
I . |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
0,511 |
0,07 |
0,014 0,097 0,332.; |
||||||||
lg |
2 lg |
2 4 |
0,2 0,07 |
|
|
4 |
|||||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
||||||||||||||
Mg |
|
SO4 |
|
|
|
|
|
1 1,5 |
0,07 |
|
|||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
Mg2 |
SO42– 0,466; |
|
||||||||||
|
|
lg |
|
1 0,014 0,097 0,083; |
|||||||||||||
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,826. |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
Используя соотношение a = γ · C, определим активности ионов в растворе:
aMg2 = 0,02 · 0,466 = 0,93 · 10–2 моль/л; aSO42 = 0,01 · 0,466 = 0,47 · 10–2 моль/л; aCl = 0,02 · 0,826 = 1,65 · 10–2 моль/л.
10
