
2718
.pdf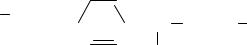
180.Молекулы жиров образуются: а) из глицерина, высших карбоновых кислот; б) из аминокислот, воды; в) из глюкозы; г) из этилового спирта, высших карбоновых кислот.
181.В состав многих синтетических моющих средств (СМС) входит органический анион
OSO2
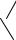
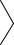
 CH (CH2)9 CH3 .
CH (CH2)9 CH3 .
CH3
После стирки вода загрязняется, но аэробные микроорганизмы осуществляют разложение этого аниона:
2C18H29SO3‾ + 51O2 = 36CO2 + 28H2O + 2HSO4‾.
Определите полную БПК воды, в 100 л которой содержится 0,1 г этого вещества.
182.Дипептид состава С20Н21О3N3 при участии гетеротрофных микроорганизмов подвергается аэробному окислению до углекислого газа, воды и аммиака. Составьте уравнение процесса.
183.В процессе нитрификации образуются: а) ионы аммония
инитратов; б) ионы нитратов и нитритов; в) ионы аммония и мочевина; г) ионы нитратов и азот.
184.Установлено, что железобактерии в процессе синтеза 1 г клеточного вещества используют энергию, выделяющуюся при окислении в среднем 279 г железа (II). Исходя из массы образовавшегося осадка 4,8 кг Fe(OH)3, определите биомассу, синтезированную железобактериями.
185.Из перечисленных организмов для поддержания жизнедеятельности способны использовать атмосферный азот: а) рыбы; б) птицы; в) бактерии; г) насекомые.
186.Процесс денитрификации глюкозы в присутствии анаэробных микроорганизмов можно представить в виде следующей
схемы: KNO3 + C6H12O6 → K2CO3 + CO2 + N2 + Н2О. Составьте уравнение реакции.
51
187. Схема анаэробного распада целлобиозы при метановом брожении имеет следующий вид: C12H22O11 + H2O → CH4 + CO2. Составьте уравнение реакции.
188.Из перечисленных ниже организмов принимают участие
вминерализации органических веществ в почве: а) дождевые черви; б) бактерии; в) почвенные клещи; г) личинки насекомых, обитающие в почве.
189.Напишите схемы химических процессов, которые осуществляют микроорганизмы – нитрификаторы, азотфиксаторы и денитрификаторы. Как эти процессы взаимосвязаны между собой? Какое экологическое значение этих процессов?
190.Укажите лимитирующую (самую медленную) стадию окислительного процесса самоочищения природных вод от органических загрязнителей.
191.После озонирования воды, загрязненной органическими веществами, активность бактерий и их размножение в воде резко возрастают. Объясните это явление.
192.В одном из способов ликвидации нефтяных разливов в океане предлагается нефть поджигать. Предскажите экологические последствия применения этого способа. Какие другие методы борьбы с нефтяными пятнами вам известны?
193.Опишите факторы, влияющие на разложение промышленных отходов в воде. Предложите программу работы по изучению поведения промышленных отходов и способы защиты природных вод.
52
Список рекомендуемой литературы
Основная литература
1.Таубе П.Р., Баранова А.Г. Химия и микробиология воды. М.: Высш.
шк., 1983.
2.Возная Н.Ф. Химия воды и микробиология. М.: Высш. шк., 1979.
3.Доливо-Добровольская Л.Б., Кульский Л.А., Накорчевская В.Ф. Хи-
мия и микробиология воды. Киев, 1971.
4.Вольф И.В., Ткаченко Н.И. Химия и микробиология природных и сточных вод. Л.: ЛГУ, 1973.
5.Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М.: Химия, 1974.
6.Кульский Л.А. Физико-химические процессы обработки природных
источных вод. Киев: Вiсш. шк., 1983.
7.Кастальский А.А., Минц Д.М. Подготовка воды для питьевого и промышленного водоснабжения. М.: Высш. шк., 1962.
8.Голубовская Э.К. Биологические основы очистки воды. М.: Высш.
шк., 1978.
9.Зарубин Г.П., Овчинкин И.П. Санитарные вопросы водоснабжения и канализации. М.: Стройиздат, 1974.
10.Мишустин Е.Н., Емцев В.Г. Микробиология. М.: Высш. шк., 1978.
11.Болдырев А.И. Физическая и коллоидная химия. М.:Высш. шк., 1983.
12.Киреев В.А. Курс физической химии. М.: Химия, 1978.
Дополнительная литература
Учебные пособия и методические рекомендации
13.Кутолин С.А., Писиченко Г.М. Химия и микробиология воды: Установочный конспект лекций. Новосибирск: Изд-во Chem. Lab NCD, МАН ЦНЗ, 2000.
14.Кутолин С.А. и др. Химия воды и микробиология: Учеб. пособие к практикуму. Новосибирск: СГАПС, 1998.
15.Кульский Л.А., Левченко Т.М., ПетроваМ.В., Чехонина Н.А.Метод. указ.
кпрактикуму по химии и микробиологииводы.Новосибирск: НИИЖТ, 1973.
16.Глинка Н.Л. Задачи и упражнения по общей химии. М.: Интеграл-
пресс, 2002.
17.Шалапенок Е.С., Камлюк Л.А., Лисов Н.Д. Тесты по биологии. М.:
Айрис-пресс, 2002.
Методические издания кафедры
18.Методические разработки по классификации примесей воды / Сост. М.В. Петрова. Новосибирск: НИИЖТ, 1975.
19.Элементы качественного анализа: Метод. указ. / Сост. С.Н. Комарова. Новосибирск: НИИЖТ, 1980.
20.Энергетика и направленность химических процессов: Метод. указ. / Сост. М.В. Петрова, С.А. Кутолин. Новосибирск: НИИЖТ, 1981.
53
21.Термодинамика биохимических процессов: Метод. указ. / Сост. М.В. Петрова, С.А. Кутолин. Новосибирск: НИИЖТ, 1981.
22.Термодинамика дисперсных систем: истинных, коллоидных, грубодисперсных: Метод. указ. / Сост. М.В. Петрова, С.А. Кутолин. Новосибирск: НИИЖТ, 1982.
23.Роль микроорганизмов в процессах превращения веществ и энергии в природе: Метод. указ. / Сост. М.В. Петрова, С.А. Кутолин. Новосибирск: НИИЖТ, 1983.
24.Скорость химических реакций и химическое равновесие: Метод. указ. / Сост. Н.В. Кадыкова, Н.А. Чехонина. Новосибирск: НИИЖТ, 1983.
25.Термодинамика электролитов: Метод. указ. / Сост. М.В. Петрова, С.А. Кутолин. Новосибирск: НИИЖТ, 1983.
26.Жесткость воды: Метод. указ. / Сост. Н.В. Кадыкова, Н.Д. Артеменок, Н.А. Чехонина. Новосибирск: НИИЖТ, 1984.
27.Очистка природных и сточных вод методом коагуляции: Метод. указ. / Сост. С.А. Кутолин, Н.И. Бойкин, Н.А. Чехонина. Новосибирск:
НИИЖТ, 1987.
28.Окислительно-восстановительные реакции: Метод. указ. / Сост. Н.В. Кадыкова, Н.А. Чехонина. Новосибирск: НИИЖТ, 1987.
29.Адсорбция и катализ: Метод. указ. / Сост. С.А. Кутолин, Р.Е. Кирикова. Новосибирск: НИИЖТ, 1987.
30.Вязкость и поверхностное натяжение водных растворов: Метод. указ. / Сост. С.А. Кутолин, С.Н. Рябов, Н.И. Бойкин. Новосибирск:
НИИЖТ, 1990.
31.Определение электропроводности природных и сточных вод: Метод. указ. / Сост. Н.И. Бойкин, С.Н Рябов, С.А. Кутолин. Новосибирск:
НИИЖТ, 1990.
32.Физико-химические методы анализа: Метод. указ. Ч. 1. / Сост. С.А. Кутолин,Г.М. Писиченко, Н.Д. Артеменок. Новосибирск: СГАПС, 1994.
33.Физические величины и единицы их измерения. Основы титриметрических (объемных) методов анализа: Метод. указ. / Сост. Г.М. Писиченко, С.А. Кутолин. Новосибирск: СГАПС, 1995.
34.Химический эквивалент вещества: Метод. указ. / Сост. А.В. Шуваев, А.И. Булавченко. Новосибирск: Изд-во СГУПСа, 2002.
35.Термодинамика фазовых переходов: Метод. указ. / Сост. Л.Ф. Кабанова. Новосибирск: Изд-во СГУПСа, 2003.
36.Паули И.А. Свойства растворов. Метод. указ. Новосибирск: Изд-во СГУПСа, 2004.
37.Кабанова Л.Ф. Получение и изучение свойств коллоидных систем. Метод. указ. Новосибирск: Изд-во СГУПСа, 2004.
38.Шуваев А.В. Номенклатура органических соединений: Метод указ. Новосибирск: Изд-во СГУПСа, 2010.
54
Ответы к задачам
1. От 7,2·1010 до 9,6·1011. 2. 6,02·1021 молекул или 0,01 моль. 4. 2H2O +
to , кт
+ 2Na = 2NaOH + H2; 2H2O + 2Cl2 4HCl + O2; 2H2O = 2H2 + O2. 5. 0,70 %. 6. 48,5 г. 7. 1107 мл. 8. 8,6 %. 9. 34,3 г. 10. 2488 мл. 11. 4 л.
12. 0,0932 г/мл; 0,27 моль/л; 0,29 моль/кг. 13. 30,2 %; 7,5 н. 14. 0,2 М; 0,4 н. 15. Ф = 3; К = 3; С = 1. 17. а) Нет; б) уменьшится. 18. 9,2·10–6 . 19. В 74 раза.
20. Нет. 22. 9,44 %; –2,1 °С. 23. –27,0 °С. 24. 22,2 моль. 25. 27 °С. 26. 0,56.
31. aK+ = 0,017 моль/л; аSO42‾ = 0,0055 моль/л. 32. I = 0,06; аCa2+ = 0,0096 моль/л;
аCl‾ = аNO3‾ = 0,017 моль/л. 33. γCl‾ = 0,989; γSO42‾ = 0,955; γPO43‾ = 0,902.
35. Уменьшится в 1,33 раза. 36. В 9 раз. 37. 80,4 кДж/моль. 39. а) Не влияет; б) увеличение Pсмещает равновесие влево; в) не влияет. 40. а) [A] = 2,78 моль/л;
[B] = 1,78 моль/л; [C] = 4,44 моль/л; б) [A] = 1,207 моль/л; [B] = 0,207 моль/л. 41. 1,8. 42. 3,47. 43. 2,09·10–12 моль/л. 44. а) 10–2 моль/л; 10–2 моль/л; 2;
б) 4·10–4 моль/л; 3,94·10–4 моль/л; 3,4; в) 0,15 моль/л; 1,64·10–3 моль/л; 2,79. 45. а) 10–2 моль/л; 10–2 моль/л; 12; б) 10–3 моль/л; 9,88·10–4 моль/л; 10,99;
в)0,03моль/л;7,35·10–4 моль/л;10,87.46.1,12·10–3 моль/л;2,95.47.5,74·10–4 моль/л; [H+] = 1,74·10–11 моль/л ≈ 0. 48. 2,4·10–5 моль/л; 5,68. 49. 10,06. 50. 6,73.
51. 0,01 моль. 53. а; б; д. 54. 8,09; 1,23·10–5. 55. Кг = 1,59·10–7; h = = 1,26·10–3; pH = 10,10. 56. 6,33; 1,18·10–3. 57. б; е. 58. а; г; д; е; з. 59. а) Восстановле-
ние; б) окисление; в) –; г) окисление; д) –. 61. а) NO3– + 2H+ + 2e– = NO2– +
+H2O; 2Сr3+ + 7H2O – 6e– = Cr2O72– + 14H+; б) SO32– + H2O – 2e‾ = SO42– +
+2H+; MnO4– + 2H2O + 3e– = MnO2 + 4OH–; в) Al + 4OH– – 3e– = AlO2– +
+2H2O; NO3– + 6H2O + 8e– = NH3 + 9OH–. 63. а) В обратном; б) в прямом.
64. а) Нет; б) да. 65. 25 мл. 66. 4 |
мг/л. 67. 16,2 мг/л. 68. а) |
2,36 мг-экв/л; |
б) 0,86 мг-экв/л; в)1,09мг-экв/л; г)2,60мг-экв/л; д)1,1мг-экв/л; |
е)0,59мг-экв/л; |
|
ж) 0,44 мг-экв/л. 69. а) 59,6 мг/л; |
б) 12,4 мг/л; в) 183 мг/л; |
г) 71,5 мг/л; |
д) 13,1 мг/л. 70. а)18мг-экв/л; б) 1мг-экв/л; в) 20 мг-экв/л. 71. а) 1,23мг-экв/л; б) 1,37 мг-экв/л. 72. ОЖ = 12 мг-экв/л; карбонат. жестк. = 2 мг-экв/л.
73. 6 мг-экв/л. 74. 126 г. 75. ОЖ = 3,0 мг-экв/л; карбонат. жестк. = 1,5 мг-экв/л. 76.ОЖ=2,4мг-экв/л; карбонат. жестк. =1,2 мг-экв/л; кальц. жестк. =1,8мг-экв/л;
магн. жестк. = 0,6 мг-экв/л. 77. 8 мг-экв/л. 78. 56,0 г. 79. 0,28 мг-экв/л.
80. 6,66 кг Ca(OH)2; 16,96 кг Na2CO3. 84. 1,59 мг/л. 86. ПК = 7,2·10-6 < К –
вода агрессивна. 87. 186 мг/л. 89. Соотношение V5ºС : V15ºС составляет от
4 : 1 до 2 : 3. 91. 142,5 г. 95. 7,2 мг-экв/л. 96. 2,17 г/л. 97. 4 тонны. 98. СFe (иссл) = = 1,526 мг/л; СFe (исх) = 3,052 мг/л. 100. Да, при [Ag+] > 0,07 мг/л. 101. Необ-
55

ходимо: [CO32–] ≥ 5,2·10–8 моль/л (по Pb2+); ≥ 3,7·10–6 моль/л (по Cd2+); ≥ 5,3·10–6 моль/л (по Cu2+); достаточно: [CO32–] ≥ 5,3·10–6 моль/л.
102.а) Раствор CdCl2 к раствору Na2S; б) раствор AgNO3 к раствору KI.
103.СКВr > CAgNO3, заряд гранулы отрицательный. 105. Na2S2O3 + 2HCl = = 2NaCl + H2SO3 + S. 106. Заряд отрицательный. 107. К катоду. 108. Нет,
СH2SO4 > CBa(NO3)2. 109. а) Na2SO4; б) FeCl3. 110. Понизится с 2 мг-экв/л до
1 мг-экв/л. 111. CrCl3. 112. Заряд отрицательный. 113. 19,6 мг/л. 114. Заряд положительный. 115. 116 мл. 116. К = 0,136; β = 0,538. 117. 4,04·1011.
118. |
а) 144,9 %; 86,9 %; б) 173,9 %; 29,0 %; в) 39,0 %; 39,0 %; г) 33,0 %; |
|||
33,0 %. 119. Be(OCl)2. 120. а) 66,0 %; 99,1 %; б) 43,2 %; 21,6 %; |
в) 46,8 %; |
|||
46,8 %; г) 195,4 %; 32,6 %. 121. NHCl2. 122. а) 57,0 %; 28,5 %; |
б) 42,0 %; |
|||
0 %; |
в) 53,4 %; 53,4 %; г) 147,9 %; 0 %. 123. 0,355 мг/л. 124. 35,2 мл. |
|||
125. |
3 л. 127. 176,7 м3. 128. Да, [Ag+] = 1,4 мг/л. 131. О2; ХПК. 133. а. 134. в. |
|||
135. |
в. 136. в. 137. а. 139. О3, доза обычно составляет 1–4 мг/л. 140. Если в |
|||
|
|
|
|
|
воде |
содержаниеn'э(Na2Se)≈nэ(Hg2+), то [Se2–]=[Hg2+] = ПРHgSe =3·10–30 моль/л, |
|||
доза вводимого Na2Se – не более 0,01 мг-экв/л. 141. а) Однократная экстракция, остаток фенола в воде: 1,7·10–2 мг/л > ПДК; б) десятикратно пор-
циями экстракция, остаток фенола в воде: 1,6·10–3 мг/л < ПДК. 142. б.
143. б. 144. в. 145. а. 146. ж. 147. б. 148. д. 149. б. 150. в. 151. в. 152. г.
153. в. 154. а. 155. г. 156. в. 157. а. 158. в. 159. б. 160. а. 162. д. 163. а. 165. г.
166. б. 167. 32; 31 мл. 168. 60; 16,7 мл. 169. 180; 5,6 мл. 170. 157; 6,4 мл.
171. Разбавленная вода: 17; 59 мл; сточная вода: 1707; 0,58 мл. 172. 750.
173. 2000. 175. а. 178. в. 179. д. 180. а. 181. 2,5 мг/л О2. 183. б. 184. 9 г. 185. в.
188. б.
56
Приложение
Таблица П1
Растворимость солей и гидроксидов в воде
Анион |
|
|
|
|
|
|
|
|
|
Катион |
|
|
|
|
|
|
|
|
|
||
Li+ |
Na+ |
K+ |
NH4+ |
Cu2+ |
Ag+ |
Mg2+ |
Ca2+ |
Sr2+ |
|
Ba2+ |
|
Zn2+ |
Hg2+ |
Al3+ |
Sn2+ |
Pb2+ |
Bi3+ |
Mn2+ |
Fe3+ |
Fe2+ |
|
Cl‾ |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
Р |
М |
– |
Р |
Р |
Р |
Br‾ |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
|
Р |
|
Р |
М |
Р |
Р |
М |
– |
Р |
Р |
Р |
I‾ |
Р |
Р |
Р |
Р |
– |
Н |
Р |
Р |
Р |
|
Р |
|
Р |
Н |
Р |
Р |
Н |
– |
Р |
– |
Р |
NO3‾ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
– |
Р |
Р |
Р |
Р |
Р |
CH3COO‾ |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
|
Р |
|
Р |
Р |
Р |
– |
Р |
– |
Р |
– |
Р |
S2‾ |
Р |
Р |
Р |
Р |
Н |
Н |
– |
Р |
Р |
Р |
|
Н |
Н |
– |
Н |
Н |
Н |
Н |
Н |
Н |
|
SO32‾ |
Р |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Р |
Н |
Н |
Н |
– |
– |
Н |
Н |
Н |
– |
Н |
||
SO42‾ |
Р |
Р |
Р |
Р |
Р |
М |
Р |
М |
Н |
Н |
Р |
– |
Р |
Р |
Н |
– |
Р |
Р |
Р |
||
CO32‾ |
Р |
Р |
Р |
Р |
– |
Н |
Н |
Н |
Н |
Н |
Н |
– |
– |
– |
Н |
Н |
Н |
– |
Н |
||
SiO32‾ |
Р |
Р |
Р |
– |
– |
– |
Н |
Н |
Н |
|
Н |
|
Н |
– |
Н |
– |
Н |
– |
Н |
Н |
Н |
CrO42‾ |
Р |
Р |
Р |
Р |
Н |
Н |
Р |
М |
М |
|
Н |
|
Н |
Н |
– |
– |
Н |
Н |
Н |
– |
– |
PO43‾ |
Н |
Р |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
|
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
OH‾ |
Р |
Р |
Р |
Р |
Н |
– |
Н |
М |
М |
|
Р |
|
Н |
– |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Примечание. Р – растворимое вещество; М – малорастворимое; Н – практически нерастворимое; – (прочерк) – вещество не существует или оно разлагается водой.
Таблица П2
Произведения растворимости (ПР) некоторых малорастворимых электролитов при 25 °С
№ |
Соединение |
ПР |
№ |
Соединение |
ПР |
1 |
AgBr |
5,3·10–13 |
14 |
CdS |
7,9·10–27 |
2 |
AgCl |
1,8·10–10 |
15 |
CuCO3 |
2,5·10–10 |
3 |
Ag2CrO4 |
1,1·10–12 |
16 |
CuS |
6,0·10–36 |
4 |
AgI |
8,3·10–17 |
17 |
Fe(OH)2 |
1,0·10–15 |
5 |
Ag2S |
6,0·10–50 |
18 |
Fe(OH)3 |
3,8·10–38 |
6 |
Al(OH)3 |
1,0·10–32 |
19 |
FeS |
5,0·10–18 |
7 |
BaSO4 |
1,1·10–10 |
20 |
HgS |
1,6·10–52 |
8 |
CaCO3 |
5,0·10–9 |
21 |
HgSe |
1,0·10–59 |
9 |
CaC2O4 |
2,0·10–9 |
22 |
MnS |
2,5·10–10 |
10 |
CaF2 |
4,0·10–11 |
23 |
PbBr2 |
9,1·10–6 |
11 |
CaSO4 |
1,3·10–4 |
24 |
PbCO3 |
7,5·10–14 |
12 |
Ca3(PO4)2 |
1,0·10–29 |
25 |
PbS |
1,0·10–27 |
13 |
CdCO3 |
1,0·10–12 |
26 |
ZnS |
1,6·10–24 |
Таблица П3
Константы диссоциации некоторых слабых электролитов в водных растворах при 25 °С
№ |
Соединение |
К |
pK = –lgK |
1 |
HNO2 |
4 · 10–4 |
3,40 |
2 |
NH4OH |
1,8 · 10–5 |
4,75 |
57
|
|
|
|
|
|
Окончание табл. П3 |
|
№ |
Соединение |
|
|
К |
|
|
pK = –lgK |
3 |
Al(OH)3 |
K3 |
= 9,1 |
· 10–10 |
|
9,04 |
|
4 |
H2O |
1,8 |
· 10–16 |
|
|
15,75 |
|
5 |
HCOOH |
1,8 |
· 10–4 |
|
|
3,75 |
|
6 |
CH3COOH |
1,8 |
· 10–5 |
|
|
4,75 |
|
7 |
Ca(OH)2 |
K2 |
= 3,5 |
· 10–2 |
|
1,46 |
|
8 |
H2CO3 |
K1 |
= |
4,5 |
· 10–7 |
|
6,35 |
K2 |
= 4,7 |
· 10–11 |
|
10,33 |
|||
|
|
K1 |
= |
7,5 |
· 10–3 |
|
2,12 |
9 |
H3PO4 |
K2 |
= 6,3 |
· 10–8 |
|
7,20 |
|
|
|
K3 |
= |
1,3 |
· 10–12 |
|
11,89 |
10 |
H2SO4 |
K2 |
= 1,2 |
· 10–2 |
|
1,92 |
|
11 |
H2SO3 |
K1 |
= |
1,6 |
· 10–2 |
|
1,80 |
K2 |
= 6,3 |
· 10–8 |
|
7,21 |
|||
12 |
H2S |
K1 |
= |
6,0 |
· 10–8 |
|
7,22 |
K2 |
= 1,0 |
· 10–14 |
|
14,00 |
|||
13 |
H2SiO3 |
K1 |
= |
2,2 |
· 10–10 |
|
9,66 |
K2 |
= 1,6 |
· 10–12 |
|
11,80 |
|||
14 |
HF |
6,6 |
· 10–4 |
|
|
3,18 |
|
Таблица П4
Стандартные электродные потенциалы в водных растворах при 25 °С
|
№ |
Электрод |
Электродная реакция |
φ°, B |
|
1 |
S/S2–(Pt) |
S + 2e– = S2– |
-0,45 |
|
2 |
NO3–/NO2–, OH–(Pt) |
NO3– + H2O + 2e– = NO2– + 2OH– |
+0,01 |
|
3 |
SO42 –, H+/H2SO3(Pt) |
SO42 – + 4H+ + 2e– = H2SO3 + H2O |
+0,17 |
|
4 |
O2 /4OH–(Pt) |
O2 + 2H2O + 4e– = 4OH– |
+0,40 |
|
5 |
I2 (тв)/2I–(Pt) |
I2 + 2e– = 2I– |
+0,54 |
|
6 |
MnO4–/MnO42–(Pt) |
MnO4– + e‾ = MnO42– |
+0,54 |
|
7 |
MnO4–/MnO2,OH–(Pt) |
MnO4– + 2H2O + 3e– = MnO2 + 4OH– |
+0,59 |
|
8 |
Fe3+/Fe2+(Pt) |
Fe3+ + e– = Fe2+ |
+0,77 |
|
9 |
NO3–, H+/NO(Pt) |
NO3– + 4H+ + 3e– = NO + 2H2O |
+0,96 |
|
10 |
Br2 (ж)/2Br–(Pt) |
Br2 + 2e– = 2Br– |
+1,06 |
|
11 |
O2, H+/H2O(Pt) |
O2 + 4H+ + 4e– = 2H2O |
+1,23 |
|
12 |
Cr2O72–, H+/Cr3+(Pt) |
Cr2O72– + 14H+ + 6e– = 2Cr3+ + 7H2O |
+1,33 |
|
13 |
Cl2 (г)/2Cl– |
Cl2 + 2e– = 2Cl– |
+1,36 |
|
14 |
MnO4–, H+/Mn2+(Pt) |
MnO4– + 8H+ + 5e– = Mn2+ + 4H2O |
+1,51 |
|
15 |
H2O2, H+/H2O(Pt) |
H2O2 + 2H+ + 2e– = 2H2O |
+1,77 |
|
16 |
O3, H+ /O2 |
O3 + 2H+ + 2e– = O2 + H2O |
+2,08 |
|
17 |
F2 (г)/2F– |
F2 + 2e– = 2F– |
+2,87 |
|
58 |
|
|
|
