
2718
.pdf
Рассчитаем массу кислорода по формуле: m(O2) = nэ(O2) · Мэ(O2),
где Мэ(O2) = 1 М(О2) = 8 г/моль.
4
m(O2) = 1,6 · 10–3 · 8 = 12,8 · 10–3 г.
Соответственно окисляемость воды равна: Х(О2) = 12,8 мг/л.
|
Задачи |
|
57. |
Какие из перечисленных соединений могут быть только |
|
окислителями: а) MnO2; б) KMnO4; в) CO; |
г) HNO2; д) H2O2; |
|
е) K2Cr2O7; ж) H2; з) H2S? |
|
|
58. |
Какие из перечисленных ионов могут играть двойную |
|
роль – |
выступать в качестве окислителей и восстановителей: |
|
а) Cr2+; |
б) S2‾; в) Br‾; г) Fe2+; д) NO2‾; |
е) ClO3‾; ж) NH4+; |
з) Pb2+? |
|
|
59. Определите, в каких схемах происходит окисление, а в каких – восстановление: а) SO42‾ → SO32‾; б) NH4+ → NO3‾;
в) CrO2‾ → Cr3+; г) MnO42‾ → MnO4‾; д) Cr2O72‾ → 2CrO42‾.
60. Составьте уравнения реакций методом электронного баланса:
а) HgS + HNO3 + HCl → HgCl2 + S + NO + H2O;
б) CrCl3 + Br2 + KOH → K2CrO4 + KBr + KCl + H2O; в) FeS + HNO3 → Fe(NO3)3 + S + NO2 + H2O.
61. Составьте уравнения полуреакций окисления или восстановления с учетом кислотности среды:
а) кислая среда, NO3‾ → NO2‾; Cr3+ →Сr2О72‾;
б)нейтральнаясреда,SO32‾→ SO42‾; MnO4‾→MnO2; в) щелочная среда, Al → AlO2‾; NO3‾ → NH3.
62. Составьте уравнения реакций методом полуреакций и получите их в ионном виде:
а) Na2MoO4 + HCl + Al → MoCl2 + AlCl3 + NaCl + H2O;
21
б) SnCl2 + K2Cr2O7 + H2SO4 → Sn(SO4)2 + SnCl4 + Cr2(SO4)3 +
+K2SO4 + H2O.
63.Укажите, в каком направлении могут самопроизвольно
протекать следующие реакции:
а) 2H2O + Cl2 = H2O2 + 2HCl;
б) H2SO3 + I2 + H2O = H2SO4 + 2HI.
64.Можно ли в водном растворе восстановить соль железа
(III)до соли железа (II): а) бромидом калия; б) йодидом калия?
65.Окисляемость воды равна 50 мг/л O2. Рассчитайте, какой объем 0,01 н раствора KMnO4 в кислой среде потребуется на титрование 40 мл воды.
66.В воде содержится примесь Na2SO3 в количестве 31,5 мг/л. Определите, чему равна окисляемость воды.
67.В образце воды содержатся примеси 2 мг/л СН4, 5 мг/л H2S, 8 мг/л FeSO4. Определите окисляемость воды, учитывая схе-
мы превращений в результате окисления: СН4 → СО2; H2S → SO2; Fe2+ → Fe3+.
2.2. Жесткость воды и методы ее устранения
Понятие жесткости воды. Единицы измерения жесткости воды. Виды жесткости воды: карбонатная (временная) и некарбонатная (постоянная). Характеристика природных вод по величине общей жесткости (ОЖ). Вредное влияние и ограниченность применения жестких вод в различных хозяйственно-бытовых и технологических процессах. Аналитическое определение жесткости воды. Кальциевая и магниевая жесткость воды, методика их определения.
Специальные методы водоподготовки. Методы умягчения воды: термический, известковый, содово-известковый, фосфатный, ионообменный. Катиониты и аниониты, применяемые для обессоливания воды. Обессоливание воды методом электродиа-
22
лиза, гиперфильтрации (обратный осмос), дистилляции, вымораживания.
Стабилизация воды. Показатель стабильности и индекс стабильности. Агрессивные воды, методы устранения с помощью гидроксида натрия, карбоната натрия, негашеной извести, мрамора. Нестабильные воды и их обработка растворами соляной, серной кислот или насыщение диоксидом углерода.
Корректирование содержания в воде железа, марганца, кремниевой кислоты и фтора. Дезактивация воды.
Пример 1. Анализ пробы воды обнаружил содержание ионов в мг/л:
[Na+] = 69,4; [Ca2+] = 112,6; [Cl‾] = 147,2; [SO42‾] = 63,4.
Выразите концентрации ионов в мг-экв/л и мг-ион/л. Решение. Количество эквивалентов вещества можно рассчи-
тать по формуле
nэ(г-экв) = m(г) / Мэ(г/г-экв).
Эквивалентная масса вещества определяется через молярную массу вещества:
Мэ(Х) = М(1/z Х) = 1/z М(Х),
где 1/z – фактор эквивалентности, в нашем случае z – величина заряда иона.
Мэ[Na+] = 23 г/г-экв; Мэ[Ca2+] = 20 г/г-экв; Мэ[Cl‾] = 35,5 г/г-экв;
Мэ[SO42‾] = 48 г/г-экв. Учитывая, что г/г-экв = мг/мг-экв, опреде-
ляем: [Na+] = 69,4 / 23 = 3,02 мг-экв/л; [Ca2+] = 112,6 / 20 = = 5,63 мг-экв/л; [Cl‾] = 147,2 / 35,5 = 4,15 мг-экв/л; [SO42‾] = = 63,4 / 48 = 1,32 мг-экв/л.
Количество ионов выражают в грамм-ионах причем следует помнить, что 1 г-ион ≡ 1 моль ионов. Соответственно n (г-ион) =
=m (г) / М (г/г-ион); г/г-ион = мг/мг-ион. Рассчитываем [Na+ ] =
=3,02 мг-ион/л; [Ca2+] = 2,82 мг-ион/л; [Cl‾] = 4,15 мг-ион/л;
[SO42‾] = 0,66 мг-ион/л.
23

Пример 2. В 10 л воды содержится 364,7 мг Мg2+ и 501 мг Са2+. Чему равна жесткость этой воды?
Решение. Общая жесткость воды – это суммарное количество мг-экв ионов Са2+ и Мg2+ в 1 л воды. Рассчитаем количество эквивалентов ионов Мg2+ и Са2+ в 10 л воды:
nэ(Мg2+) = 364,7 / 12 = 30,4 мг-экв; nэ(Са2+) = 501 / 20 = 25,0 мг-экв.
Пересчитывая суммарное значение на 1 л воды, получаем:
ОЖ = 5,54 мг-экв/л.
Пример 3. Какую массу карбоната натрия необходимо прибавить к 400 л воды, чтобы устранить жесткость воды, равную 3 мг-экв/л?
Решение. Рассчитаем количество эквивалентов жесткости в 400 л воды:
3 мг-экв/л · 400 л = 1200 мг-экв = 1,2 г-экв.
Такое количество эквивалентов карбоната натрия потребуется для устранения жесткости.
Мэ(Na2CO3) = 53 г/г-экв.
m(Na2CO3) = nэ(Na2CO3) · Мэ(Na2CO3) = 1,2 · 53 = 63,6 г.
Пример 4. В воде содержится [CO2] = 44 мг/л; [НСО3‾] = = 122 мг/л; [Ca2+] = 80 мг/л. Определите стабильность воды.
Решение. Оценку стабильности воды осуществляют на основании сопоставления произведения концентраций реагентов (ПК) со значением константы (К) в условиях равновесия, исходя из уравнения процесса
СаСО3(к) + СО2 + Н2О = Са(НСО3)2,
для которого K [Ca2 ] [HCO3 ]2.
CO2
Значение К при 25 °С можно рассчитать (см. табл. П2 и П3):
24

K ПРCaCO3 K1(H2CO3) 4,79 10 5.
K2 (H2CO3)
Находим, исходя из условия задачи,
|
[Ca2 ] [HCO ]2 |
|
2 10 3 2 10 3 2 |
|
6 |
|
|
ПK |
|
3 |
|
|
8 10 |
|
. |
CO2 |
|
1 10 3 |
|
||||
|
|
|
|
|
|||
Так как ПК < К, реакция будет идти в прямом направлении, а это значит, что концентрация свободной угольной кислоты превышает равновесную, поэтому вода является агрессивной.
Задачи
68. Вода реки Клязьмы содержит в мг-ион/л: а) [Ca2+] = 1,18;
б) [Мg2+] = 0,43; в) [Na+] = 1,09; г) [НСО3‾] = 2,60; д) [SO42‾] = 0,55; е) [Cl‾] = 0,59; ж) [SiO32‾] = 0,22. Выразите концентрации в
мг-экв/л. |
|
[Ca2+] = 2,98; |
69. Вода Волги содержит в |
мг-экв/л: а) |
|
б) [Мg2+] = 1,03; в) [НСО3‾] = 3,0; |
г) [SO42‾] = 1,49; |
д) [Cl‾] = 0,37. |
Выразите концентрации в мг/л. |
|
|
70.Рассчитайте жесткость воды, содержащей в 1 л: а) 1 г хлорида кальция; б) 1 мг-экв нитрата кальция; в) 0,01 моль гидрокарбоната кальция.
71.Определите временную жесткость воды, содержащей в
1л 100 мг: а) гидрокарбоната кальция; б) гидрокарбоната магния.
72.10 л воды пропустили через H-R катионит, при этом выделилось 448 мл СО2 (н.у.). При добавлении соды к воде, прошедшей через катионит, выделяется 1,12 л СО2. Чему равна общая и карбонатная жесткость воды?
73.Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 мл воды, требуется 15 мл 0,08 н раствора HCl.
25
74.Вода, содержащая только сульфат магния, имеет жесткость 7 мг-экв/л. Какая масса сульфата магния содержится в 300 л этой воды?
75.Вычислите общую и карбонатную жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
76.В 100 л воды содержится 8,1 г Са(НСО3)2; 1,46 г Мg(НСО3)2; 5,44 г СаSO4 и 2,4 г МgSO4. Вычислите общую, карбонатную, кальциевую, магниевую жесткость воды.
77.Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия?
78.Какую массу гидроксида кальция надо прибавить к 275 л воды,чтобы устранить еекарбонатную жесткость,равную5,5 мг-экв/л?
79.При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 3,5 мг. Чему равна карбонатная жесткость воды?
80.Рассчитайте массы реагентов, необходимые в содовоизвестковом методе для умягчения 100 м3 воды, общая и временная жесткость которой равны соответственно 5 мг-экв/л и 1,8 мг-экв/л.
81.В фармацевтической промышленности для получения деминерализованной воды используют сильнокислотные катиониты КУ-1 и КУ-2 в Н+-форме и сильноосновные аниониты АВ-171
иАВ-17 в ОН‾-форме. В чем сущность получения деминерализованной воды?
82.Процесс обесфторивания воды осуществляют добавлением к воде смеси фосфата кальция и гидроксида натрия. При этом вначале образуется гидроксифосфат кальция, который затем связывает ионы фтора с образованием осадка – смешанного фторидфосфата кальция. Напишите уравнения происходящих реакций.
83.В одном из методов удаления кремниевой кислоты из воды используется реакция ее взаимодействия с плавиковой кисло-
26
той (HF), в результате сначала образуется тетрафторид кремния, а затем гексафторокремниевая кислота. Последняя легко задерживается на анионите ROH в результате ионообменной реакции. Напишите уравнения всех реакций.
84.Ионы железа (III) из воды можно удалять путем фильтрования воды через катионит кальция, при этом происходит следующая ионообменная реакция: 3СаR + Fe2(SO4)3 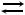 Fe2R3 + 3CaSO4. Определите содержание железа (мг/л) в исходной воде, если в 200 мл воды после прохождения через катионит было обнаружено 0,34 мг ионов кальция.
Fe2R3 + 3CaSO4. Определите содержание железа (мг/л) в исходной воде, если в 200 мл воды после прохождения через катионит было обнаружено 0,34 мг ионов кальция.
85.Удаление марганца (II) из воды сводится к его окислению до четырехвалентного состояния. Для этого воду обрабатывают смесью пиролюзита MnO2 и извести Ca(OH)2, в результате под действием кислорода воздуха образуется манганат кальция CaMnO4, который затем окисляет марганец (II) до MnO2, выпадающий в осадок. Составьте схемы двух окислительновосстановительных реакций и уравняйте их методом электронного баланса.
86.Определите стабильность воды, если анализом установ-
лено, что в воде содержится [CO2] = 1,2·10-3 моль/л; [НСО3‾] =
=1,7 мг-ион/л; [Ca2+] = 3 мг-ион/л.
87.В пробе воды, характеризующейся нестабильностью, содержание [Ca2+] = 196 мг/л, [НСО3‾] = 225,7 мг/л. После добавления в воду соляной кислоты удалось ее стабилизировать, при этом концентрация [CO2] оказалась равной 41,8 мг/л. Выделения газа и образования осадка не наблюдалось. Рассчитайте концентрацию [НСО3‾] в обработанной воде.
2.3. Физико-химические показатели качества воды
Физические показатели воды: температура, запах, вкус, прозрачность, мутность, цветность, плотность. Методика определения качественных и количественных характеристик, требования
27

ГОСТа, предъявляемые к физическим показателям для питьевой воды.
Химические показатели воды. Санитарно-химический анализ содержания в воде компонентов: молекулярный кислород, свободный хлор, активная реакция среды pH; общая кислотность и щелочность; ионы Ca2+, Мg2+, Fe2+, Fe3+, Mn2+, Al3+, Na+, K+, Cl‾, SO42‾, PO43‾, F‾, I‾; азотосодержащие вещества – аммонийные соли (NH4+), нитриты и нитраты; жесткость воды; углекислота; диоксид кремния; сероводород; ионы тяжелых металлов – Pb2+, Cu2+, Zn2+, Sn2+; органические вещества. Значения ПДК и требования к качеству воды в зависимости от ее целевого назначения: хозяйственно-питьевая, охлаждающая, для паросилового хозяйства, техническая, поливная.
Пример 1. В питьевой воде обычно содержание ионов F– составляет 0,7–1,0 мг/л. Сколько фторида натрия следует добавить в не содержащую фтор воду, чтобы его содержание отвечало норме? Достигается ли требуемое содержание фтора в питьевой воде при пропускании над кристаллами фторида кальция?
Решение. Пересчет на массу фторида натрия можно осуществить по формуле:
m(NaF) = m(F–) · M(NaF) / M(F–) = (0,7…1,0) · 42 / 19 = = 1,5…2,2 мг/л.
Гетерогенное равновесие СaF2(тв) = Ca2+ + 2F– характеризует-
ся величиной ПРCaF2 = 4·10–11 (см. табл. П2). Обозначим раство-
римость соли CaF2 в насыщенном растворе через s, моль/л, тогда [Ca2+] = s, [F–] = 2s. Подставив значения в исходное уравнение, получаем:
s (2s)2 = 4 · 10–11; s = 3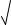 10 11 = 2,15 · 10–4 моль/л; [F–] = 2 · 2,15 · 10–4 = 4,3 · 10–4 моль/л,
10 11 = 2,15 · 10–4 моль/л; [F–] = 2 · 2,15 · 10–4 = 4,3 · 10–4 моль/л,
28
в единицах массы это составит: 4,3 · 10–4 · 19 = 8,17 · 10–3 г/л = = 8,17 мг/л. Полученное значение на порядок превышает норму содержания ионов F– в питьевой воде.
Задачи
88.В два совершенно одинаковых сосуда налили по 500 мл водопроводной и кипяченой воды и поместили в холодильник. Объясните, почему быстрее замерзает кипяченая вода.
89.Оптимальный температурный диапазон питьевой воды равен 7–11 °С. В соответствии с этим определите значения допустимых соотношений объемов при смешивании двух водопотоков с температурами 15 °С и 5 °С.
90.Назовите нормативы ГОСТа, предъявляемые к питьевой воде по запаху, вкусу, цветности, прозрачности.
91.Присутствие в воде сульфата магния с концентрацией, не превышающей 200 мг/л, не вызывает каких-либо вкусовых ощущений, при концентрациях более 500 мг/л появляется горький вкус. Рассчитайте массу гидроксида бария, которую необходимо прибавить к 0,2 м3 воды, содержащей 700 мг/л MgSO4, чтобы устранить вкус до нижнего предела обнаружения.
92.Почему морская вода, как правило, прозрачнее речной?
93.Дайте краткую характеристику состава следующих видов
природной воды: а) дождевая; б) речная; в) поверхностная; г) морская; д) минеральная; е) кристаллизационная.
94.Почему электропроводность дистиллированной воды намного меньше электропроводности природной воды?
95.При определении общей жесткости воды комплексометрическим методом на титрование 50 см3 исследуемой воды было израсходовано 7,2 см3 0,05 н раствора трилона. Чему равна общая жесткость воды?
29
96.Сточные воды травильного цеха содержат серную кислоту с концентрацией 3,8 г/л. Сколько негашеной извести, г/л, потребуется для нейтрализации кислоты?
97.Зола морских водорослей содержит в среднем 0,3 % йода. Сколько тонн золы следует переработать, чтобы получить 12 кг йода?
98.Для определения содержания железа в воде были приготовлены в мерных колбах емкостью 50 мл два раствора – стандартный и исследуемый. Для приготовления стандартного раствора взяли 8 мл раствора, содержащего ионы Fe3+ со значением титра ТFe = 0,01 мг/мл, а для приготовления исследуемого раствора – 25 мл исходной воды. После добавления соответствующих реактивов определили на фотоколориметре в одинаковых условиях значения оптических плотностей растворов: Dст = 0,65; Dиссл = 0,62. Вычислите концентрацию железа, мг/л, в исследуемом растворе и в исходной воде.
99.ПДК алюминия в питьевой воде определена по ГОСТу в 0,5 мг/л. В обычных условиях городская водопроводная вода со-
держит 0,02–0,2 мг/л алюминия. Величина ПРAl(OH)3 имеет очень низкое значение, тем не менее путем приливания в воду раствора щелочи обнаружить алюминий по образованию осадка Al(OH)3 не удается. Объясните почему. В какой форме алюминий содержится в воде?
100.ПДК хлорид-ионов в питьевой воде по ГОСТу составляет 350 мг/л. Обычно в городской водопроводной воде содержится 10–20 мг/л хлорид-ионов. Удастся ли добавлением нитрата серебра обнаружить хлорид-ионы в питьевой воде?
101.В соответствии с санитарными нормами в питьевой воде величины ПДК, мг/л, составляют: Pb2+ – 0,3; Cd2+ – 0,03; Cu2+ – 3,0. Вычислите, без учета процессов гидролиза, необходимую и
30
