
2718
.pdfПример 4. Как изменится скорость прямой реакции
2NО(г) + О2(г) = 2NО2(г),
если: а) увеличить давление в системе в 3 раза; б) уменьшить объем системы в 2 раза; в) повысить концентрацию NО в 3 раза?
Решение. Выражение закона действия масс для прямой реакции
V = k1 · NО 2 · О2 .
а) Так как P = СRТ, то при постоянной температуре увеличение давления в 3 раза равносильно увеличению концентраций газообразных веществ в 3 раза:
V1 = k1 · (3 NО )2 · (3 О2]) = 27 · k1 · [NО]2 · [О2] = 27V ,
скорость реакции возрастает в 27 раз.
б) Поскольку C = n/V, то при уменьшении объема системы в 2 раза концентрации веществ увеличивается в 2 раза, тогда:
V2= k1 · (2 NО )2 · (2 О2]) = 8 · k1 · [NО]2 · [О2] = 8V ,
скорость реакции возрастает в 8 раз.
в) При увеличении концентрации NО в 3 раза
V3= k1 · (3 [NО])2 · [О2] = 9 · k1 · [NO]2 · [O2] = 9V ,
скорость реакции возрастает в 9 раз.
Пример 5. Энергия активации некоторой реакции равна 100 кДж/моль. Как изменится скорость реакции при повышении температуры от 280 до 300 К? Чему равен температурный коэффициент скорости реакции?
Решение. Используя уравнение Аррениуса k Ae Eакт / RT , рассчитаем :
ln |
V300 |
ln |
k300 |
|
Eакт |
( |
1 |
|
1 |
) |
100 20 |
2,865; |
|
|
|
|
300 |
|
8,31 10 3 300 280 |
||||||||
V |
|
k |
280 |
|
R |
|
280 |
|
|||||
280 |
|
|
|
|
|
|
|
|
|
|
|
||
V300 / V280 = 17,54, скорость реакции возрастает в 17,5 раза.
11

По уравнению Вант-Гоффа V |
/V (t2 t1)/10 , подставляя |
t2 |
t1 |
соответствующие значения, определяем температурный коэффи-
циент скорости реакции γ = 
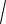 17,5 = 4,19.
17,5 = 4,19.
Пример 6. В реакции 2SO2(г) + О2(г)  2SО3(ж) установилось равновесие. Какое влияние на равновесие окажут: а) увеличение давления; б) уменьшение концентрации триоксида серы?
2SО3(ж) установилось равновесие. Какое влияние на равновесие окажут: а) увеличение давления; б) уменьшение концентрации триоксида серы?
Решение. а) Увеличение давления в системе смещает равновесие в сторону меньшего числа газообразных частиц. Слева три газообразные частицы, справа – ноль, значит равновесие сместится вправо.
б) Изменение концентрации SО3 не окажет влияния на смещение равновесия, так как SО3(ж) представляет собой индивидуальную жидкую фазу в газовой системе.
Задачи
21.Объясните, почему при взбалтывании бензола в воде наблюдается быстрое расслаивание жидкостей, а при взбалтывании указанных жидкостей в присутствии мыла получается устойчивая эмульсия. Какую роль играют молекулы мыла C17H35COONa? Дайте схему капельки эмульсии бензола в воде.
22.Давление пара водного раствора глицерина C3H8O3 составляет 98 % от давления пара воды при той же температуре. Вычислите процентную концентрацию глицерина в растворе и температуру замерзания раствора.
23.При какой температуре будет замерзать 40%-й водный раствор этилового спирта?
24.В скольких молях воды следует растворить 0,02 моль некоторого неэлектролита для получения раствора, температура кипения которого 100,026 °С?
12
25.Осмотическое давление некоторого раствора при –3 °С составляет 2 735 кПа. При какой температуре осмотическое давление достигнет 3 040 кПа?
26.Раствор, содержащий 33,2 г Ba(NO3)2 в 300 г воды, кипит при 100,466 °С. Вычислите кажущуюся степень диссоциации соли в растворе.
27.Напишите уравнение электролитической диссоциации
следующих электролитов: а) FeCl2; б) KH2PO4; в) Mn(OH)2;
г) CaOHCl; д) H2S.
28.Напишите уравнения реакций в молекулярной и ионной формах между следующими веществами: а) CaCl2 и Na3PO4;
б) CuS и HCl; в) FeCl3 и NH4OH.
29.Допишите уравнения и получите сокращенные ионные уравнения:
а) Na3PO4 + HCl → … ;
б) Pb(NO3)2 + K2S → … ;
в) Cr(OH)3 + NaOH → … .
30. Составьте по два уравнения в молекулярной форме, которые соответствуют каждому из уравнений в сокращенной ионной форме:
а) CO32– + 2H+ = CO2 + H2O;
б) HSO3– + OH– = SO32– + H2O; в) Ca2+ + 2F– = CaF2.
31.Вычислите значения активности ионов K+ и SO42– в 0,01 М растворе K2SO4.
32.1 л раствора содержит по 0,01 моль Ca(NO3)2 и CaCl2. Вычислите ионную силу и активность ионов в растворе.
33.Рассчитайте значения коэффициентов активности ионов
Cl–, SO42–, PO43– в растворе с ионной силой 0,0001.
34. Напишите выражения закона действия масс для прямой и обратной реакций:
13

а) 2H2(г) + O2(г) 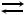 2H2O(г);
2H2O(г);
б) Н2(г) + I2(к) 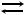 2НI(г);
2НI(г);
в) NН3(г) + НСl(г)  NН4Сl(к).
NН4Сl(к).
35.Как изменится скорость прямой реакции 2А(г) + В(г) = А2В(г), если концентрацию вещества А уменьшить в 2 раза, а концентрацию вещества В увеличить в 3 раза?
36.Во сколько раз следует увеличить давление, чтобы скорость прямой реакции 2NO + O2 = 2NO2 возросла в 729 раз?
37.Каково значение энергии активации реакции, скорость которой при 300 К в 10 раз больше, чем при 280 К?
38.Напишите выражения для констант равновесия процессов:
а) 2СО |
СО2 + С; |
|
б) 4НСl(г) + О2 |
2Н2О(г) + 2Сl2(г); |
|
в) 3Fe + 4Н2О(г) |
Fe3О4 + 4Н2. |
|
39. Как повлияет давление на равновесие следующих обра- |
||
тимых реакций: |
|
|
а) Н2(г) + CO2(г) |
CO(г) + H2O(г); |
|
б) PCl5(г) |
PCl3(г) + Cl2(г); |
|
в) Fe + Н2О(г) |
FeО + Н2? |
|
40.Реакция протекает по уравнению А + В 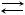 2С. Константа равновесия равна 4. Найдите равновесные концентрации веществ, если исходные концентрации СА = 5 моль/л; СВ = 4 моль/л. Рассмотрите отдельно два случая, когда: а) А, В, С – газы; б) A, B – газы, С – твердое вещество.
2С. Константа равновесия равна 4. Найдите равновесные концентрации веществ, если исходные концентрации СА = 5 моль/л; СВ = 4 моль/л. Рассмотрите отдельно два случая, когда: а) А, В, С – газы; б) A, B – газы, С – твердое вещество.
41.Реакция протекает по уравнению А2 + В2 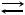 2АВ. Определите значение константы равновесия, если равновесные концентрации равны: [А2] = 0,25 моль/л; [В2] = 0,2 моль/л; [АВ] = 0,3 моль/л.
2АВ. Определите значение константы равновесия, если равновесные концентрации равны: [А2] = 0,25 моль/л; [В2] = 0,2 моль/л; [АВ] = 0,3 моль/л.
1.3. Кислотность и щелочность водных растворов
Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель pH водных растворов. Кислотно-
14
основные индикаторы: лакмус, фенолфталеин, метилоранж, их применение и принцип действия. Инструментальный метод определения величины pH растворов.
Понятие об активной (свободной) и общей кислотности и щелочности водных растворов, аналитическое определение этих величин.
Вычисление pH растворов сильных и слабых кислот и оснований. Буферные системы и их роль в различных природных процессах. Свойства буферных растворов. Вычисление значений pH буферных систем.
Гидролиз солей. Три типа гидролиза солей. Ступенчатый гидролиз многозарядных ионов. Факторы, оказывающие влияние на смещение равновесия гидролиза. Степень гидролиза, константа гидролиза. Вычисление pH растворов солей через константу гидролиза и концентрацию соли.
Пример 1. Вычислите общую и активную кислотность водного раствора HF, имеющего значение pH = 3,30.
Решение. Определим активную кислотность раствора: –lg[H+] = 3,30, [H+] = 5,01 · 10–4 моль/л.
Запишем уравнение диссоциации HF в водном растворе: HF  H+ + F–. Учитывая, что [H+] = [F–], и используя значение константы диссоциации (см. табл. П3), можно записать:
H+ + F–. Учитывая, что [H+] = [F–], и используя значение константы диссоциации (см. табл. П3), можно записать:
[H ] [F ] |
6,6 10 4; [HF] = |
(5,01 10 4)2 |
||
|
|
|
= 3,8 · 10–4 моль/л. |
|
HF |
|
6,6 10 4 |
||
Теперь находим общую кислотность раствора:
CHF = [H+] + [HF] = 5,01 · 10–4 + 3,8 · 10–4 = 8,81 · 10–4 моль/л.
Пример 2. Рассчитайте pH буферного раствора, содержащего в 1 л 0,1 моль CH3COOH и 0,2 моль CH3COONa.
15

Решение. pH буферного раствора, состоящего из кислоты и ее
соли, рассчитывается по формуле pH = pK + lgСс . Для уксусной
Ск
кислоты рК = 4,76 (см. табл. П3), по условию задачи Сс = 0,2 моль/л,
Ск = 0,1 моль/л. Определяем pH = 4,76 + lg0,2 = 4,76 + 0,30 = 5,06. 0,1
Пример 3. Напишите в молекулярном и ионном виде уравнения гидролиза хлорида аммония. Рассчитайте значения константы гидролиза, степени гидролиза и pH для 0,03 М раствора хлорида аммония.
Решение. Уравнения гидролиза соли:
NH4Cl + HOH = NH4OH + HCl;
NH4+ + HOH = NH4OH + H+.
Напишем выражение для константы гидролиза соли и рассчитаем ее значение:
Kг = |
NH4OH [H ] |
NH4OH [H ] [OH ] |
= |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
OH |
|
|||||
|
|
NH4 |
|
|
|
|
NH4 |
|
|||||
= |
K |
|
|
|
10 14 |
5,56 10 10. |
|
|
|
||||
W |
|
|
|
|
|
|
|
|
|||||
|
|
1,8 10 5 |
|
|
|
||||||||
|
|
KNH4OH |
|
|
|
|
|
||||||
Обозначим [NH4OH] = [H+] = x, тогда [NH4+] = c – x. Принимая допущение, что гидролизу подвергается незначительная часть соли (h << 1), можно записать: с – х ≈ с. Рассчитываем x:
Кг = cx2x, x 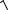
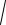 Кг c
Кг c 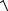
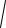 5,56 10 10 3 10 2 4,08 10 6.
5,56 10 10 3 10 2 4,08 10 6.
Поскольку 4,08 · 10–6 << 3 · 10–2, это подтверждает справедливость принятой гипотезы, что х << с. Теперь рассчитываем h:
h = х / с = 4,08 · 10–6 / 3 · 10–2 = 1,36 · 10–4; [H+] = 4,08 · 10–6 моль/л;
pH = –lg(4,08 · 10–6) = 5,39.
16
Задачи
42.Вычислите pH раствора, в котором [H+] = 3,4 · 10–4 моль/л.
43.Определите концентрацию [OH‾] в растворе, pH которого равен 2,32.
44.Рассчитайте общую и активную кислотность и pH раство-
ров: а) 0,01 М HCl; б) 0,0002 М H2SO4; в) 0,15 М СH3COOH.
45.Рассчитайте общую и активную щелочность и pH раство-
ров: а) 0,01 М NaOH; б) 0,0005 М Ca(OH)2; в) 0,03 М NH4OH.
46.К 1 л чистой воды прибавили 1 каплю концентрированного 94%-го раствора азотной кислоты. Рассчитайте активную кислотность и pH образовавшегося раствора. 1 мл = 20 капель; плотность концентрированного раствора азотной кислоты 1,5 г/мл; азотная кислота в конечном растворе диссоциирована полностью.
47.К 1 л чистой воды при 25 °С прибавили 1 каплю крепкого 44%-го раствора гидроксида калия. Рассчитайте общую щелоч-
ность и активную кислотность полученного раствора. 1 мл = = 20 капель; плотность исходного раствора щелочи 1,46 г/мл; в конечном растворе щелочь диссоциирована полностью.
48.Дистиллированная вода, находящаяся в соприкосновении
своздухом, содержит в 1 л 1,2 · 10–5 моль CO2. Вычислите общую кислотность и pH водного раствора, учитывая только первую ступень диссоциации угольной кислоты и предполагая, что весь растворенный CO2 находится в виде кислоты.
49.Вычислите pH аммиачного буферного раствора, содержащего 2 моль/л NH4OH и 0,3 моль/л NH4NO3.
50.Вычислите pH фосфатного буферного раствора, содержащего в 1 л 0,1 моль Na2HPO4 и 0,3 моль KH2PO4.
51.Какое количество NH4Cl следует добавить к 100 мл 0,1 н раствора NH4OH для того, чтобы концентрация ионов OH‾ в растворе стала численно равна константе диссоциации NH4OH?
17
52. Составьте ионные и молекулярные уравнения гидролиза по I ступени солей в растворах: а) FeSO4; б) NaCN; в) Pb(NO3)2;
г) CrCl3; д) Cu(NO3)2; е) Na2SiO3; ж) Pb(CH3COO)2.
53.Какие из солей подвергаются гидролизу: а) K2S; б) FeCl3; в) K2SO4; г) NaNO3; д) ZnSO4? Составьте ионные и молекулярные уравнения гидролиза по I ступени и определите характер среды (pH больше или меньше 7).
54.Вычислите значения pH и степени гидролиза 0,1 М раствора NaF.
55.Рассчитайте значение константы гидролиза, степень гидролиза и pH для 0,1 М раствора Nа2HPO4.
56.Вычислите значения pH и степени гидролиза 0,05 М раствора NH4NO2.
Модуль 2. ХАРАКТЕРИСТИКА ПРИРОДНЫХ ВОД (27 баллов)
2.1. Окислительно-восстановительные процессы
Степень окисления. Процессы окисления и восстановления. Окислители и восстановители. Типы окислительно-восстанови- тельных реакций. Влияние характера среды на протекание окис- лительно-восстановительной реакции. Составление уравнений окислительно-восстановительных реакций, метод электронного баланса и метод полуреакций.
Окислительно-восстановительные потенциалы. Направленность протекания окислительно-восстановительных реакций.
Окисляемость воды. Химическое потребление кислорода (ХПК) в качестве характеристики степени загрязнения природной воды.
Пример 1. При взаимодействии перманганат-иона с перекисью водорода в кислой среде образуется катион марганца (II) и выделяется молекулярный кислород. Составьте схему реакции в
18

ионном виде и уравняйте с помощью метода электронного баланса или метода полуреакций.
Решение. Составим схему реакции в ионном виде: MnO4‾ + H2O2 + H+ → Mn2+ + O2 + H2O.
а) Метод электронного баланса. В реакции марганец восстанавливается, понижая степень окисления от +7 до +2, а кислород окисляется, его степень окисления повышается от –1 до 0. Составим электронные уравнения и определим коэффициенты:
Mn7+ + 5e‾ → Mn2+ |
|
2 |
|
||
2О1‾ – 2e‾ → 2О0 |
|
5 |
Подставляем эти коэффициенты в схему: 2MnO4‾ + 5H2O2 + H+ → 2Mn2+ + 5O2 + H2O.
Слева 18 атомов кислорода, поэтому справа перед молекулами воды добавляем коэффициент 8. Чтобы уравнять атомы водорода, необходимо слева перед ионами H+ поставить коэффициент 6. В результате получаем:
2MnO4‾ + 5H2O2 + 6H+ = 2Mn2+ + 5O2 + 8H2O.
б) Метод полуреакций. Для превращения MnO4‾ → Mn2+ необходимо связать четыре атома кислорода, что осуществляется с помощью ионов водорода: MnO4‾ + 8H+ → Mn2+ + 4H2O. Справа суммарный заряд равен +2, значит, в левую часть необходимо добавить пять электронов: MnO4‾ + 8H+ + 5e‾ = Mn2+ + 4H2O. Аналогично в схеме H2O2 → O2 необходимо в правой части добавить два иона H+, а в левой отнять два электрона: H2O2 – 2e‾ = O2 + 2H+. Далее, умножая обе полуреакции на коэффициенты таким образом, чтобы количество принятых электронов было равно количе-
ству отданных, получаем: |
|
|
MnO4‾ + 8H+ + 5e‾ = Mn2+ + 4H2O |
|
2 |
|
||
H2O2 – 2e‾ = O2 + 2H+ |
|
5 |
|
2MnO4‾ + 16H+ + 5H2O2 = 2Mn2+ + 8H2O + 5O2 + 10H+ .
19

В окончательном виде получается уравнение
2MnO4‾ + 6H+ + 5H2O2 = 2Mn2+ + 5O2 + 8H2O.
Пример 2. Установите, в каком направлении возможно самопроизвольное протекание реакции
2NaCl + Fe2(SO4)3 = 2FeSO4 + Cl2 + Na2SO4.
Решение. Запишем уравнение реакции в ионно-молекулярной форме:
2Cl‾ + 2Fe3+ = 2Fe2+ + Cl2.
Используем значения стандартных окислительно-восста- новительных потенциалов, участвующих в реакции веществ (см. табл. П4):
Cl2 |
+ 2e‾ = 2Cl‾, |
o |
= 1,36 В; |
|
|
1 |
|
Fe3+ + e‾ = Fe2+, |
2o |
= 0,77 В. |
|
Поскольку o > |
o , то окислителем в реакции будет молеку- |
||
1 |
2 |
|
|
ла хлора, а восстановителем – ион Fe2+, соответственно реакция самопроизвольно протекает справа налево.
Пример 3. На титрование 250 мл воды при подкислении было затрачено 20 мл 0,02 н раствора KMnO4. Чему равна окисляемость воды?
Решение. Окисляемость воды определяется числом миллиграммов O2, затрачиваемым на окисление примесей, содержащихся в 1 л воды. Рассчитаем количество эквивалентов KMnO4, израсходованных на титрование 1 л воды:
0,25 л воды |
– |
0,02 · 0,02 моль эквивалентов KMnO4 |
1 л воды |
– |
х |
х = 0,0004 / 0,25 = 1,6 · 10–3 моль эквивалентов KMnO4.
Такое же количество эквивалентов кислорода O2 было бы израсходовано, если его использовать в качестве окислителя:
O2 + 4H+ + 4e‾ = 2H2O.
20
